隐球菌性脑膜炎患者外周血中Th9和Th17细胞水平变化及意义
雷文知 桑军军 潘炜华 廖万清
(上海长征医院皮肤病与真菌病研究所全军真菌病重点实验室第二军医大学附属长征医院皮肤科,上海 200003)
隐球菌性脑膜炎是由隐球菌引起的中枢神经系统感染性疾病,该病预后严重,死亡率高。随着实体器官移植术的广泛开展,免疫抑制剂的大量使用以及HIV感染者的逐步增多,隐球菌性脑膜炎的发病率逐年上升。在HIV感染患者中,并发隐球菌性脑膜炎后3个月内的平均死亡率高达65.2%[1],在器官和骨髓移植人群中的死亡率亦高达50%。所以隐球菌感染与机体免疫的相互作用一直是研究的热点。
Th9和Th17是近年来新发现的CD4+T辅助细胞亚群,研究认为Th9细胞是促炎细胞,在一些自身免疫病和变态反应性疾病模型中具有促进炎症发展的作用[2]。Th17主要分泌 IL-17,它在炎症和自身免疫方面也起着很重要的作用,在结核分枝杆菌感染中Th17细胞及其相关细胞因子发挥重要致炎作用[3]。但Th9和Th17是否在真菌感染中的免疫机制中发挥作用目前仍缺乏相关研究,由于Th17细胞也可以促进IL-9的分泌[2],且Th9和Th17具有相同的刺激分化因子TGF-β[4],这两者之间是否存在协同致炎作用也有待研究。本实验的目的在于通过比较Th9和Th17细胞在隐球菌性脑膜炎患者和健康对照外周血CD4+T细胞中的表达水平并分析两者相关性,初步探讨Th9和Th17免疫途径在隐球菌脑膜炎发病机制中的作用。
1 资料与方法
1.1 研究资料
研究对象 选择自2013年4月~2014年2月在上海长征医院及华山医院住院治疗的隐球菌脑膜炎患者12例,其中男10例,女2例,年龄为23~61岁,平均43.4岁,所有患者均为初诊患者,病程7~40 d,平均17.8 d,第1次抽血前均未接受过抗真菌治疗(A组),第2次抽血为治疗后3周 (B组)。患者临床表现为头痛、呕吐、发热等,脑脊液墨汁涂片发现隐球菌,脑脊液真菌培养为隐球菌生长或脑脊液乳胶凝集滴度大于1∶8,符合隐球菌性脑膜炎诊断标准。健康对照组12例(C组),其中男10例,女2例,年龄为26~63岁,平均43.3岁,均来自本院体检健康者,两组之间年龄、性别无统计学差异。入组者均签订知情同意书。
疗效评估及治疗好转患者选择标准 治愈为临床症状消失,脑脊液培养连续3次 (每周1次)为阴性;好转为临床症状明显改善,脑脊液墨汁染色隐球菌计数减少,脑脊液乳胶凝集滴度下降,脑脊液培养隐球菌生长时间延长;无效是指临床症状无明显改善,脑脊液墨汁染色隐球菌计数无明显变化,培养仍阳性。按照美国IDSA2010年颁布的隐球菌病治疗指南[5]隐球菌性脑膜炎的诱导治疗分为2周和4周,我们既往治疗观察隐球菌性脑膜炎患者好转的时间多为2~4周,所以本实验选择治疗后3周为第2次采血点及疗效评估点。此次观察的12例隐球菌性脑膜炎患者在治疗3周后评定为好转以上的病例为8例,无效者为4例。
1.2 方法
标本采集及制备 用肝素钠抗凝管采取静脉血5 mL,2 h内分离外周血单核细胞 (PBMC),用RPMI 1640(含10%热灭活FBS)重悬单个核细胞,用台盼兰染色计数活细胞数在95%以上,调节细胞浓度为2×106细胞/mL。
流式细胞学检测 取上述标本500 μL,加入250×佛波醇乙酯(PMA)/离子霉素2 μL和250*莫能霉素/布雷菲德菌素 (BFA)2 μL混匀,37℃,5%CO2培养箱培养5 h,将培养好的细胞分成100 μL/管,分别加入CD3/CD8抗体,4℃避光孵育30 min,加入FIX/PERM破膜剂A 100 μL室温孵育15 min,加入3 mL染色缓冲液300 g离心5 min后收集细胞,加入 FIX/PERM破膜剂 B 100 μL和 IL-17A抗体,混匀,室温孵育20 min,加入3 mL染色缓冲液300 g离心5 min后收集细胞,0.5 mL PBS重悬后立即上机。1.3 统计学方法
统计学处理采用SPSS 13.0。计量资料以(±s)表示,组间外周血Th9与Th17细胞比率比较采用独立样本t检验,多样本的相关性分析采用pearson双变量相关性分析方法,P<0.05为有统计学差异。
2 结 果
2.1 隐球菌性脑膜炎患者治疗前后和健康对照CD4+T细胞中Th9、Th17的比值
与正常对照相比,隐球菌性脑膜炎患者治疗前CD4+T细胞中Th9细胞的比值与健康对照相比无显著性差异,Th17细胞的比值较健康对照降低,P<0.01;隐球菌性脑膜炎患者治疗后Th9细胞的比值较前明显升高,与治疗前及健康对照相比均有显著性差异,P<0.05,Th17细胞较治疗前显著性升高,P<0.01,但与健康对照相比差异无统计学意义 (见表1、图1)。
2.2 治疗好转的隐球菌性脑膜炎患者治疗前后和健康对照CD4+T细胞中Th9、Th17的比值
评价为好转的患者CD4+T细胞中Th9细胞的比值变化与整体患者的比值变化表现出同样的趋势;Th17细胞的比值在治疗后明显上调,与治疗前及健康对照相比均有显著性差异,P<0.01(见表 2、图2)。
2.3 治疗无效的隐球菌性脑膜炎患者治疗前后和健康对照CD4+T细胞中Th9、Th17的比值
治疗无效的患者CD4+T细胞中Th9细胞的比值无论是在治疗前还是治疗后于健康对照相比均无显著性差异;Th17细胞的比值无论是在治疗前还是治疗后与健康对照相比均显著性降低,两者之间差异无统计学意义 (见表3、图3)。
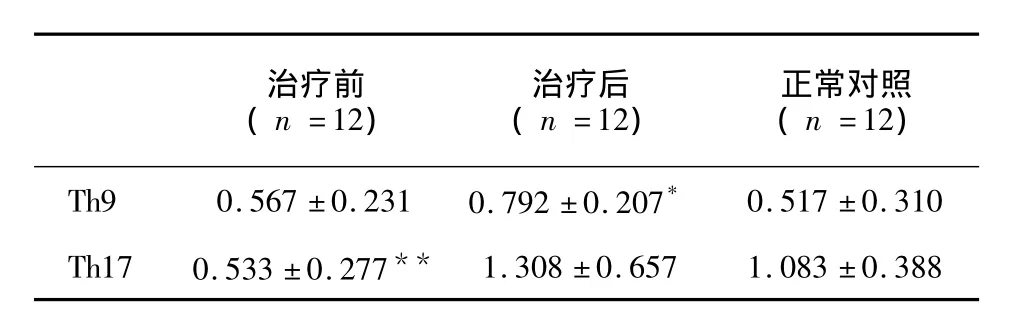
表1 隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值Tab.1 The ratios of Th9 and Th17 cells in CD4+T cells among CM patients group before and after treatment and the normal group
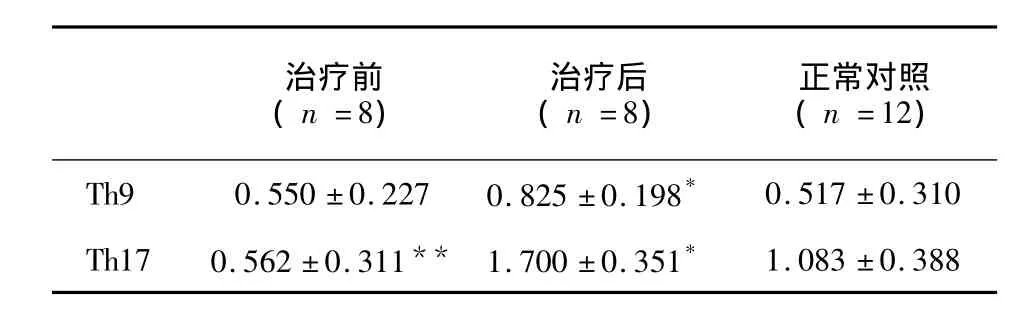
表2 治疗好转的隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值Tab.2 The ratios of Th9 and Th17 cells in CD4+T cells among improved CM patients group before and after treatment and the normal group
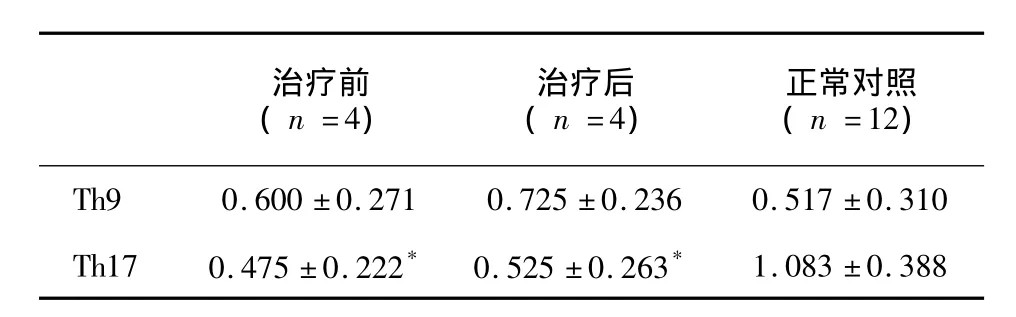
表3 治疗无效的隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值Tab.3 The ratios of Th9 and Th17 cells in CD4+T cells among CM patients who resistant to treatment before and after treatment and the normal control
2.4 Th9和Th17细胞比值的相关性分析
无论是在整体患者或是治疗好转患者治疗后Th9和Th17细胞比值之间有正相关趋势,但两者相关性统计学分析均无统计学意义,P>0.05(见图4)。
3 讨 论
隐球菌性脑膜炎好发于青壮年,在AIDS患者中发病率极高,该病起病隐匿,由于缺乏早期、特异的诊断方法和高效、低毒的抗真菌药物,死亡率和致残率高,深入了解隐球菌性脑膜炎患者感染隐球菌后的免疫反应机制、寻找新的治疗方法对降低隐球菌性脑膜炎的发病率和死亡率有至关重要的意义。
普遍的观点认为天然免疫是机体抵抗隐球菌侵入的第一道防线,但近期有学者研究发现巨噬细胞吞噬隐球菌后并不能有效杀死病菌,反而会促进隐球菌在体内的播散[6],而特异性的细胞免疫却在抵抗隐球菌侵袭中发挥着重要作用[7]。其中T淋巴细胞免疫在清除隐球菌感染方面至关重要[8]。宿主细胞免疫系统可以通过释放细胞因子调节巨噬细胞清除病原体的能力。
近年来的研究发现打破了以往认为CD4+T细胞仅有 Th1和 Th2两个亚群的学说,Dardalhon[9]在2008年率先提出了一种以分泌IL-9、IL-10为主的新型效应性CD4+T细胞,定义为Th9细胞亚群,其在自身免疫性疾病、微生物感染、过敏性疾病中起作用,在大肠炎小鼠模型中,若注入Th9细胞,可以导致结肠炎症的加剧,表明Th9细胞具有促炎作用。在肝炎病毒感染患者中,Th9细胞的高表达不利于丙型肝炎病毒的清除[10]。而Th17细胞亚群主要分泌IL-17,与多种炎症疾病和自身免疫病发病密切相关。Zelante[11]研究发现在白念珠菌及烟曲霉菌感染的小鼠模型中,Th17和IL-23旁路通过抑制Th1的保护性免疫而促进真菌感染后的炎症发生,同时实验表明若阻断Th17和IL-23的表达可以增加小鼠对于白念珠菌及烟曲霉的免疫耐受性,所以认为Th17在抗真菌感染中起促进作用。但是Khader的研究持相反的观点[12],他成功建立了结核分枝杆菌感染小鼠模型,认为抗结核分枝杆菌疫苗的作用机制是通过诱导CD4+T细胞中IL-17的表达,激发CXCL9/CXCL10等炎症相关细胞因子的表达,从而诱导产生干扰素-γ,而抑制细菌的生长。Murdock在肺部隐球菌感染小鼠模型中的研究中也认为Th17细胞增高对清除隐球菌感染具有积极的作用[13]。
我们的实验数据发现,隐球菌性脑膜炎患者在治疗前CD4+T细胞中Th9细胞的比值与正常对照相比无统计学差异,但Th17细胞的比值与健康对照相比明显下调,经过治疗后,Th9和Th17细胞的比值均明显升高,以Th17的升高更为明显,且在治疗好转的患者中差异更大,而治疗无效的患者Th9和Th17细胞的比值在治疗前后均无统计学差异。我们推测,Th17细胞介导的免疫通路对于隐球菌性脑膜炎患者有效清除隐球菌的感染起重要作用,而Th17细胞的缺乏或者不应答是导致隐球菌性脑膜炎患者中隐球菌产生免疫逃逸的重要突破口。在小鼠实验中也发现IL-17A缺陷小鼠具有较低的真菌清除能力[13]。有研究发现,Th17细胞在特定条件下也能大量分泌IL-9,正向调节Th9细胞的产生[14]。在体外培养中也发现,Th17细胞的减少可能导致IL-9和IL-9受体的衰减[15]。我们实验也观察到,随着Th17细胞比值的升高,Th9细胞在治疗后的隐球菌性脑膜炎患者中比值也与健康对照相比有明显上调,为分析此次实验中Th9细胞比值的上调是否与Th17细胞相关,我们对治疗后Th9和Th17细胞比值进行相关性分析,但无论是在治疗好转或无效的患者中均未发现两者的显著相关性。这可能与我们此次实验中观察的病例数较少有关。
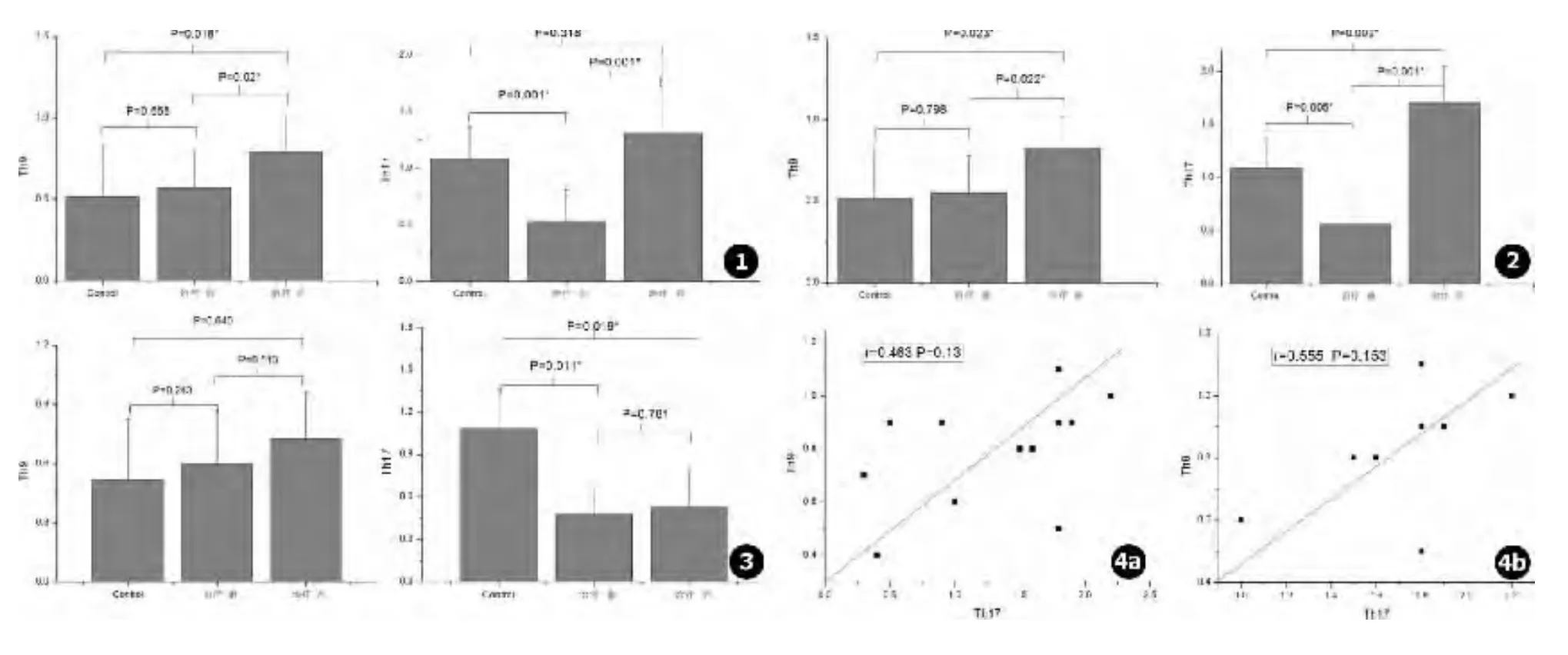
图1 隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值 图2 治疗好转的隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值 图3 治疗无效的隐球菌性脑膜炎患者治疗前后和正常对照CD4+T细胞中Th9、Th17的比值图4 a.隐球菌性脑膜炎患者治疗后Th9和Th17比值相关性分析,b.治疗好转的隐球菌性脑膜炎患者治疗后Th9和Th17比值相关性分析Fig.1 The ratios of Th9 and Th17 cells in CD4+T cells among CM patients group before and after treatment and the normal group Fig.2 The ratios of Th9 and Th17 cells in CD4+T cells among improved CM patients group before and after treatment and the normal group Fig.3 The ratios of Th9 and Th17 cells in CD4+T cells among CM patients who resistant to treatment before and after treatment and the normal control Fig.4 a.Correlation analysis of Th9 and Th17 in CM patients after treatment,b.Correlation analysis of Th9 and Th17 in improved CM patients after treatment
Th17和Th9细胞如何发挥清除隐球菌感染的确切机制尚不明确,有研究发现在漆酶缺陷的隐球菌感染小鼠模型中,Th1和Th17细胞分泌的细胞因子明显增加,其中IL-17的增加出现时间更早,认为Th17细胞能与Th1细胞共同作用,对于预防和降低隐球菌在脑脊液中的扩散具有保护作用[16]。在肺炎克雷伯菌感染的肺炎中,Th17细胞可以通过趋化TNF-α、IL-1β、巨噬细胞炎性蛋白-2、粒细胞集落刺激因子等至感染部位,以增强对细菌的清除率,抵抗肺炎克雷伯菌的攻击[17]。而IL-9在巴西钩虫感染中认为可以激活先天性淋巴样细胞,调节B淋巴细胞增强对病原菌的杀伤作用[18]。所以我们推测,在隐球菌性脑膜炎患者中,Th17细胞可以通过调节其他辅助T细胞如Th1、Th9细胞的分泌,增强吞噬细胞的吞噬杀伤隐球菌的功能来达到抵御隐球菌感染的目的。而Th17细胞在未治疗隐球菌性脑膜炎患者及隐球菌性脑膜炎治疗后无好转患者中的表达下调可能是这一系列免疫反应无法应答,导致隐球菌性脑膜炎发病及隐球菌治疗抵抗的根源。隐球菌性脑膜炎患者中Th17细胞的具体免疫调控功能还需进一步研究,本实验的结果为寻找抵御隐球菌感染疫苗制备及免疫治疗靶点的选择提供了新的思路。
[1]Park BJ,Wannemuehler KA,Marston BJ,et al.Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS[J].AIDS(London,England),2009,23(4):525-530.
[2]Veldhoen M,Uyttenhove C,van Snick J,et al.Transforming growth factor-beta 'reprograms'the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset[J].Nat Immunol,2008,9(12):1341-1346.
[3]Khader SA,Cooper AM.IL-23 and IL-17 in tuberculosis[J].Cytokine,2008,41(2):79-83.
[4]Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[5]Perfect JR,Dismukes WE,Dromer F,et al.Clinical practice guidelines for the management of cryptococcal disease:2010 update by the infectious diseases society of america[J].Clin Infect Dis,2010,50(3):291-322.
[6]Charlier C,Nielsen K,Daou S,et al.Evidence of a role for monocytes in dissemination and brain invasion by Cryptococcus neoformans[J].Infect Immun,2009,77(1):120-127.
[7]Tan DB,Yong YK,Tan HY,et al.Immunological profiles of immune restoration disease presenting as mycobacterial lymphadenitis and cryptococcal meningitis[J].HIV Med,2008,9(5):307-316.
[8]Schop J.Protective immunity against cryptococcus neoformans infection[J].Mcgill J Med,2007,10(1):35-43.
[9]Dardalhon V,Awasthi A,Kwon H,et al.IL-4 inhibits TGF-beta-induced Foxp3+T cells and,together with TGF-beta,generates IL-9+IL-10+Foxp3(-)effector T cells[J].Nat Immunol,2008,9(12):1347-1355.
[10]Guzman-Fulgencio M,Jimenez JL,Berenguer J,et al.Plasma IL-6 and IL-9 predict the failure of interferon-alpha plus ribavirin therapy in HIV/HCV-coinfected patients[J].J Antimicrob Chemother,2012,67(5):1238-1245.
[11]Zelante T,De Luca A,Bonifazi P,et al.IL-23 and the Th17 pathway promote inflammation and impair antifungal immune resistance[J].Eur J Immunol,2007,37(10):2695-2706.
[12]Khader SA,Bell GK,Pearl JE,et al.IL-23 and IL-17 in the establishment of protective pulmonary CD4+T cell responses after vaccination and during Mycobacterium tuberculosis challenge[J].Nat Immunol,2007,8(4):369-377.
[13]Murdock BJ,Huffnagle GB,Olszewski MA,et al.Interleukin-17A Enhances Host Defense against Cryptococcal Lung Infection through Effects Mediated by Leukocyte Recruitment,Activation,and Gamma Interferon Production[J].Infect Immun,2014,82(3):937-948.
[14]Beriou G,Bradshaw EM,Lozano E,et al.TGF-beta induces IL-9 production from human Th17 cells[J].J Immunol,2010,185(1):46-54.
[15]Nowak EC,Weaver CT,Turner H,et al.IL-9 as a mediator of Th17-driven inflammatory disease[J].J Exp Med,2009,206(8):1653-1660.
[16]Qiu Y,Davis MJ,Dayrit JK,et al.Immune modulation mediated by cryptococcal laccase promotes pulmonary growth and brain dissemination of virulent Cryptococcus neoformans in mice[J].PLoS One,2012,7(10):e47853.
[17]Ye P,Garvey PB,Zhang P,et al.Interleukin-17 and lung host defense against Klebsiella pneumoniae infection[J].Am J Respir Cell Mol Biol,2001,25(3):335-340.
[18]Turner JE,Morrison PJ,Wilhelm C,et al.IL-9-mediated survival of type 2 innate lymphoid cells promotes damage control in helminth-induced lung inflammation[J].J Exp Med,2013,210(13):2951-2965.

