耐氟康唑念珠菌和耐伊曲康唑烟曲霉对泊沙康唑的敏感性测定
王雪洁 万喆 李若瑜 刘伟
(北京大学第一医院皮肤科 北京大学真菌和真菌病研究中心 皮肤病分子诊断北京市重点实验室,北京 100034)
近30 a来,人类的真菌感染率显著增高[1]。而在能感染人类的条件性致病真菌中,又以念珠菌和曲霉最为常见。其中,以白念珠菌 (Candida albicans)为主的念珠菌属是引起侵袭性真菌感染的首要致病真菌[2]。近年来国内外流行病学调查研究表明,虽然白念珠菌的分离率有所下降,但是对氟康唑 (fluconazole,FLU)敏感性差的近平滑念菌(C andida parapsilosis)和热带念珠菌(Candida tropicalis)等的比例正在升高[3-4]。曲霉是仅次于念珠菌的第二大深部致病真菌,且近年来发病率有逐渐升高的趋势。其中烟曲霉(Aspergillus fumigatus)是引起侵袭性曲霉病最主要的病原菌[5],并且已成为该类患者最常见的死亡原因[6]。
随着临床治疗中FLU、伊曲康唑 (itraconazole,ITC)的应用日益频繁,耐FLU的念珠菌以及耐ITC的烟曲霉临床分离株正在逐渐增多,而且往往导致患者应用FLU或者ITC治疗失败[7]。因此选择高效、敏感的新型抗真菌药物来治疗这些耐药菌株引起的感染具有十分重要的意义。泊沙康唑(posaconazole,POS)是一种新型广谱三唑类抗真菌药物,具有良好的药物动力学,对难治性侵袭性真菌病有预防和治疗的作用[8]。为了验证POS对耐FLU念珠菌和耐ITC曲霉的作用,我们参照美国临床实验室标准化研究所(clinical laboratory standard institute,CLSI)颁布的酵母菌药敏实验方案 M27-A3[9]和丝状菌药敏实验方案 M38-A2[10]方案,以微量液基稀释法测定11株耐FLU的念珠菌和3株耐ITC的曲霉对 FLU、ITC、伏立康唑 (voriconazole,VRC)和POS的敏感性。现将结果报道如下。
1 材料与方法
1.1 受试菌株
11株耐FLU的念珠菌和3株耐ITC的烟曲霉,均为临床分离菌株,来源于患者的血液和尿液。菌株保存于北京大学第一医院皮肤性病科真菌室、北京大学真菌和真菌病研究中心。抗真菌药物敏感性试验所用质控株为近平滑念珠菌ATCC22019和克柔念珠菌(Candida krusei)ATCC6258。
1.2 试验用药物
所有药物均以原料粉形式提供。FLU(Sigma-Aldrich公司,批号 200606040,纯度 98.83%)用无菌双蒸水溶解,储存液的浓度为1 600 μg/mL;ITC(中国药品生物制品检定所,批号100631-200401,纯度 99.3%)、VRC(山东省寿光富康制药公司,批号070724,纯度99.3%)和POS(Merck公司,批号 171228-49-2,纯度 >99%),用100%分析纯度二甲基亚砜 (dimethyl sulfoxide,DMSO)溶解,储存液的浓度为 1 600 μg/mL,药物储存液于-30℃保存备用。
1.3 菌悬液制备
菌悬液制备:受试菌株接种于马铃薯葡萄糖琼脂 (potato dextrose agar,PDA)培养基,念珠菌35℃活化2 d,烟曲霉35℃活化7 d。取PDA上的菌落,加入4 mL生理盐水,反复吹吸混匀后,将菌悬液吸到无菌试管中。对于念珠菌,在530 nm波长的比浊仪上,利用无菌生理盐水调整菌悬液浓度至0.5麦氏单位,再用血球计数板计数至 (1~5)×106/mL。菌悬液用RPMI1640液体培养基稀释20倍,再稀释100倍,制备成工作浓度的菌悬液,得到 (0.5~2.5)×103CFU/mL的接种菌悬液。对于曲霉菌悬液,以血球计数板调整孢子浓度为1×106/mL~5×106/mL,再以 RPMI1640液体培养基进一步稀释50倍,即为2倍于最终接种浓度的孢子悬液。
1.4 抗真菌药物体外抑菌活性测定
参照CLSI制定的酵母药敏方案M27-A3和丝状真菌药敏方案M38-A2。采用微量液基稀释法,分别将FLU、ITC、VRC和POS的药物储存液以RPMI1640液基倍比稀释,配制成2倍于终浓度的药液,加入96孔圆底药敏板。FLU的工作浓度为 0.125 ~64 μg/mL,ITC、VRC 和 POS 的均为0.03 ~16 μg/mL。取 100 μL 药液分别加入第 1~10列各孔,第11列中加入100 μL RPMI1640。第12列设立阴性对照。向第1~11孔分别加入100 μL菌悬液后,35℃孵育48 h判读结果。对于念珠菌,FLU、ITC、VRC和POS的最低抑菌浓度(minimal inhibitory concentration,MIC)均定义为与生长对照孔相比生长50%受抑制所对应的最低药物浓度。对于曲霉,FLU、ITC、VRC和 POS的MIC均定义为与生长对照孔相比生长100%受抑制所对应的最低药物浓度。对于念珠菌属,FLU,MIC≤16 μg/mL 为敏感,MIC=16 ~ 32 μg/mL为剂量依赖性敏感,MIC≥64 μg/mL为耐药;ITC,MIC≤0.125 μg/mL 为敏感,MIC=0.25 ~0.5 μg/mL 为剂量依赖性敏感,MIC≥1 μg/mL 为耐药;VRC,MIC≤1 μg/mL 为敏感,MIC=2 μg/mL为剂量依赖性敏感,MIC≥4 μg/mL 为耐药[9]。有些文献认为,对于 POS,MIC>32 μg/mL为耐药[11]。对于曲霉属,ITC 和 VRC,MIC <2 μg/mL为敏感,MIC=2 μg/mL 为中介,MIC >2 μg/mL为耐药;POS,MIC < 0.25 μg/mL 为敏感,MIC=0.5 μg/mL 为中介,而 MIC > 0.5 μg/mL 为耐药[12]。所有药敏试验均重复操作3遍。
2 结 果
四种药物对念珠菌和曲霉的体外抑菌作用
对于11株念珠菌,FLU的MIC值均为64 μg/mL,ITC 的 MIC 范围是 0.5 ~ 16 μg/mL,VRC 的MIC 范围是0.25~2 μg/mL,POS的MIC 范围是0.125~1 μg/mL。根据判读标准,11株念珠菌均对氟康唑耐药。
对于 3株曲霉,ITC的 MIC均 >16 μg/mL,VRC的MIC范围是1~2 μg/mL,POS的MIC范围是 0.25 ~ 0.5 μg/mL。根据判读标准,烟曲霉对ITC均耐药,但对POS为敏感或中介。
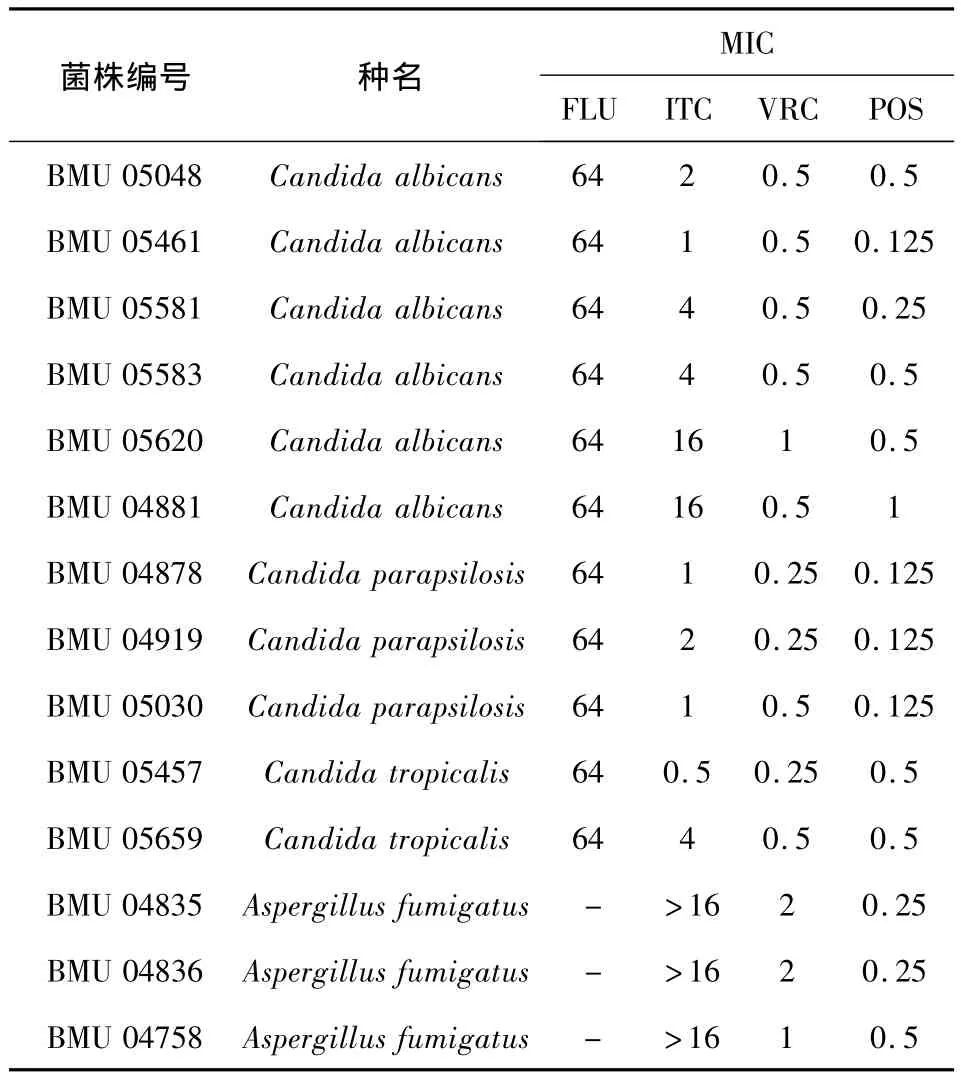
表1 FLU、ITC、VRC和POS对14株病原真菌的最低抑菌浓度 (MIC)(μg/mL)Tab.1 The MIC results of 14 pathogenic fungi to FLU,ITC,VRC and POS(μg/mL)
3 讨 论
念珠菌是引起黏膜和深部组织真菌感染的主要病原菌。近年来,由于免疫抑制剂的使用,念珠菌等条件致病菌的感染率大幅上升[13]。随着抗真菌药物在临床的广泛使用,尤其是使用FLU来预防高危人群的真菌感染,耐药念珠菌不断出现,并且对抗真菌药物敏感性低的非白念珠菌也在增多[14]。对唑类药物耐药的曲霉主要为烟曲霉,且曲霉对唑类药物敏感性相对较低[14]。其耐药株在比利时、加拿大、中国、丹麦、法国、挪威、西班牙、瑞典、荷兰、英国和美国等国家均有报道[14]。国外有报道称,近年来唑类耐药情况有显著增长趋势[15]。在有些地区,曲霉已成为引起侵袭性真菌病 (invasive fungal disease,IFD)的首要因素。而在中国,念珠菌引起的侵袭性真菌感染最为常见,其次是曲霉[15]。
目前,治疗侵袭性真菌感染的常用药物包括三唑类药物、多烯类药物两性霉素B(amphotericin B,AMB)、棘白霉素类药物卡泊芬净 (caspofungin,CAS)以及氟胞嘧啶 (flucytosine)等。三唑类药物又包括FLU、ITC、VRC以及POS等。由于唑类药物具有高效性、低毒性和抗菌谱广的特点,在临床上广泛应用[16]。而随着唑类药物的广泛应用,耐药现象日趋严重。在念珠菌中,FLU的耐药性与药物靶酶的改变、外排泵基因过度表达以及热休克蛋白90(heat shock protein 90,HSP90)有关,与菌株生物膜的形成也有一定的联系[17]。目前认为,烟曲霉对三唑类药物的耐药机制与外排泵基因、HSP90、外源性胆固醇的摄入,cyp51A基因过表达或者靶酶突变等因素有关[18]。耐药真菌给治疗造成了更大的困难,临床治疗效果受到严重影响[19]。
新型唑类药物POS从ITC衍化而来,其结构类似,三唑侧链苯环上的氟和羟基被氯所取代,因此增强其效能和活性谱[19]。POS的作用机制是抑制真菌细胞膜麦角固醇合成关键酶--甾醇14α-去甲基 化 酶 (sterol14α-demethylase,P45014DM,CYP51)。因麦角固醇与真菌细胞膜的合成有关,该酶的改变不仅可以导致麦角固醇合成的缺失,而且可以造成有害的甲基甾醇前体的堆积[6],最终致真菌死亡。有人曾研究了在POS中白念珠菌、近平滑念珠菌、烟曲霉和黄曲霉的麦角固醇合成。结果表明,在这些菌种中,POS都能抑制麦角固醇合成,且呈剂量依赖性[19]。
体外试验证实,POS的抗菌谱近似于AMB,较其它三唑类药物更广,并且耐受性好[6]。一直以来,AMB都被认为是治疗严重真菌感染的首选药物,但是它的肾毒性和输液相关事件限制了其应用[19]。POS对包括念珠菌、曲霉、接合菌在内的多种致病真菌有杀伤或者抑制作用,尤其是对耐药的难治性或侵袭性真菌感染 (如曲霉,镰刀菌属、接合菌和球孢子菌)有效[7]。在预防侵袭性真菌病方面,比FLU或者ITC更有效[20]。POS对克柔念珠菌和葡萄牙念珠菌有杀菌作用,对其他很多念珠菌有抑菌作用[7]。在小鼠模型实验中,POS对侵袭性曲霉病、接合菌病、镰刀菌病、中枢神经系统暗色丝孢霉病、组织胞浆菌病、芽生菌病和球孢子菌病均有效[7]。
POS已经被美国食品药品管理局批准用于治疗口咽念珠菌病,包括对FLU和/或ITC耐药菌株的感染,以及可以用于13岁以上严重免疫缺陷的患者的侵袭性曲霉和念珠菌感染的预防[7]。此外,欧盟委员会还允许其用于难治性疾病或者无法耐受常用抗真菌药物的成人患者的侵袭性曲霉病、镰刀菌病、慢性芽生菌病、分支菌病和球孢子菌病的治疗[8]。虽然VRC对接合菌没有作用,但是POS对接合菌依然有效[15]。有研究表明,对于 IFD、POS与 FLU在预防IFD时同样有效;在治疗造血干细胞移植患者的侵袭性曲霉病时,POS要优于FLU[20]。
本实验表明,POS对耐FLU的念珠菌和耐ITC的烟曲霉有良好的抗菌作用,这与以前的研究一致[8]。FLU 对念珠菌的 MIC 值是 64 μg/mL,ITC对烟曲霉的MIC范围>16 μg/mL,受试菌株均表现出明显的耐药性。而POS对所有菌株的MIC范围是0.125~1 μg/mL,说明受试菌株对 POS均有良好的敏感性。念珠菌和曲霉对VRC和POS均不耐药,但是受试真菌对于两种药的敏感性略有不同。对于白念珠菌,POS的MIC值不高于VRC。VRC对烟曲霉的MIC值为1~2 μg/mL,而POS对烟曲霉的MIC均<1 μg/mL。泊沙康唑是伊曲康唑基础上改造而来将伊曲康唑的三唑侧链苯环上的氟和羟基以氯取代,这种改造增强了其抗真菌活性并拓宽了抗菌谱[21]。受试菌株对FLU和ITC耐药,却对新型抗真菌唑类药物POS敏感,对临床选择用药有重要意义。POS不仅抗菌谱广泛,还对一些FLU和ITC耐药的菌株有效,这与其他人的研究一致[6]。综上,我们认为,在治疗耐药性念珠菌和曲霉方面,POS是一种有效的药物。
[1]Silva S,Negri M,Henriques M,et al.Candida glabrata,Candida parapsilosisandCandida tropicalis:biology,epidemiology,pathogenicity and antifungal resistance[J].FEMS Microbiol Rev,2012,36(2):288-305.
[2]陈翠珠,徐英春,王澎,等.1557株酵母菌的鉴定及其药敏试验分析[J].中国真菌学杂志,2006,1(3):134-138.
[3]Rodloff C,Koch D,Schaumann R.Epidemiology and antifungal resistance in invasive candidiasis[J].Eur J Med Res,2011,16(4):187-195.
[4]Wang H,Xiao M,Chen SC,et al.In vitrosusceptibilities of yeast species to fluconazole and voriconazole as determined by the 2010 National China Hospital Invasive Fungal Surveillance Net(CHIF-NET)study [J].J Clin Microbiol,2012,50(12):3952-3959.
[5]Pfaller MA,Diekema DJ,Ghannoum MA,et al.Wild-type MIC distribution and epidemiological cutoff values for Aspergillus fumigatus and three triazoles as determined by the Clinical and Laboratory Standards Institute broth microdilution methods[J].J Clin Microbiol,2009,47(10):3142-3146.
[6]Denning DW,Hope WW.Therapy for fungal diseases:opportunities and priorities [J].Trends Microbiol,2010,18(5):195-204.
[7]Warrilow AG,Melo N,Martel CM,et al.Expression,purification,and characterization ofAspergillus fumigatessterol 14-alpha demethylase(CYP51)isoenzymes A and B[J].Antimicrob A gents Chemother,2010,54(10):4225-4234.
[8]Nagappan V,Deresinski S.Reviews of anti-infective agents:Posaconazole:a broad-spectrum triazole antifungal agent[J].Clin Infect Dis,2007,45(12):1610-1617.
[9]Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of yeasts[S].Approved standard-Third edition M27-A3.CLSI,Wayne,PA,2008.
[10]Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of filamentous fungi[S].Approved standard-Second edition M38-A2.CLSI,Wayne,PA,2008.
[11]Pfaller M,Boyken L,Hollis R,et al.Use of epidemiological cutoff values to examine 9-year trends in susceptibility of Candida species to anidulafungin,caspofungin,and micafungin[J].Journal of clinical microbiology,2011,49(2):624-629.
[12]Verweij PE,Howard SJ,Melchers WJ,et al.Azole-resistance in Aspergillus:proposed nomenclature and breakpoints[J].Drug Resist Update,2009,12(6):141-147.
[13]Mishra NN,Prasad T,Sharma N,et al.Pathogenicity and drug resistance inCandida albicansand other yeast species.A review[J].Acta Microbiol Immunol Hung,2007,54(3):201-235.
[14]Mayr A,Lass-Fl?rl C.Epidemiology and antifungal resistance in invasive Aspergillosis according to primary disease:review of the literature[J].Eur J Med Res,2011,16(4):153-157.
[15]Kriengkauykiat J,Ito JI,Dadwal SS.Epidemiology and treatment approaches in management of invasive fungal infections[J].Clin Epidemiol,2011,3(1):175-191.
[16]芦现杰,郑玉果,周斌.真菌对唑类药物耐药机制研究进展[J].世界临床药物,2012,33(6):363-368.
[17]索桂英,付萍.白念珠菌氟康哇耐药机制的研究进展[J].皮肤病与性病,2013,5(2):90-94.
[18]孙毅,刘伟,陈伟,等.对唑类药物交叉耐药的烟曲霉临床分离株耐药机制的初步探讨[J].中华皮肤科杂志,2011,44(4):244-248.
[19]Schiller DS,Fung HB.Posaconazole:an extended-spectrum triazole antifungal agent[J].Clin Ther,2007,29(9):1862-1886.
[20]Ullmann AJ,Lipton JH,Vesole DH,et al.Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease[J].N Engl J Med,2007,356(4):335-347.
[21]Xiao L,Madison V,Chau AS,et al.Three-dimensional models of wild-type and mutated forms of cytochrome P450 14α-sterol demethylases fromAspergillus fumigatusandCandida albicansprovide insights into posaconazole binding[J].Antimicrob A-gents Chemother,2004,48:568-574.

