菠萝皮黄酮的提取及其稳定性、抗氧化性研究
王 芳 ,高瑜珑 ,石建雯
(1.浙江师范大学化学与生命科学学院,浙江金华321004;2.浙江师范大学行知学院,浙江金华321004)
菠萝(Ananas comosus(L.)Merr.)又名凤梨,是四大热带水果之一。我国菠萝年产量140余万t,居世界第4位[1]。菠萝除了直接食用外,还可以加工成饮料、罐头、蜜饯、酒、色拉等食品,在食用和加工过程中产生的菠萝皮有50%~60%[2]被丢弃。据报道,菠萝皮含有的营养成分与果肉的基本成分相接近[3],大量的丢弃既浪费资源,又污染环境。有研究表明,黄酮类化合物具有多种生物活性,如抗氧化[4-8]、抗癌[9-10]、调节免疫[11-12]、抗菌[6,13-14]、抗病毒[15-16]、抗炎症[4]、抗过敏、预防心血管病等[17-19]。
本试验对冬、夏季菠萝皮中黄酮类化合物的提取、稳定性及体外抗氧化活性进行研究,以期进一步开发利用菠萝皮,提高菠萝的附加值,拓宽黄酮类化合物的来源,同时减轻环境压力。
1 材料和方法
1.1 试验材料
夏、冬季菠萝分别于2013年7,12月购于金华水果市场,取菠萝皮于60℃烘干至恒质量,粉碎过0.42 mm筛,贮于避光、干燥、冷藏环境中。
1.2 试验试剂
芦丁、DPPH为分析纯,Sigma化学公司产品;其余试剂均为分析纯(碘化钾为优级纯)。
1.3 主要仪器和设备
HWS28型电热恒温水浴锅、DHG-9140A型电热恒温鼓风干燥箱(上海一恒科技有限公司);T6新世纪紫外分光光度计(上海天美科学仪器有限公司);JY1002电子天平(上海精密科学仪器有限公司);RE-52 AAB旋转蒸发器(温州奥利生物医学仪器厂)。
1.4 菠萝皮总黄酮含量的测定
1.4.1 标准溶液的制备 精密称取芦丁0.500 0 g,用70%乙醇配制成1.0 mg/mL的标准溶液,备用。
1.4.2 最大吸收波长的确定[20]精密吸取标准芦丁溶液 0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL,分别加蒸馏水至3.0 mL,加5%亚硝酸钠0.5 mL,混匀放置6min,加10%硝酸铝0.5mL,混匀放置6min,加5%NaOH 2.5 mL,混匀放置15 min,蒸馏水定容至10 mL,以不加标准芦丁溶液组作为空白,用T6新世纪紫外分光光度计在400~600 nm下进行扫描。测得在波长为490 nm处吸光值最大,因此,选择490 nm作为测定波长。
1.4.3 芦丁标准曲线的制作 分别精密吸取标准芦丁溶液 0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL,同1.4.2方法在490 nm处测吸光值,根据吸光值经最小二乘法作线性回归处理,得芦丁质量浓度C(mg/mL)和吸光值A的标准曲线回归方程为:C=0.090 4A+0.000 1,R2=0.999 7。
1.4.4 黄酮含量的计算 取3 mL待测液于10 mL容量瓶中,同1.4.2方法在490 nm处测吸光值。样品中黄酮类化合物含量,其中,C为从标准曲线中查得的黄酮类化合物的质量浓度(mg/mL);Vt为提取液总体积(mL);Vs为测定时取样体积(mL);W为样品质量(干质量,g)。
1.5 菠萝皮中黄酮类化合物的提取工艺研究
1.5.1 单因素试验 称取1.00 g菠萝皮样品粉末,分别考察不同的提取溶剂(0,20%,40%,60%,80%,95%乙醇)、料液比(1∶10,1∶30,1∶50,1∶70)、提取温度 (20,40,60,80 ℃) 和提取时间(0.5,1,2,3,4 h)对黄酮含量的影响。所有试验数据均重复3次。
1.5.2 正交试验 在单因素试验的基础上,每个因素选取3个适宜水平,运用L9(34)正交试验,确定提取冬、夏季菠萝皮黄酮的适宜条件。正交试验方案如表1,2所示。

表1 正交试验方案(冬季菠萝皮)

表2 正交试验方案(夏季菠萝皮)
1.6 菠萝皮中黄酮类化合物的稳定性研究
取所得黄酮类化合物配制成50μg/mL水溶液,分别考察光照(太阳直射、避光)、碳水化合物(淀粉、蔗糖、葡萄糖)、氧化剂和还原剂(H2O2、氧化亚铁、Vc)、金属离子(K+,Na+,Cu2+,Zn2+,Al3+,Mg2+,Ca2+,Fe3+)对其稳定性的影响。
1.7 菠萝皮中黄酮类化合物的抗氧化性研究[21]
取待测液2 mL及1×10-4mol/LDPPH 2 mL加入同一具塞试管中,混匀,30 min后用无水乙醇作参照,在517 nm处测定其吸光度Ai,同时测定2 mL 1×10-4mol/L DPPH溶液与2 mL无水乙醇混合液的吸光度Ac,以及2 mL待测液与2 mL无水乙醇混合液的吸光度Aj,根据下列公式计算待测液对DPPH的抑制率。
抑制率=(1-(Ai-Aj)/Ac)×100%,其中,Ac为未加待测液时DPPH的吸光度;Aj为待测液的吸光度;Ai为加待测液后DPPH的吸光度。
2 结果与分析
2.1 菠萝皮中黄酮类化合物的提取工艺研究
2.1.1 单因素试验
2.1.1.1 提取溶剂的选择 目前,国内外溶剂法提取黄酮一般采用甲醇、乙醇、丙酮、乙醚、乙酸乙酯等有机溶剂[22]。相对其他溶剂来说,乙醇具有浸提效率高、毒性小、价格低廉且黏度小,有利于减少传质阻力等优点,因此,本试验主要考察水和乙醇作为提取溶剂的效果。
精确称取1.00 g菠萝皮样品,分别加入水和不同浓度的乙醇溶液50 mL,于80℃水浴浸提2 h,离心抽滤,定容,按1.4.4的方法测定黄酮含量(其余同)。
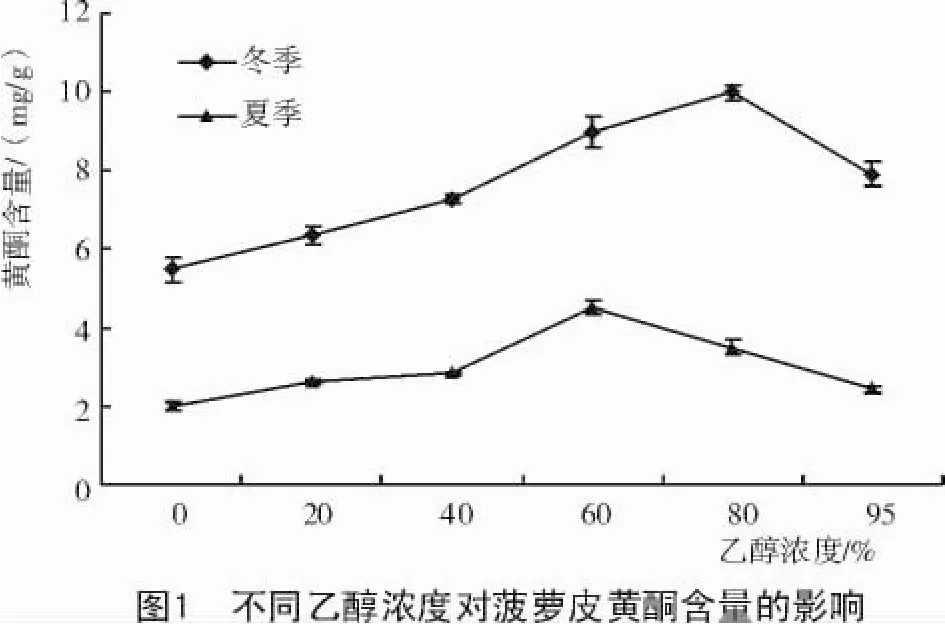
由图1可知,80%,60%乙醇分别为冬、夏季菠萝皮中黄酮类化合物的最佳提取溶剂,黄酮含量分别达9.98,4.52 mg/g,分别是水提取含量的1.83倍和2.27倍。水和过低浓度的乙醇溶液会使无机盐、蛋白质、淀粉和果胶等杂质溶出,而过高浓度乙醇亲脂性强,脂溶性物质溶出会增加,干扰因素增多[23-24],这些干扰成分(醇溶性杂质、色素等)会与乙醇-水分子结合,使黄酮与乙醇-水分子结合的机会减少,从而导致黄酮类化合物的含量下降[25]。
2.1.1.2 料液比对提取效果的影响 取1.00 g菠萝皮样品,分别以料液比 1∶10,1∶30,1∶50,1∶70加入75%乙醇至50 mL,80℃水浴浸提2 h,离心抽滤,定容,测定黄酮含量。
图2表明,冬季菠萝皮黄酮含量在料液比1∶30时最大,达11.09mg/g,是1∶10的8.66倍;而夏季菠萝皮黄酮含量在料液比1∶50时最大,为5.33 mg/g,是1∶10的2.99倍。随着料液比的增大,黄酮类物质的溶出量会增加,但料液比达到一定值后,一方面由于黄酮逐渐达到溶解平衡,另一方面由于杂质溶出增加均会影响提取结果[26]。

2.1.1.3 提取温度对提取效果的影响 取1.00 g菠萝皮样品,加入75%乙醇50 mL,分别在20,40,60,80℃下浸提2 h,离心抽滤,定容,测定黄酮含量。
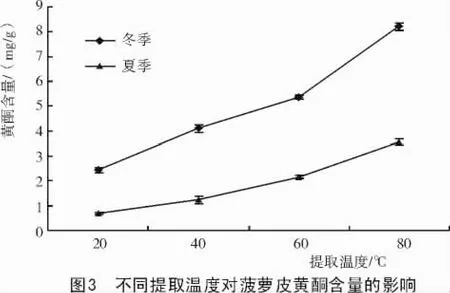
图3表明,随提取温度的升高,冬、夏季菠萝皮黄酮含量分别从2.43,0.68 mg/g(20℃)提高到8.22,3.54 mg/g(80℃),含量显著提高。其原因可能是温度提高后提取溶剂的黏度下降,分子运动加速,溶解速度加快,有助于黄酮的溶出。但由于乙醇沸点为75℃左右,温度的升高和加热时间的延长,容易使其过快挥发,造成溶剂损失,且会导致黄酮结构被氧化破坏。同时也使一些非黄酮类物质更易进入溶剂系统,干扰黄酮浸出率。所以,不宜进一步升高温度。
2.1.1.4 提取时间对提取效果的影响 取1.00 g菠萝皮样品,加入75%乙醇至50 mL,于80℃下分别水浴浸提 0.5,1,2,3,4 h,离心抽滤,定容,测定黄酮含量。

从图4可以看出,提取时间在0.5~1 h之间时,冬季菠萝皮的黄酮含量随提取时间增加明显,之后含量增速减慢,1,2 h的黄酮含量分别为10.09,10.50 mg/g,推测原因可能是1 h后提取溶剂和样品这2个体系中的黄酮浓度已相差不大,传质推动力下降,黄酮类化合物溶出缓慢[23];2 h之后,在2个体系传质推动下,部分黄酮类化合物被氧化破坏,含量出现下降的趋势;3 h时,含量为8.73 mg/g,这可能是因为长时间的热效应,影响了黄酮类物质的化学结构,也可能是因为溶出了更多的杂质,影响了黄酮类化合物的溶解度,从而影响了其含量[27]。综合考虑经济、效率等因素,冬季菠萝皮提取时间取1 h。夏季菠萝皮中黄酮含量的变化趋势与冬季类似,提取2,3 h的黄酮含量分别为3.40,3.41 mg/g,所以,提取时间取2 h。
2.1.2 正交试验结果 试验结果(表3,4)表明,冬季菠萝皮黄酮的适宜提取工艺为80%乙醇为提取溶剂,料液比1∶40,80℃提取1.5 h,此条件下黄酮含量可达12.80 mg/g,4种因素对提取结果的影响从大到小依次为:提取温度>乙醇浓度>提取时间>料液比;夏季菠萝皮黄酮的适宜提取工艺为50%乙醇为提取溶剂,料液比1∶40,80℃提取1.5 h,此条件下黄酮含量可达4.41 mg/g,4种因素对提取结果的影响从大到小依次为:提取温度>料液比>乙醇浓度>提取时间。结果同时表明,冬季菠萝皮黄酮含量明显高于夏季菠萝皮黄酮的含量(约为夏季的2.90倍),这可能与菠萝的成熟度不同有关,张秀梅等[28]的研究也发现,不同成熟度菠萝果实的营养成分含量差异明显。

表3 冬季菠萝皮黄酮化合物提取正交试验结果

表4 夏季菠萝皮黄酮化合物提取正交试验结果
2.2 菠萝皮中黄酮类化合物的稳定性研究
2.2.1 光照的影响 从图5,6可以看出,菠萝皮黄酮对光敏感,随着光照时间的延长,黄酮溶液吸光度值下降,在光照20 h后,冬、夏季菠萝皮黄酮吸光度值分别下降了90.81%和71.02%,而在避光条件下仅下降了1.77%和0.56%。这可能是光照使黄酮物质先发生自身的氧化聚合,之后又发生降解[23],所以,菠萝皮黄酮在贮存和使用过程中应避免阳光直射。


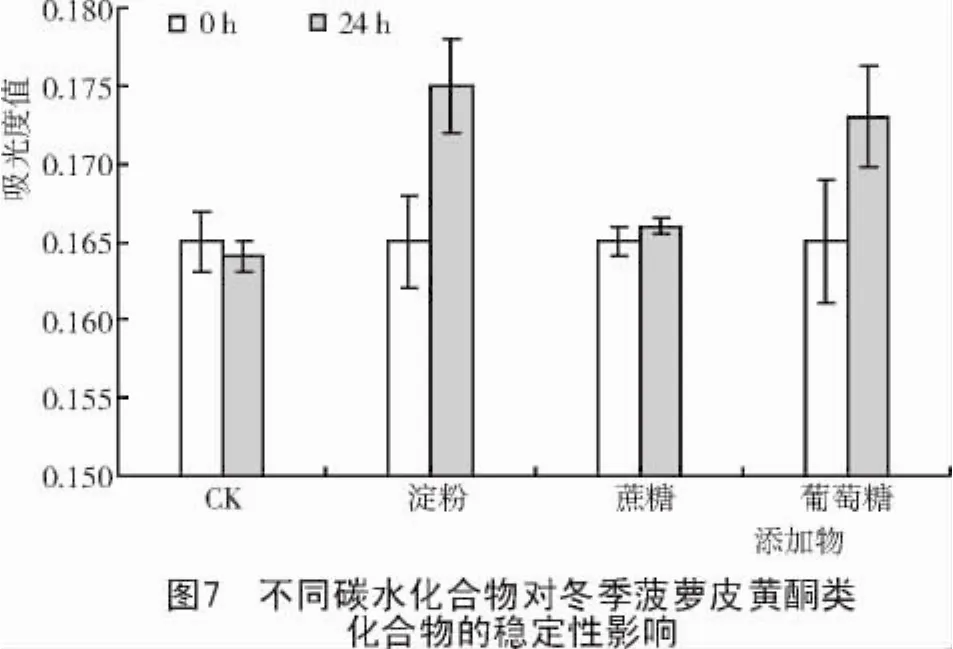
2.2.2 碳水化合物的影响 在4支(其中1支为对照)25 mL的具塞试管中各加入2/3体积的菠萝皮黄酮提取液,然后再分别加入葡萄糖、蔗糖、淀粉各0.1 g,室温下分别放置0,24 h。同时以不添加碳水化合物为对照。
从图7,8可以看出,24 h后,黄酮提取液吸光度值都呈现出上升的趋势,淀粉和葡萄糖的作用尤为明显,因而,黄酮在贮藏、使用中均宜与糖共处。

2.2.3 氧化剂、还原剂的影响 取样液10 mL,分别加入质量分数为2%Vc,2%H2O2,氧化亚铁及水各 40 μL,室温下放置 0,1,24 h。
由图9,10可知,H2O2使冬季菠萝皮黄酮含量下降,而对夏季无明显影响,说明冬季菠萝皮黄酮对氧化剂更敏感;Vc对冬季菠萝皮黄酮无明显影响,而使夏季黄酮含量下降,可能黄酮成分与维生素发生了缩合反应,聚合或降解产物对黄酮含量有一定影响[27];氧化亚铁能使样液中黄酮含量上升,Das等指出,黄酮类化合物的酮基和3-位或5-位羟基联合作用,可螯合金属离子,削弱微量金属的助氧化作用[29],说明菠萝皮黄酮与亚铁离子产生络合反应,因此,能阻断由亚铁离子催化的氧化反应。


2.2.4 金属离子的影响 分别配制 K+,Na+,Cu2+,Zn2+,Al3+,Mg2+,Ca2+溶液 1mg/mL,Fe3+溶液 50μg/mL。取一定量样液,分别加入不同金属离子溶液,分别放置 0,1,2,3,4 d,测定其吸光度值。
从 图 11,12 可 以 看 出 ,K+,Na+,Al3+,Mg2+,Ca2+对菠萝皮黄酮无明显影响,Cu2+,Zn2+,Fe3+使黄酮含量下降,Fe3+,Zn2+的影响尤其明显。其原因可能是Fe3+属于过渡金属离子,最外层有不成对的电子,而Cu2+虽然不完全符合过渡金属离子的定义,但Cu2+是Cu的4s轨道和3d轨道各失去1个电子而形成的,因此,也具有不成对电子,它们都易于与黄酮类化合物中酚羟基形成络合物;另一方面,Cu2+,Zn2+,Fe3+作为中心离子形成配离子时一般都具有颜色,从而影响了黄酮类化合物的吸收光谱[27]。


2.3 菠萝皮中黄酮类化合物的抗氧化性研究
由图13可知,2种菠萝皮黄酮提取物均具有清除DPPH自由基的能力,且黄酮提取物的浓度和抗氧化性之间成一定的剂量-效应关系。

冬季菠萝皮黄酮对DPPH自由基的抑制率分别达 52.60%,90.40%,93.01%,94.10%和 95.40%;夏季的抑制率分别达84.30%,91.00%,94.41%,95.20%和96.73%,表现出较冬季菠萝皮更强的抗氧化活性,这可能是由2种季节菠萝皮黄酮的成分、结构、纯度以及与糖的结合程度不同等因素所致[30-32]。
3 结论
3.1 菠萝皮黄酮类化合物提取工艺
冬、夏季菠萝皮分别以80%,50%乙醇为提取剂,均在料液比为1∶40,温度为80℃下浸提1.5 h,黄酮含量分别达12.80,4.41 mg/g。其中,浸提温度对提取效果的影响最大。
3.2 菠萝皮黄酮类化合物的稳定性
菠萝皮黄酮对光敏感;淀粉、葡萄糖和蔗糖对黄酮类化合物有一定的保护作用;冬季菠萝皮黄酮稳定性受氧化剂影响大,而夏季菠萝皮黄酮受还原剂影响大;K+,Na+,Al3+,Mg2+,Ca2+对菠萝皮黄酮无明显影响,而Fe3+,Zn2+,Cu2+对黄酮类化合物有不良影响。
3.3 菠萝皮黄酮类化合物的抗氧化性
冬、夏季菠萝皮黄酮均表现出较强的清除DPPH自由基的能力,且成一定的剂量-效应关系,夏季菠萝皮黄酮的抗氧化活性强于冬季。
[1]董定超,李玉萍,梁伟红,等.近十年世界菠萝的生产贸易现状[J].热带农业科学,2008,28(2):59-63.
[2]徐雪荣,冯静,梁瑞红,等.菠萝皮果胶的分离纯化及组成分析[J].热带作物学报,2012,32(8):1476-1481.
[3]张文华.菠萝皮黄酮类化合物的结构分析及其生理活性研究[D].湛江:广东海洋大学,2012.
[4]王芳,乔璐,淡小艳,等.桑叶黄酮的提取及抗氧化研究[J].广东农业科学,2011,38(15):76-79.
[5]韩雅慧,陶宁萍.甘草黄酮提取及其抗氧化能力测定方法研究进展[J].山西农业科学,2010,38(11):89-93.
[6]冯颖,王建国,孟宪军,等.无梗五加果黄酮类化合物生物活性研究[J].食品研究与开发,2008,29(1):30-33.
[7]孙芝杨,钱建亚,陈卫.宁夏枸杞子中类黄酮的提取及其性质研究[J].食品科学,2008,29(3):188-194.
[8]李铭芳,李淑芳,汪小强,等.枸杞中总黄酮的分析方法及提取工艺研究[J].天津农业科学,2011,17(1):46-50.
[9]黄明玉,罗胜勇.山茶花总黄酮抗肿瘤作用的实验研究[J].中国医药指南,2012,10(1):3-5.
[10]Wang B,Zhang X.Inhibitory effectsof Broccolinileaf flavonoidson human cancer cells[J].Scanning,2012,34(1):1-5.
[11]杨秀松.金花葵粗黄酮提取物的免疫调节作用研究[J].中国药师,2013,16(9):1307-1311.
[12]冯朋,张丽萍,白利涛.银杏中黄酮类化合物提取分离方法研究进展[J].天津农业科学,2012,18(2):42-45.
[13] N AL-Waili,A Al Ghamdi,MJAnsari,et al.Differences in composition of honey samplesand their impact on theantimicrobial activitiesagainst drugmultiresistant bacteriaand pathogenic fungi[J].Archivesof Medical Research,2013,44(4):307-316.
[14]张雁冰,艾国民,王克让,等.马桑叶提取物的杀虫杀菌活性初步研究[J].河南农业科学,2006(1):60-63.
[15]王志杰,黄铁牛.黄芪多种成分对豚鼠皮肤型人疱疹病毒感染的治疗作用 [J].中国现代应用药学杂志,2003,20(6):452-455.
[16]范丽,董六一,江勤,等.黄蜀葵花总黄酮抗炎解热作用[J].安徽医科大学学报,2003,38(1):25-27.
[17]Yasukawa K,Takido M,Takeuchi M,et al.Effects of chemical constituents from plants on 12-o-tetradecanoylphorbol-13-acetateinduced inflammation in mice[J].Chem Pharm Bull,1989,37(4):1071-1073.
[18]Habtemariam S.Flavonoids as inhibitors or enhancers of the cytotoxicity of tumor necrosisfactor-αin L-929 tumor cells[J].Journal of Natural Products,1997,60(8):775-778.
[19]Simoes C M O,Amoros M,Girrl L,et al.Antiviral activity of ternatin and meliternati-n,3-methoxy flavones from species of Rutaceae[J].Journal of Natural Products,1990,53(4):989-992.
[20]CalabròM L,Galtieri V,Cutroneo P,et al.Study of the extraction procedureby experimental design and validation of a LCmethod for determination of flavonoids in Citrus bergamia juice[J].Journal of Pharmaceutical and Biomedical Analysis,2004,35(2):349-363.
[21]严建刚,张名位,杨公明,等.芹菜黄酮的提取条件及其抗氧化活性研究 [J].西北农林科技大学学报:自然科学版,2005,33(1):131-135.
[22]崔介君.花生壳中黄酮成分的研究[D].杭州:浙江工业大学,2004.
[23]陈郑镔.白檀叶总黄酮和果肉红色素的初步研究[D].福州:福建师范大学,2005.
[24]黄泽元,王海滨,刘志伟.芝麻叶中总黄酮的最佳提取工艺研究[J].农业工程学报,2004,20(6):201-204.
[25]王永涛.洋葱皮黄酮类化合物提取技术的研究[D].石家庄:河北科技大学,2009.
[26]国家药典委员会.中华人民共和国药典2000年版一部[M].北京:化学工业出版社,2000.
[27]姜贵全.地榆中药用活性成分提取工艺及稳定性研究 [D].哈尔滨:东北林业大学,2005.
[28]张秀梅,杜丽清,孙光明,等.菠萝果实发育过程中糖积累与其代谢酶的关系[J].热带作物学报,2008,29(1):10-13.
[29]菲尼马(美).食品化学[M].王璋,译.北京:中国轻工业出版社,2003.
[30]陈林林,吴春.菟丝子黄酮成分分析及对食用油脂的抗氧化活性[J].食品科学,2012,33(15):103-106.
[31]孙静,黄芸,孙桂波,等.河北香菊中黄酮类成分体外抗氧化活性研究及构效关系探讨 [J].中国中药杂志,2012,37(13):1958-1962.
[32]Shenvi S,Kumar K,Hatti K S,et al.Synthesis,anticancer and antioxidant activities of 2,4,5-trimethoxy chalcones and analogues from asaronaldehyde:Structure-activity relationship[J].European Journal of Medicinal Chemistry,2013,62:435-442.

