氟哌噻吨美利曲辛联合美沙拉秦治疗伴焦虑抑郁状态溃疡性结肠炎患者的临床观察
谢 睿 高成城 吴尚农 严 伟 马天恒
南京医科大学附属淮安第一医院消化科(223300)
溃疡性结肠炎(ulcerative colitis, UC)是累及结直肠的慢性非特异性炎症性疾病,其病因和发病机制尚不清楚,主要临床表现为反复发作的腹痛、腹泻、黏液脓血便等。随着生物医学模式向生物-心理-社会医学模式的转变,目前认为除遗传、免疫、感染等因素外,精神心理因素亦在UC的发生、发展和复发中起重要作用,并互为因果、相互影响[1-2]。为探讨抗焦虑、抑郁治疗对UC患者的作用,本研究应用氟哌噻吨美利曲辛联合美沙拉秦治疗伴焦虑、抑郁状态的UC患者,评价其疗效和安全性。
对象与方法
一、临床资料
纳入2010年1月至2011年9月在淮安市第一人民医院就诊的UC患者80例,其中男32例,女48例,平均年龄(36.5±11.2)岁,平均病程(4.9±1.2)年。入组患者均完成整个治疗过程,无退出和失访者。
二、分组和治疗方案
采用完全随机设计将80例患者分为观察组和对照组,每组40例。两组均给予美沙拉秦肠溶片(商品名莎尔福,德国霍克大药厂)3.0 g/d,分3次口服;观察组同时给予氟哌噻吨美利曲辛片(商品名黛力新,每片含三氟噻吨0.5 mg,四甲蒽丙胺10 mg,丹麦灵北制药公司)口服,每日2次,每次1片。疗程均为8周。两组患者性别、年龄、病情严重程度和病程差异均无统计学意义(P>0.05)。研究方案经医院伦理委员会批准,所有入选者对研究方案均知情同意。
三、评估标准、纳入/排除标准和观察指标
1. 评估标准:①病情分期:采用Southerland疾病活动指数(disease activity index, DAI)[3]进行评估,腹泻、便血、黏膜表现和医师评估病情四项分别按0、1、2、3计分,总分≤2分为症状缓解,3~5分为轻度活动,6~10分为中度活动,11~12分为重度活动。②焦虑/抑郁状态:采用综合医院焦虑抑郁量表(hospital anxiety and depression scale, HADS)[4]进行评估,该量表含有14项条目[7项评价焦虑(HA评分),7项评价抑郁(HD评分)],分别按0~3级评分,总分0~7分为正常,8~10分为轻度焦虑/抑郁,11~14分为中度焦虑/抑郁,15~21分为重度焦虑/抑郁。③内镜分级:采用改进的Baron内镜下UC活动度分级标准[5]进行评估,0级为黏膜正常,Ⅰ级为黏膜充血、血管模糊,Ⅱ级为黏膜有接触性出血,Ⅲ级为黏膜有自发性出血,Ⅳ级为黏膜可见大小不等的溃疡。④生存质量:采用炎症性肠病问卷(inflammatory bowel disease questionnaire, IBDQ)[6]进行评估,得分越高代表生存质量越好。⑤安全性:采用美国国立精神卫生研究所(NIMH)制订的治疗意外症状量表(treatment emergent symp-tom scale, TESS)[7],即副反应量表进行评估。
2. 纳入标准:诊断符合2007年中华医学会消化病学分会炎症性肠病协作组推荐的UC诊断标准[3],选择处于轻、中度活动期(DAI 3~10分)、伴轻、中度焦虑、抑郁状态(HADS 8~14分)的UC患者。
3. 排除标准:重度UC(DAI 11~12分);重度焦虑、抑郁(HADS 15~21分);就诊前1个月内服用抗焦虑、抑郁药;胃肠道、肝、胆、胰、心、肾等脏器严重器质性疾病;传染性、遗传性、代谢性、内分泌性疾病;乙醇或药物滥用史;未经治疗的闭角型青光眼;妊娠、哺乳期女性;美沙拉秦过敏。
4. 观察指标:观察两组患者治疗第0天以及1周末和(或)4、8周末的临床症状(DAI评分)、内镜表现、HADS、IBDQ评分和安全性,并行血、尿、粪常规、肝肾功能、电解质等实验室指标和心电图检查。DAI≤2分定义为临床缓解,Baron内镜分级 0~Ⅰ级定义为内镜缓解。
四、统计学分析
结 果
一、临床症状
1. DAI评分:治疗前和治疗1周末,观察组与对照组间DAI评分差异无统计学意义(P>0.05);治疗4、8周末,观察组DAI评分明显低于对照组,组间差异有统计学意义(P<0.05)(表1)。
2. 临床缓解率:治疗1周末,观察组和对照组临床缓解率均为0%;治疗4周末,观察组临床缓解率为 80.0%(32/40),明显高于对照组的47.5%(19/40),组间差异有统计学意义(χ2=9.141,P=0.002);治疗8周末,观察组临床缓解率为92.5%(37/40),明显高于对照组的75.0%(30/40),组间差异有统计学意义(χ2=4.501,P=0.034)。
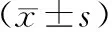
表1 观察组与对照组治疗前后DAI评分比较
二、内镜缓解率
治疗8周末,观察组Baron内镜分级缓解率为95.0%(38/40),明显高于对照组的77.5%(31/40),组间差异有统计学意义(χ2=5.165,P=0.023)。
三、HADS评分
治疗前,观察组与对照组间HA、HD评分差异均无统计学意义(P>0.05);治疗1、4、8周末,观察组HA、HD评分均明显低于对照组,组间差异有统计学意义(P<0.05)(表2)。
四、IBDQ评分
治疗前,观察组与对照组间IBDQ评分差异无统计学意义(78.55±14.48对76.32±15.41,t=0.666,P=0.508);治疗4、8周末,观察组IBDQ评分分别为137.31±11.82和195.05±11.01,对照组分别为131.65±8.16和187.55±11.79,组间差异均有统计学意义(t=2.487,P=0.015;t=2.941,P=0.004)。
五、安全性
观察组和对照组治疗前后血、尿、粪常规、肝肾功能、电解质和心电图均无明显变化。观察组出现睡眠障碍3例、腹胀3例、恶心2例、口干1例、头晕1例,对照组腹胀4例、腹泻2例,症状均为轻度,患者能耐受,未予特殊处理。治疗第0天和4、8周末两组间TESS评分均无明显差异(P>0.05)。
讨 论
各种应激、心理创伤均可促使UC发生、加重或复发,而UC本身亦可导致情绪障碍发生或加重,因此UC与情绪障碍之间存在着不可忽视的相互作用[8-11]。50%以上的UC患者认为精神心理因素对其疾病过程产生影响,该比例显著高于其他疾病患者[12]。UC患者最常见的精神心理异常是不同程度的焦虑、抑郁,发病率高于一般人群以及其他慢性病[12-13]。研究证实UC患者情绪稳定性差,易出现紧张、焦虑、抑郁,存在较多的疑病和焦虑、抑郁症状[12-14]。对个性特征的分析发现,UC患者不善于区分情绪状态与躯体感觉,在表露内心感受和态度方面表现较差,较少自发倾诉焦虑、抑郁情绪,而是更多地表现为躯体症状[13-14]。现已发现抗焦虑和抗抑郁治疗可减轻UC患者的临床症状,改善生活质量[8,15-16]。因此,对于伴焦虑、抑郁状态的UC患者,应在常规治疗的基础上给予抗焦虑、抑郁药。
在IBD的发生、发展过程中,焦虑和抑郁主要通过一系列神经免疫、内分泌机制导致肠屏障功能下降,其中促皮质素释放激素(CRH)释放、迷走神经激活、肥大细胞分泌介质等引发免疫细胞、肠道神经细胞与上皮细胞间的相互作用,使组织和血清中的细胞因子如白细胞介素-6(IL-6)、肿瘤坏死因子(TNF)、干扰素-γ(IFN-γ)水平升高,最终导致UC发生、活动或复发[17]。
临床上应用的抗焦虑、抑郁药主要为三环类或选择性5-羟色胺再摄取抑制剂,但这些药物禁忌证和不良反应较多,临床应用受到很大限制。氟哌噻吨美利曲辛为二盐酸三氟噻吨与盐酸四甲蒽丙胺组成的合剂,前者是一种神经阻滞剂,小剂量时主要作用于突触前膜多巴胺自身调节受体(D2受体),促进多巴胺合成和释放,使突触间隙中的多巴胺含量增加,从而发挥抗焦虑和抗抑郁作用;后者可抑制突触前膜对去甲肾上腺素和5-羟色胺的再摄取,提高突触间隙单胺类递质含量,并能对抗大剂量三氟噻吨可能产生的锥体外系症状。两者合用能协同调整中枢神经系统功能,且不影响各自单独的药代动力学特性[18-19]。三氟噻吨和四甲蒽丙胺吸收后达到血药峰值的时间短、半衰期长,因此氟哌噻吨美利曲辛起效迅速,服药后3~5 d有效,7~10 d 效果显著,且药效持续时间长。
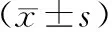
表2 观察组与对照组治疗前后HADS评分比较
本研究发现,对照组患者经美沙拉秦治疗后,临床症状逐渐缓解,HADS和IBDQ评分较治疗前明显改善,说明随着临床症状的好转,患者的焦虑、抑郁状态亦逐渐好转。观察组患者经氟哌噻吨美利曲辛联合美沙拉秦治疗后,临床症状缓解、内镜下黏膜修复以及HADS、IBDQ评分均优于同时点对照组,组间差异有统计学意义,说明抗焦虑、抑郁治疗不仅能改善患者的精神状态和生活质量,还能促进临床症状缓解和炎症黏膜修复。观察组与对照组间HADS评分在治疗1周末即出现显著差异,说明氟哌噻吨美利曲辛起效快,临床应用可增加患者的依从性,与相关文献报道一致[19]。两组患者治疗中和治疗后均无严重不良反应和并发症出现,治疗前后两组间TESS评分均无明显差异,提示氟哌噻吨美利曲辛联合美沙拉秦治疗方案安全可靠。
综上所述,对于伴焦虑、抑郁状态的UC患者,应用氟哌噻吨美利曲辛联合美沙拉秦能显著提高临床疗效,改善患者的精神状态和生活质量且安全可靠,值得在临床上推广。由于本研究未选取重度UC和伴重度焦虑、抑郁状态的患者,该疗法对这部分患者的疗效尚不清楚。UC为慢性反复发作性疾病,而本研究观察期仅为8周,因此其远期疗效和安全性有待更大样本的长期临床观察加以评估。
1 Kurina LM, Goldacre MJ, Yeates D, et al. Depression and anxiety in people with inflammatory bowel disease[J]. J Epidemiol Community Health, 2001, 55 (10): 716-720.
2 Mittermaier C, Dejaco C, Waldhoer T, et al. Impact of depressive mood on relapse in patients with inflammatory bowel disease: a prospective 18-month follow-up study[J]. Psychosom Med, 2004, 66 (1): 79-84.
3 中华医学会消化病学分会炎症性肠病协作组. 对我国炎症性肠病诊断治疗规范的共识意见[J]. 胃肠病学, 2007, 12 (8): 488-495.
4 Zigmond AS, Snaith RP. The hospital anxiety and depression scale[J]. Acta Psychiatr Scand, 1983, 67 (6): 361-370.
5 黄红丽,聂玉强,李瑜元. 溃疡性结肠炎临床严重度分型与内镜、病理分级的关系[J]. 现代消化及介入诊疗, 2008, 13 (2): 79-81.
6 周璐,陆星华. 炎症性肠病患者的健康相关生存质量[J]. 中华内科杂志, 2004, 43 (5): 392-394.
7 张明园. 精神科评定量表[M]. 长沙: 湖南科学技术出版社, 1993: 162-165.
8 Kiebles JL, Doerfler B, Keefer L. Preliminary evidence supporting a framework of psychological adjustment to inflammatory bowel disease[J]. Inflamm Bowel Dis, 2010, 16 (10): 1685-1695.
9 Sewitch MJ, Abrahamowicz M, Bitton A, et al. Psychological distress, social support, and disease activity in patients with inflammatory bowel disease[J]. Am J Gastroenterol, 2001, 96 (5): 1470-1479.
10 Mawdsley JE, Macey MG, Feakins RM, et al. The effect of acute psychologic stress on systemic and rectal mucosal measures of inflammation in ulcerative colitis[J]. Gastroenterology, 2006, 131 (2): 410-419.
11 Lerebours E, Gower-Rousseau C, Merle V, et al. Stressful life events as a risk factor for inflammatory bowel disease onset: A population-based case-control study[J]. Am J Gastroenterol, 2007, 102 (1): 122-131.
12 Moser G. Depression and anxiety in inflammatory bowel disease[J]. Gastroenterol Hepatol, 2009, 32 (Suppl 2): 9-12.
13 Nahon S, Lahmek P, Saas C, et al. Socioeconomic and psychological factors associated with nonadherence to treatment in inflammatory bowel disease patients: results of the ISSEO survey[J]. Inflamm Bowel Dis, 2011, 17 (6): 1270-1276.
14 罗秋华,邹天然,陈掌珠,等. 心理社会因素在溃疡性结肠炎中的作用[J]. 世界华人消化杂志, 2008, 16 (5): 556-558.
15 von Wietersheim J, Kessler H. Psychotherapy with chronic inflammatory bowel disease patients: a review[J]. Inflamm Bowel Dis, 2006, 12 (12): 1175-1184.
16 Janke KH, Klump B, Gregor M, et a1. Determinants of life satisfaction in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2005, 1l (3): 272-286.
17 Mawdsley JE, Rampton DS. Psychological stress in IBD: new insights into pathogenic and therapeutic implications[J]. Gut, 2005, 54 (10): 1481-1491.
18 Meeus O, De Ridder D, Van de Heyning P. Administration of the combination clonazepam-Deanxit as treatment for tinnitus[J]. Otol Neurotol, 2011, 32 (4): 701-709.
19 付剑亮,赵玉武,孙晓江. 乌灵胶囊联合黛力新治疗脑卒中后抑郁疗效和安全性的随机对照研究[J]. 中西医结合学报, 2008, 6 (3): 258-261.

