Preparation and Application of Sensitive Enzymeless Sensor for Hydrogen Peroxide Based on Prussian Blue/PDDA-Graphene Modified Electrode*
ZHANG Lehua,ZHANG Huayang,LI Chong,JIA Liping,WANG Huaisheng*
(1.College of Chemistry and Chemical Engineering,Liaocheng University,Liaocheng Shandong 252059,China; 2.School of Materials Science and Engineering,Shandong University,Jinan 250061,China)
Preparation and Application of Sensitive Enzymeless Sensor for Hydrogen Peroxide Based on Prussian Blue/PDDA-Graphene Modified Electrode*
ZHANG Lehua1,ZHANG Huayang2,LI Chong1,JIA Liping1,WANG Huaisheng1*
(1.College of Chemistry and Chemical Engineering,Liaocheng University,Liaocheng Shandong 252059,China; 2.School of Materials Science and Engineering,Shandong University,Jinan 250061,China)
A novel,sensitive and enzymeless electrochemical sensor based on Prussian blue/poly(diallyldimethylammonium chloride)functionalized graphene composite film was fabricated for the detection of hydrogen peroxide.Graphite oxide was synthesized chemically by Hummers method and then was reduced by hydrazine hydrate in the presence of PDDA.Prussian blue(PB)was deposited on PDDA-G matrix by electrochemical method.With the synergistic effect of PDDA-G and PB,the PDDA-G/PB composite film(PB/PDDA-G/GCE)modified electrode shows good electrocatalytic ablitily toward H2O2reduction,at an applied potential of-0.3 V,which can be used as an H2O2enzymeless sensor.The sensor showed good response to H2O2reduction in a wide linear range of 3.0 μmol/L~2 061.0 μmol/L,and the detection limit was 1.0 μmol/L(S/N=3).This sensor will be promising for the fast detection of H2O2in real sample.
hydrogenperoxide;enzymeless sensors;poly(diallyldimethylammonium chloride);graphene; prussian blue
过氧化氢(H2O2)在食品、工业、临床、制药和环境分析等领域中具有重要的作用[1-2]。H2O2是生物体内多种生化反应的重要产物之一,与很多疾病的发生有关[3]。因此,对于H2O2的检测具有理论和实际意义。目前,检测H2O2的方法有化学发光法[4]、荧光法[5]、分光光度法[6]及电化学方法等[7-8]。其中电化学方法由于其成本较低、所需仪器简单、灵敏高效等优点而受到广泛重视[9-11]。H2O2的传感器很多,主要包括酶传感器和无酶传感器两种。但是在实际工作中,酶传感器中所使用的酶常常受温度、pH等外界条件的影响而失活导致传感器的寿命较短[12]。因此,H2O2传感器因为其所固定的酶或蛋白质复杂、不稳定、易变质等而使其应用受到限制[13]。所以,有必要创建灵敏、简单的H2O2无酶传感器。
自从2004年Novoselov用机械剥离的方法制备出单层石墨烯片层以来[14],石墨烯以其独特的结构和优异的性能成为研究的热点[15]。但是石墨烯片层之间有很强的范德华力,容易发生团聚,使其难溶于水及常用的有机溶剂,这给石墨烯的进一步研究和应用造成了极大的困难[16]。通过引入特定的官能团对石墨烯进行功能化,可以赋予石墨烯新的性质,进一步拓展其应用领域[17]。目前常用的功能化方法有两种:共价键和非共价键功能化。共价键功能化石墨烯是利用苯六元环结构的边缘及缺陷部位的活性环氧基团与改性剂的化学反应,共价键功能化会破坏石墨烯的结构,改变其本身的物理化学性质。而非共价键功能化石墨烯的制备过程简单,还能保持石墨烯本身的结构和性质。聚二烯丙基二甲基氯化铵(PDDA)是一种水溶性的离子导电聚合物,可以通过其与石墨烯之间的π-π相互作用将石墨烯功能化,使其在水中能较好地分散[18],拓展了石墨烯在电化学分析中的应用[19]。另外,由于PDDA可以赋予石墨烯表面正电荷,可与带负电的材料进行复合形成新的纳米复合材料[20]。
普鲁士蓝对于H2O2电催化的高灵敏度和高选择性曾受到人们的广泛关注,因而被称为“人工过氧化物酶”[21-27]。1984年Itaya等报道了普鲁士蓝的还原态(PW(K4Fe2+4[Fe2+(CN)6]3))对于O2和H2O2的还原有催化活性[28-29],之后,基于普鲁士蓝的H2O2电化学传感器的研究也引起人们的注意。基于普鲁士蓝的传感器对H2O2的还原具有较好的电催化性,较低的检出限和较好的选择性[30],并且工作电位较低,可以减小样品中其他电活性物质的干扰影响[31]。张培培等[32]用电化学方法在玻碳电极表面引入磺酸根,然后分别在Fe3+溶液和[Fe (CN)6]4-溶液中交替吸附形成普鲁士蓝晶体,该晶体对H2O2有很高的电催化活性,检出限为0.48 mmol/L,检测范围为0.97 mmol/L~32.33 mmol/L。李丽花等[33]在碳纳米管修饰玻碳电极表面电聚合一层普鲁士蓝膜,该修饰电极对H2O2有明显的催化效应。本实验在PDDA功能化的石墨烯表面电沉积普鲁士蓝制备了H2O2传感器。
本实验以水合肼为还原剂,PDDA作为分散剂和功能化试剂制备了PDDA功能化的石墨烯(PDDA-G),将其滴涂在玻碳电极表面得到PDDA-G/ GCE。用循环伏安扫描法将普鲁士蓝电沉积在PDDA-G薄膜上,制得修饰电极PB/PDDA-G/GCE。研究了H2O2在该修饰电极上的电催化还原行为,实验结果证明,该修饰电极作为H2O2传感器可以大大降低对H2O2的检测限,而且拓宽了其检测范围,且具有良好的抗干扰能力,检测结果令人满意。
1 实验部分
1.1 试剂
石墨粉(325 mesh,99.9995%,Alfa Aesar公司),聚二烯丙基二甲基氯化铵(PDDA)(MW= 200 000~350 000,Sigma公司),浓硫酸,高锰酸钾,水合肼(80%),H2O2(30%,天津市光复精细化工研究所),氯化钾(KCl),盐酸(HCl),铁氰化钾(K3Fe (CN)6),氯化亚铁(FeCl2·4H2O),磷酸氢二钠(Na2HPO4),磷酸二氢钠(NaH2PO4),抗坏血酸(AA),多巴胺(DA),尿酸(UA),葡萄糖(Glucose)以上试剂均为分析纯,使用时未经过进一步纯化,实验用水均为二次水。0.1 mol/L的PBS缓冲溶液由0.1 mol/L的Na2HPO4和0.1 mol/L的NaH2PO4制得。
1.2 仪器
AG135电子天平(上海梅特勒公司),pHS-3C型酸度计(上海第二分析仪器厂),78HW-1恒温磁力搅拌器(江苏金坛荣华仪器公司),KQ2200DB型超声波清洗器(昆山市超声仪器有限公司),Anke TGL-16B型离心机(上海安亭科学仪器厂),H-1650高速台式离心机(长沙湘仪离心机仪器有限公司)。电化学实验使用CHI660b电化学工作站(CH Inc.上海辰华仪器公司),利用传统的三电极体系:铂丝电极为对电极,裸玻碳电极或修饰玻碳电极为工作电极,Ag/AgCl电极为参比电极。
1.3 PDDA功能化的石墨烯的制备
用Hummer法[34]制备0.5 mg/mL的氧化石墨(GO),并超声分散3 h。取1 mL 20%PDDA稀释至50 mL,将50 mL GO慢慢加入到PDDA溶液中,磁力搅拌30 min后,加入1 mL水合肼,然后将混合液在100℃条件下反应3 h。产物经离心、洗涤后于60℃下干燥,即得PDDA-G。
1.4 修饰电极的制备
首先将玻碳电极(直径3.0 mm)在金相砂纸上打磨成镜面,然后再用50 nm湿润的Al2O3在抛光布上抛光,用二次蒸馏水冲洗干净,再分别在乙醇和二次蒸馏水中超声1 min,用氮气吹干。用微量进样器取5.0 μL PDDA-G溶液滴涂于玻碳电极表面,自然晾干,得到PDDA-G/GCE。
将PDDA-G/GCE置于N2饱和的含有2 mmol/L FeCl2+2 mmol/L K3[Fe(CN)6]+0.1 mol/L KCl+0.01 mol/L HCl的电沉积溶液[29]中,在-0.2 V~0.5 V之间循环伏安扫描10圈(扫速为50 mV/s),即得PB/PDDA-G/GCE。然后,用去离子水洗去多余的未吸附上的离子,将PB/PDDA-G/GCE在0.1 mol/L KCl溶液(含有0.01 mol/L HCl,N2饱和)中于-0.2 V~0.5 V之间循环伏安扫描10圈。
2 结果与讨论
2.1 修饰电极制备条件的优化
为了获得性能比较好的传感器,对PDDA-G复合膜制备过程中氧化石墨(GO)和PDDA的浓度等条件进行了优化。实验发现0.5 mg/mL GO和0.4%(wt.)PDDA制备的PDDA-G复合膜沉积普鲁士蓝膜后形成的复合膜修饰电极对H2O2催化还原的能力最强。
普鲁士蓝的电沉积电位、溶液的pH、支持电解质的浓度等与所制备的H2O2传感器的灵敏性、稳定性等性质有关[35-36]。Itaya研究表明,有一部分阳离子(激活离子)能进入普鲁士蓝的晶格中提高其电化学活性,如K+、Rb+、Cs+、NH+4[37-38]。所以本实验电沉积溶液中加入了0.1 mol/L KCl作为支持电解质。图1(A)为PDDA-G/GCE在N2饱和的电沉积溶液中于-0.2 V~0.5 V之间连续扫描的循环伏安曲线。可见,随着扫描圈数的增加,普鲁士蓝的氧化还原峰电流逐渐增大,峰电位变化不大且峰电位差较小,可逆性较好[39],表明普鲁士蓝已经逐渐沉积到电极表面。当扫描圈数超过10圈以后,普鲁士蓝的氧化还原峰电流增加速度变慢,这可能是由于普鲁士蓝膜逐渐变厚的缘故。实验还发现,H2O2在修饰电极上的还原峰电流也会随着扫描圈数的增加而相应地变小。结果表明,普鲁士蓝的最佳电沉积圈数为10圈。将电沉积10圈后的普鲁士蓝膜修饰电极PB/PDDA-G/GCE在KCl溶液中连续循环扫描10圈,可以得到稳定的循环伏安曲线如图1(B),表明修饰电极表面比较稳定。普鲁士蓝在酸性条件下对H2O2有很高的灵敏度和很好的稳定性,但在实际应用中普鲁士蓝最主要的缺点是在中性或碱性条件下不稳定[29]。因此,本实验测定过程选择0.1 mol/L pH 6.0 PBS为支持电解质。由于普鲁士蓝对O2的还原也有一定的催化活性,为避免溶解氧对该传感器的干扰,本实验的整个过程是在通N2的条件下进行的。
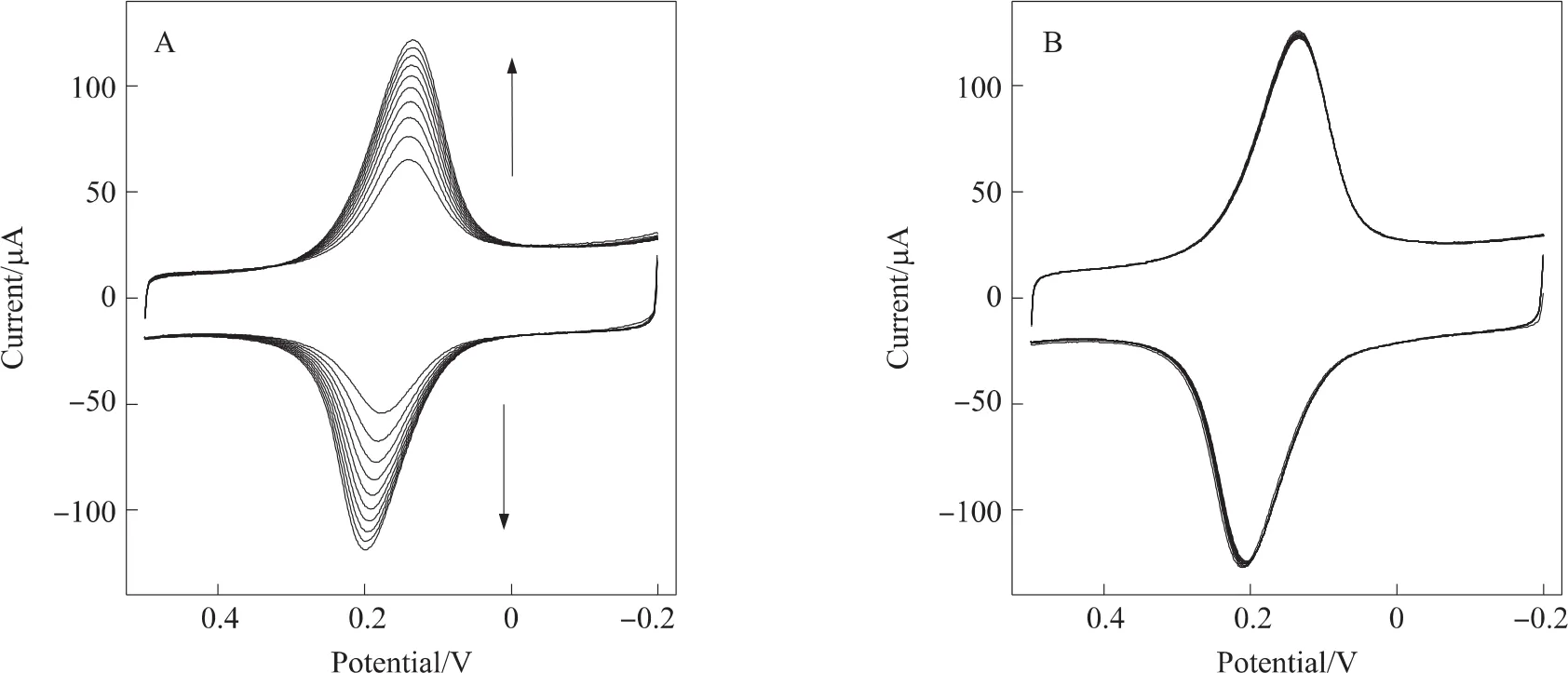
图1 (A)PDDA-G/GCE在N2饱和的电沉积溶液中循环伏安扫描10圈的循环伏安曲线(扫速:50 mV/s),(B)电沉积后PB/PDDA-G/GCE在N2饱和的0.1 mol/L KCl+0.01 mol/L HCl溶液中循环伏安扫描10圈的循环伏安曲线(扫速:50 mV/s)
2.2 修饰电极的电化学表征
图2(A)是不同修饰电极在0.1 mol/L pH 6.0 PBS中的循环伏安曲线。从图中可以看出,裸玻碳电极在底液中没有出现明显的氧化还原峰(曲线a); PDDA-G修饰到玻碳电极表面后,也没有出现明显的氧化还原峰但背景电流显著增大(曲线b);将普鲁士蓝电沉积到玻碳电极表面后,电极呈现出普鲁士蓝的一对氧化还原峰(曲线c)。而在PDDA-G/GCE上沉积PB后可以观察到明显的氧化还原峰且峰电流比在裸电极上沉积PB后显著增大(曲线d),这表明PDDA-G的存在有利于普鲁士蓝的沉积且能促进电子的传输。
用交流阻抗谱对修饰电极进行了表征,结果如图2(B)所示。交流阻抗随着电极的修饰而发生变化,其值约为阻抗谱半圆的直径。裸电极(曲线a)经过PDDA-G复合物修饰后,电化学阻抗明显减小(曲线b),这是因为带正电的PDDA-G与探针分子[Fe(CN)6]3-/4-发生静电吸引,促进了探针分子在电极表面的电子传递。与图2B-b相比,当复合修饰膜上电沉积上普鲁士蓝后,电化学阻抗略有减小(曲线c),造成这种现象的原因可能是普鲁士蓝中的一对氧化还原态的反应有利于电子的传递,同时也说明普鲁士蓝已经沉积于电极表面。普鲁士蓝中的一对氧化还原态的反应[29]:


图2 (A)裸GCE(a),PDDA-G/GCE(b),PB/GCE(c),PB/PDDA-G/GCE(d)在0.1 mol/L pH 6.0 PBS (含0.1 mol/L KCl,N2饱和)溶液中的循环伏安曲线,(B)裸GCE(a),PDDA-G/GCE(b),PB/PDDA-G/ GCE(c)在20 mmol/L[Fe(CN)6]3-/4-(含0.1 mol/L KCl)溶液中的交流阻抗图(施加电压:0.22 V,频率:1 Hz~100 kHz)
2.3 扫速对普鲁士蓝电化学行为的影响
图3(A)是在0.1 mol/L pH 6.0 PBS(含0.1 mol/L KCl,N2饱和)中,不同扫描速度下普鲁士蓝的电化学行为曲线。可以看出,在20 mV/s~300 mV/s的扫速范围内,随着扫速的增加,氧化还原峰电流和峰电位差逐渐增大,而且氧化还原峰电流与扫描速度呈线性关系(如图3(B))。综上说明,普鲁士蓝在PDDA-G/GCE修饰电极上的氧化还原过程是表面控制的准可逆电化学过程[22,40-41]。
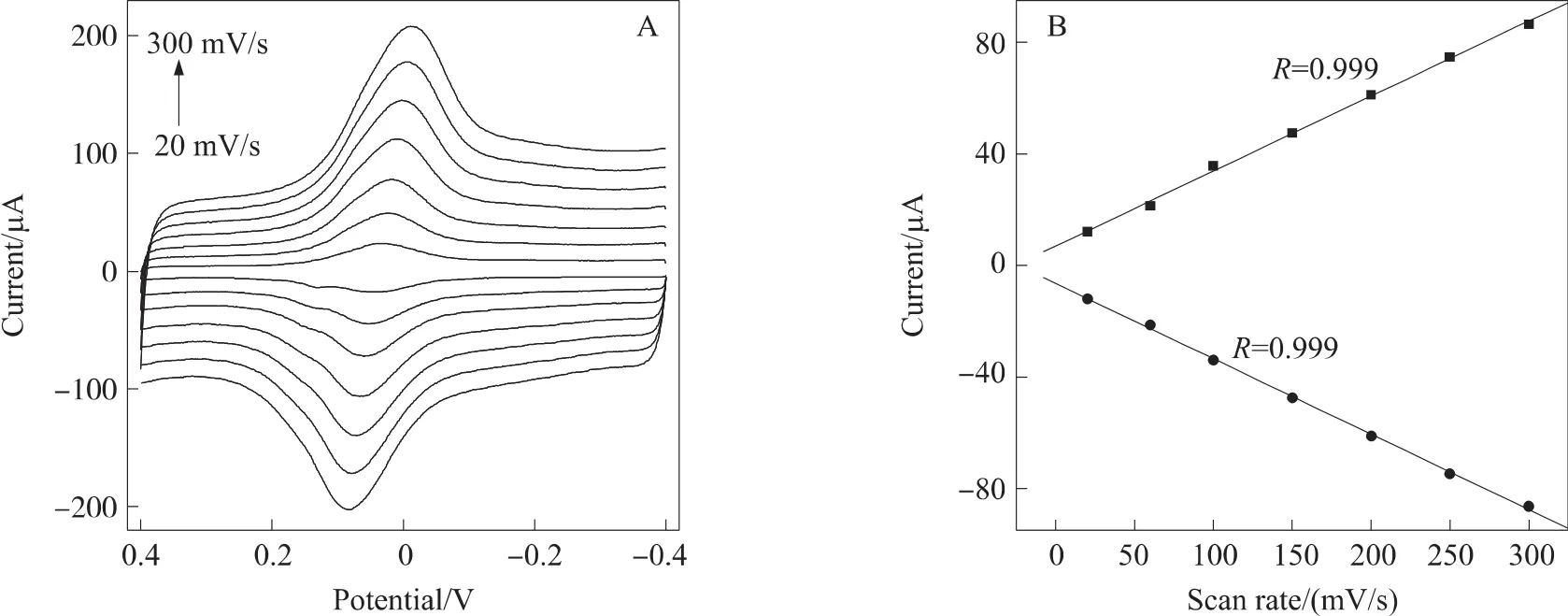
图3 (A)PB/PDDA-G/GCE在不同扫速下的循环伏安曲线(电解液:N2饱和的含有0.1 mol/L KCl的0.1 mol/L pH 6.0 PBS,扫速分别为:20、60、100、150、200、250和300 mV/s),(B)氧化还原峰电流与扫描速度间的关系曲线
2.4 复合膜修饰电极的电催化性能研究
利用循环伏安法和计时电流法研究了修饰电极PB/PDDA-G/GCE对H2O2的电催化还原作用。从图4(A)中可以看出,当有H2O2存在时,普鲁士蓝的还原峰电流增大,氧化峰电流减小,表现出对H2O2还原的催化性质。随着H2O2浓度的增加,普鲁士蓝的氧化峰电流逐渐减小,而还原峰电流显著增大,而在-0.3 V左右,还原电流增加的比较快,这说明PB/PDDA-G/GCE对H2O2有很好的电催化还原作用。图4(B)为工作电位-0.3 V,PDDA-G/GCE和PB/PDDA-G/GCE分别作为传感器时对H2O2响应的计时电流曲线。可见,PDDA-G/GCE对H2O2的响应非常小,而且响应也慢,而PB/PDDA-G/GCE对H2O2的响应比较大,响应速度非常快,在5 s内即可达到稳态电流值。这主要是因为普鲁士蓝Fe4[Fe(CN)6]3独特的沸石结构对小质量分子(如O2,H2O2,肼)有很好的催化能力[29]。因此,PB/PDDA-G/GCE可以作为传感器用于H2O2的检测。
2.5 计时电流法检测H2O2的含量
图5(A)是PB/PDDA-G/GCE作为传感器在工作电位为-0.3 V时,对不断加入H2O2的电流响应-时间曲线。在搅拌状态下,随着H2O2的加入,H2O2的还原电流快速增大。传感器达到95%稳定电流的响应时间小于5 s,且峰电流与H2O2的浓度在3.0 μmol/L~2 061 μmol/L范围内分两段呈线性关系(如图5(B)),线性回归方程分别为:
Ipc/μA=1.27+0.0674 c μmol/LR=0.999 (3.0 μmol/L~61 μmol/L)
Ipc/μA=5.03+0.0163 c μmol/LR=0.999 (61 μmol/L~2 061 μmol/L)
在信噪比为3时,传感器的检出限为1.0 μmol/L。
表1是不同修饰电极对H2O2检测的数据结果比较。由图表可知,本实验制备的PB/PDDA-G/ GCE修饰电极对H2O2的检出限较低,检测线性范围较宽。并且该修饰电极制备比较简单易行,可用于制备H2O2无酶传感器。

图4 (A)PB/PDDA-G/GCE在不同浓度H2O2存在下的循环伏安曲线(电解液:N2饱和的含有0.1 mol/L KCl的0.1 mol/L pH 6.0 PBS,扫速:100 mV/s),(B)PDDA-G/GCE,PB/PDDA-G/GCE在支持电解质中连续加入0.2 mmol/L H2O2的i-t曲线(工作电位:-0.3 V)

图5 (A)PB/PDDA-G/GCE在0.1 mol/L pH 6.0 PBS(含0.1 mol/L KCl,N2饱和)中连续加入一定量H2O2的i-t曲线(工作电位:-0.3 V),(B)传感器响应电流与H2O2浓度的线性关系曲线(内插图为0~61 μmol/L H2O2的放大图)
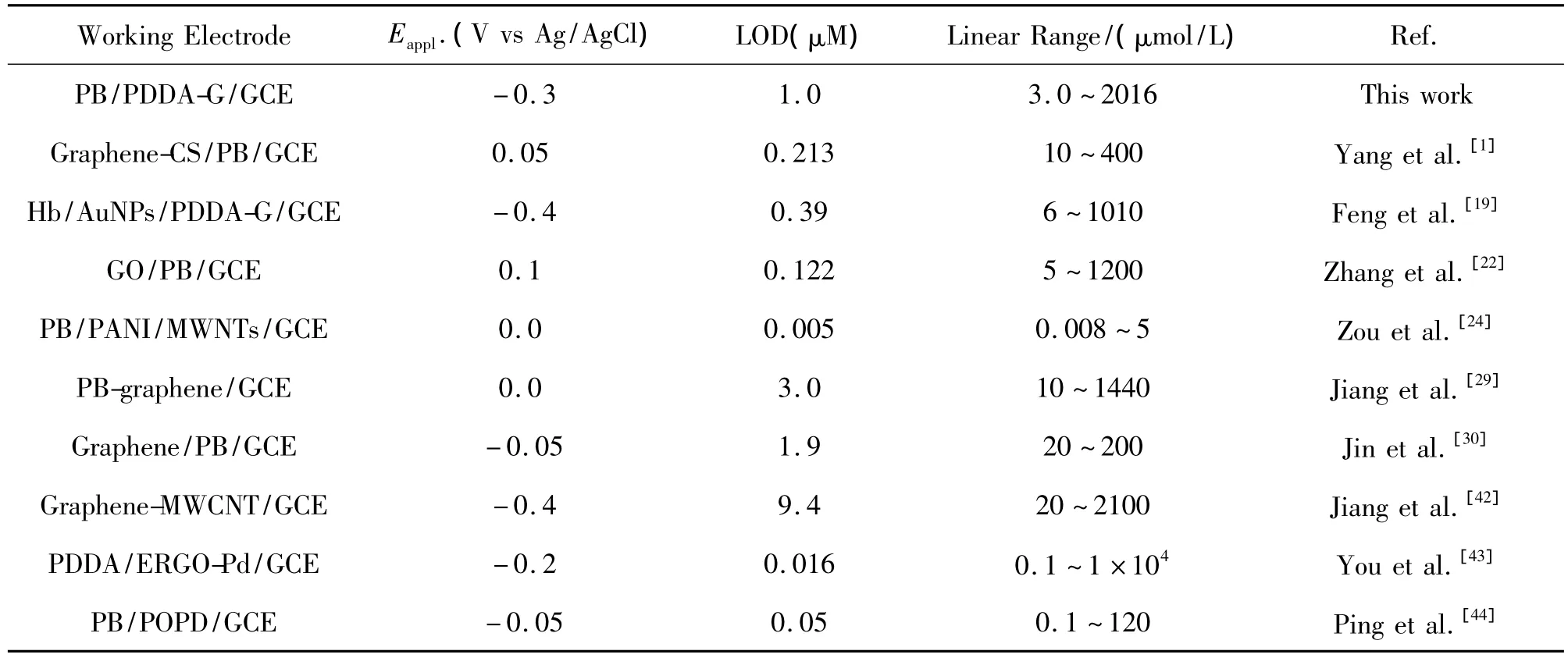
表1 不同修饰电极对H2O2检测的线性范围和检出限的对比
2.6 电极的抗干扰性
在电化学检测H2O2过程中,抗坏血酸(AA)、多巴胺(DA)、尿酸(UA)等电活性物质会对其产生信号干扰[45],所以有必要检测该传感器的抗干扰性。图6为在0.1 mol/L pH 6.0 PBS(含0.1 mol/L KCl,N2饱和)溶液中,考察了0.1 mmol/L H2O2在100倍尿酸,100倍抗坏血酸,100倍多巴胺和100倍葡萄糖存在时的干扰情况。实验发现,加入这些物质时虽然产生了微弱的响应信号,但几乎没有干扰传感器的电流响应[46],说明该传感器在较低的工作电位下可以有效地避免UA,AA,DA,Glucose的信号干扰。

图60 .1 mol/L pH 6.0 PBS(含有0.1 mol/L KCl,N2饱和)中加入H2O2、UA、AA、DA、Glucose的i-t曲线(工作电位:-0.3 V)
2.7 传感器的稳定性和重现性
稳定性和重现性是衡量一个传感器性能的重要指标。将PB/PDDA-G/GCE电极在0.1 mol/L pH 6.0 PBS(含有0.1 mol/L KCl,N2饱和)溶液中连续循环伏安扫描10圈后,峰电流无明显变化,说明修饰材料是比较稳定的。在4℃下于缓冲溶液中保存2周后,还原峰电流仅仅降低了4.7%。同方法制备的4支修饰电极,对0.1 mmol/L H2O2进行检测时,相对偏差为4.3%。结果说明,基于PB/PDDA-G/ GCE的生物传感器具有良好的稳定性。
3 结论
本实验以聚二烯丙基二甲基氯化铵(PDDA)作为分散剂和功能化试剂制备了PDDA功能化的石墨烯(PDDA-G),并将普鲁士蓝电沉积在PDDA-G复合膜上,制备了PB/PDDA-G/GCE复合膜修饰电极。实验证明,该修饰电极可以作为H2O2无酶传感器,避免了酶传感器中酶活性降低导致的传感器不稳定,而且制备时间短、操作简便。在工作电位为-0.3 V时,可以有效地避免其他电活性物质的干扰,检测H2O2的电流响应快,检出限较低,检测范围较宽,为H2O2传感器的研制提供了一种新方法。
[1]Yang J H,Myoung N,Hong H G.Facile and Controllable Synthesis of Prussian Blue on Chitosan-Functionalized Graphene Nanosheets for the Electrochemical Detection of Hydrogen Peroxide[J].Electrochim Acta,2012,81:37-43.
[2]李华清,刘春秀,郭宗慧,等.氧化还原聚合物修饰的过氧化氢传感器的研究[J].传感技术学报,2006,19(3):549-551.
[3]Huang Y,Li S F Y.Electrocatalytic Performance of Silica Nanoparticles on Grapheme Oxide Sheets for Hydrogen Peroxide Sensing[J].J.Electroanal Chem,2013,690:8-12.
[4]Fan Y W,Huang Y M.The Effective Peroxidase-Like Activity of Chitosan-Functionalized CoFe2O4Nanoparticles for Chemilumine-scence Sensing of Hydrogen Peroxide and Glucose[J].Analyst,2012,137(5):1225-1231.
[5]Lazrus A L,Kok G L,Gitlin S N,et al.Automated Fluorimetric Method for Hydrogen Peroxide in Atmospheric Precipitation[J].A-nal Chem,1985,57(4):917-922.
[6]Nogueira R F P,Oliveira M C,Paterlini W C.Simple and Fast Spectrophotometric Determination of H2O2in Photo-Fenton Reactions Using Metavanadate[J].Talanta,2005,66(1):86-91.
[7]Evans S A G,Elliott J M,Andrews L M,et al.Detection of Hydrogen Peroxide at Mesoporous Platinum Microelectrodes[J].Anal Chem,2002,74(6):1322-1326.
[8]Mao L,Osborne P G,Yamamoto K,et al.Continuous On-Line Measurement of Cerebral Hydrogen Peroxide Using Enzyme-Modified Ring-Disk Plastic Carbon Film Electrode[J].Anal Chem,2002,74(15):3684-3689.
[9]Xie L L,Xu Y D,Cao X Y.Hydrogen Peroxide Biosensor Based on Hemoglobin Immobilized at Graphene,Flower-Like Zinc Oxide,and Gold Nanoparticles Nanocomposite Modified Glassy Carbon Electrode[J].Colloids Surf,B,2013,107:245-250.
[10]Santhosh P,Manesh K M,Gopalan A,et al.Fabrication of a New Polyaniline Grafted Multi-Wall Carbon Nanotube Modified Electrode and Its Application for Electrochemical Detection of Hydrogen Peroxide[J].Anal Chim Acta,2006,575(1):32-38.
[11]Shen Y,Trauble M,Wittstock G.Detection of Hydrogen Peroxide Produced during Electrochemical Oxygen Reduction Using Scanning Electrochemical Microscopy[J].Anal Chem,2008,80(3): 750-759.
[12]Li M G,Xu S D,Tang M,et al.Direct Electrochemistry of Horseradish Peroxidase on Graphene-Modified Electrode for Electrocatalytic Reduction Towards H2O2[J].Electrochim Acta,2011,56 (3):1144-1149.
[13]Huang K J,Niu D J,Liu X,et al.Direct Electrochemistry of Catalase at Amine-Functionalized Graphene/Gold Nanoparticles Composite Flm for Hydrogen Peroxide Sensor[J].Electrochim Acta,2011,56(7):2947-2953.
[14]Novoselov K S,Geim A K,Morozov S V,et al.Electric Field Effect in Atomically Thin Carbon Films[J].Science,2004,306(5696): 666-669.
[15]Zhou K F,Zhu Y H,Yang X Y,et al.A Novel Hydrogen Peroxide Biosensor Based on Au-Graphene-HRP-Chitosan Biocomposites[J].Electrochim Acta,2010,55(9):3055-3060.
[16]Liu K P,Zhang J J,Yang G H,et al.Direct Electrochemistry and Electrocatalysis of Hemoglobin Based on Poly(Diallyldimethylammonium Chloride)Functionalized Graphene Sheets/Room Temperature Ionic Liquid Composite Film[J].Electrochem.Commun,2010,12(3):402-405.
[17]Fang Y X,Guo S J,Zhu C Z H,et al.Self-Assembly of Cationic Polyelectrolyte-Functionalized Graphene Nanosheets and Gold Nanoparticles:A Two-Dimensional Heterostructure for Hydrogen Peroxide Sensing[J].Langmuir,2010,26(13):11277-11282.
[18]Shen J F,Long Y,Li T,et al.One-Pot Polyelectrolyte Assisted Hydrothermal Synthesis of TiO2-Reduced Graphene Oxide Nanocomposite[J].Mater Chem Phys,2012,133(1):480-486.
[19]Feng Q L,Liu K P,Fu J J,et al.Direct Electrochemistry of Hemoglobin Based on Nano-Composite Film of Gold Nanopaticles and Poly(Diallyldimethylammonium Chloride)Functionalized Graphene[J].Electrochim Acta,2012,60:304-308.
[20]Liu W L,Zhang J F,Li C,et al.A Novel Composite Film Derived from Cysteic Acid and PDDA-Functionalized Graphene:Enhanced Sensing Material for Electrochemical Determination of Metronidazole[J].Talanta,2013,104:204-211.
[21]Liu Y,Chu Z Y,Jin W Q.A Sensitivity-Controlled Hydrogen Peroxide Sensor Based on Self-Assembled Prussian Blue Modified E-lectrode[J].Electrochem Commun,2009,11(2):484-487.
[22]Zhang Y,Sun X M,Zhu L Z,et al.Electrochemical Sensing Based on Graphene Oxide/Prussian Blue Hybrid Film Modified Electrode[J].Electrochim Acta,2011,56(3):1239-1245.
[23]Karyakin A A,Karyakina E E,Gorton L.Amperometric Biosensor for Glutamate Using Prussian Blue-Based“Artificial Peroxidase”as a Transducer for Hydrogen Peroxide[J].Anal Chem,2000,72 (7):1720-1723.
[24]Zou Y J,Sun L X,Xu F.Prussian Blue Electrodeposited on MWNTs-PANI Hybrid Composites for H2O2Detection[J].Talanta,2007,72(2):437-442.
[25]Wang W J,Wang F,Yao Y L,et al.Amperometric Bienzyme Glucose Biosensor Based on Carbon Nanotube Modified Electrode with Electropolymerized Poly(Toluidine Blue O)Film[J].Electrochim Acta,2010,55(23):7055-7060.
[26]Bai X Y,Chen G H,Shiu K K.Electrochemical Biosensor Based on Reduced Graphene Oxide Modified Electrode with Prussian Blue and Poly(Toluidine Blue O)Coating[J].Electrochim Acta,2013,89:454-460.
[27]Zhang Y N,Chu Z Y,Shi L,et al.Effect of Temperature-Controlled Poly(Diallyldimethylammonium Chloride)on Morphology of Self-Assembled Prussian Blue Electrode and Its High Detection Sensitivity of Hydrogen Peroxide[J].Electrochim Acta,2011,56(24): 8163-8167.
[28]Itaya K,Shoji N,Uchida I.Catalysis of the Reduction of Molecular Oxygen to Water at Prussian Blue Modified Electrodes[J].J Am Chem Soc,1984,106(12):3423-3429.
[29]Jiang Y Y,Zhang X D,Shan C S,et al.Functionalization of Graphene with Electrodeposited Prussian Blue Towards Amperometric Sensing Application[J].Talanta,2011,85(1):76-81.
[30]Jin E,Lu X F,Cui L L,et al.Fabrication of Graphene/Prussian Blue Composite Nanosheets and Their Electrocatalytic Reduction of H2O2[J].Electrochim Acta,2010,55(24):7230-7234.
[31]Zhang H,Yin Y J,Wu P,et al.Indirect Electrocatalytic Determination of Choline by Monitoring Hydrogen Peroxide at the Choline Oxidase-Prussian Blue Modified Iron Phosphate Nanostructures[J].Biosens Bioelectron,2012,31(1):244-250.
[32]张培培,王爱军,刘雪燕,等.层层自组装法制备普鲁士蓝修饰电极及对过氧化氢的测定[J].应用化学,2012,29(5):585-590.
[33]李丽花,徐琴,王海燕,等.普鲁士蓝-多壁碳纳米管复合材料修饰电极测定过氧化氢[J].分析化学研究报告,2007,35(6): 835-838.
[34]Hummers W S,Offeman R E.Preparation of Graphitic Oxide[J].J Am Chem Soc,1958,80(6):1339-1339.
[35]Kawiak J,Jedral T,Galus Z.A Reconsideration of the Kinetic Data for the Fe(CN)3-6,/Fe(CN)4-6,System[J].J Electroanal Chem,1983,145(1):163-171.
[36]Li L,Sheng Q L,Zheng J B,et al.Facile and Controllable Preparation of Glucose Biosensor Based on Prussian Blue Nanoparticles Hybrid Composites[J].Bioelectrochemistry,2008,74(1):170-175.
[37]Itaya K,Uchida I,Neff V D.Electrochemistry of Polynuclear Transition Metal Cyanides:Prussian Blue and Its Analogues[J].Acc Chem Res,1986,19(6):162-168.
[38]卢惠婷,陈昌国,董海峰.普鲁士蓝修饰生物传感器的研究进展[J].理化检验(化学分册),2010,46(4):460-464.
[39]Gaviglio C,Battaglini F.Hydrogen Peroxide Detection under Physiological Conditions by Prussian Blue Stabilized Using a Polyelectrolyte-Surfactant Complex Matrix[J].Sens Actuators B,2013,182: 53-57.
[40]Laviron E.General Expression of the Linear Potential Sweep Voltammogram in the Case of Diffusionless Electrochemical Systems[J].J Electroanal.Chem.Interfacial Electrochem,1979,101(1): 19-28.
[41]Laviron E,Roullier L.Electrochemical Reactions with Adsorption of the Reactants and Electrosorption.Simple Analytical Solutions for a Henry Isotherm[J].J Electroanal Chem,1998,443(2):195-207.
[42]Woo S,Kim Y R,Chung T D,et al.Synthesis of a Graphene-Carbon Nanotube Composite and Its Electrochemical Sensing of Hydrogen Peroxide[J].Electrochim Acta,2012,59:509-514.
[43]You J M,Kim D,Kim S K,et al.Novel Determination of Hydrogen Peroxide by Electrochemically Reduced Graphene Oxide Grafted with Aminothiophenol-Pd Nanoparticles[J].Sens Actuators B,2013,178:450-457.
[44]Ping J F,Wu J,Fan K,et al.An Amperometric Sensor Based on Prussian Blue and Poly(O-Phenylenediamine)Modified Glassy Carbon Electrode for the Determination of Hydrogen Peroxide in Beverages[J].Food Chem,2011,126(4):2005-2009.
[45]Thangamuthu R,Pan Y C,Chen S M.Electrocatalytic Reduction of Hydrogen Peroxide and Its Determination in Antiseptic and Soft-glass Cleaning Solutions at Phosphotungstate-Doped-Glutaraldehyde-Cross-Linked Poly-L-Lysine Film Electrodes[J].Sens Actuators B,2011,151 (2):377-383.
[46]姚飞,贾丽萍,霍瑞伟,等.纳米银/ds-DNA/聚(3,4-乙烯基二氧噻吩)复合膜修饰电极的制备及应用于过氧化氢无酶传感器[J].传感技术学报,2013,26(6):762-768.

张乐华(1989-),女,硕士研究生,研究方向为功能化石墨烯修饰电极的制备及其生物传感应用,zhanglehua99@ 126.com;

王怀生(1962-),男,博士,教授,博士研究生导师,山东省有突出贡献的中青年专家。研究方向为生物电分析化学,主持完成和在研四项国家自然科学基金课题,科研成果获2010年山东省自然科学二等奖,hswang@lcu.edu.cn。
普鲁士蓝/PDDA-石墨烯复合膜修饰电极的制备及应用于过氧化氢无酶传感器*
张乐华1,张华阳2,李冲1,贾丽萍1,王怀生1*
(1.聊城大学化学化工学院,山东聊城252059;2.山东大学材料科学与工程学院,济南250061)
制备了一种基于普鲁士蓝/PDDA-石墨烯复合膜的新型无酶电化学传感器,可以用于过氧化氢的灵敏检测。以聚二烯丙基二甲基氯化铵(PDDA)作为分散剂和功能化试剂制备了PDDA功能化的石墨烯(PDDA-G),然后将普鲁士蓝(PB)电沉积到PDDA-G修饰的玻碳电极表面,制备了PB/PDDA-G/GCE。实验发现,在工作电位为-0.3 V时,PB/PDDA-G/GCE作为传感器对H2O2的电化学还原有很好的催化能力,响应时间小于5 s,这主要是缘于PDDA-G和PB的协同作用。在3.0 μmol/L~2 061 μmol/L的范围内,H2O2的还原电流与其浓度呈现良好的线性关系,检出限为1.0 μmol/L(S/N=3)。该修饰电极有望用于实际样品中H2O2的快速检测。
过氧化氢;无酶传感器;聚二烯丙基二甲基氯化铵;石墨烯;普鲁士蓝
TP212.2
A
1004-1699(2014)04-0438-08
2014-03-10修改日期:2014-04-02
C:7230J
10.3969/j.issn.1004-1699.2014.04.004
项目来源:国家自然科学基金(21075059,21375055);山东省“泰山学者”建设工程专项经费项目
- 传感技术学报的其它文章
- Design a Composite Bio-Signal Monitoring System Based on SOPC*
- A Method of the CMUT Array Design and Imaging Simulation Based on MATLAB*
- Preparation of AChE/IL-GR/CHI/GCE Enzyme Electrode and Its Application for Chlorpyrifos Pesticide*
- An Improved Routing Algorithm Based on SPIN for WSN in Straight Narrow Tunnel
- Research on Acoustic Localization Technology for PIG*
- Research on a Passive Force Feedback Damper and Its Model*

