Detection of Living Gastric Cancer Cell Response to Allicin Stimulation Based on Surface Plasmon Resonance Interferometric Imaging Sensing*
DOU Fuyin,WANG Peng*,XING Rui,DENG Shijie,LV Youyong,YU Xinglong
(1.State Key Laboratory of Precision Measurement Technology and Instruments,Department of Precision Instruments,
Tsinghua University,Beijing 100084,China;
2 Laboratory of Molecular Oncology,Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Peking University School of Oncology,Beijing Cancer Hospital and Institute,Beijing 100142,China)
Detection of Living Gastric Cancer Cell Response to Allicin Stimulation Based on Surface Plasmon Resonance Interferometric Imaging Sensing*
DOU Fuyin1,WANG Peng1*,XING Rui2,DENG Shijie1,LV Youyong2,YU Xinglong1
(1.State Key Laboratory of Precision Measurement Technology and Instruments,Department of Precision Instruments,
Tsinghua University,Beijing 100084,China;
2 Laboratory of Molecular Oncology,Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Peking University School of Oncology,Beijing Cancer Hospital and Institute,Beijing 100142,China)
Aimed at the requirement of living-cell detection,the method of SPR interferometric imaging sensing cell response was proposed.A novel microfluidic chamber was designed,and the system used for molecular detection on living-cell level was set up.The cell cultured state in chamber was detected and analyzed,and then the response of gastric cancer cell line BGC823 simulated by allicin was monitored.The results show that gastric cancer cells adhere and grow well,and the microfluidic chamber could maintain cell survival microenvironment.The SPR signal of cells stimulated and not stimulated by allicin was respectively 0.15 RIRF and 0.35 RIRF,which indicated that allicin has obvious inhibitory effect on the cells.It suggests the possibility of the establishment of a detection drug-stimulating-cells platform and contribution to the drug development and clinical chemotherapy after the precision,reliability,relative technology are further enhanced.
SPR interferometric imaging,microfluidic chamber,living-cell detection,allicin,gastric cancer cell line BGC823
大蒜素是在大蒜中提取的主要生物活性的物质[1-2]。已有研究表明,大蒜素可通过诱导细胞凋亡,抑制胃癌细胞系的增殖[3-4]。大蒜素对不同细胞系,甚至是个体的有效作用浓度都存在很大差异,因而精确检测不同浓度大蒜素对细胞的作用极为必要。可是,现有的主要研究方法是基于MTT法,利用IC50计算化合物的作用浓度[5-6],误差较大,也无法直观地观测细胞对药物的反应。药物对癌细胞的作用复杂,同时还是一个动力学过程,迫切需要一种新颖的传感和检测方法。
表面等离子体共振SPR(Surface Plasmon Resonance)传感器属光学方法,既灵敏、实时和无需标记,又可同时获得特异性、亲和力以及动力学常数,已在生物分子相互作用检测中发挥了尚无可替代的作用[7-10]。药物对细胞的刺激,其本质是在细胞水平上发生分子相互作用后,继而引起细胞的形态及内部生化反应变化。Katsutoshi Yoshizato等人基于SPR角度法,进行了细胞检测的相关研究,实时分析配体诱导细胞表面和内部反应变化[11],检测了毒素(Toxin)B对RBL-2H3细胞的刺激作用[12]。角度法的不足是光束为线状,难以覆盖整个细胞,无法传感整个细胞的响应。SPR成像法却能实现群体、多个乃至单个细胞的传感,因而很有潜力[13]。需要指出,目前只能获取多个或群体细胞的传感信号,还难以达到单细胞。
SPR成像传感可分为光强法和相位法,后者的灵敏度高于前者[14]。光强法较简单,首先被用于检测细胞受刺激后的响应[15]。分子-细胞与分子-分子的相互作用比较,在同一传感面上,因为细胞表面的可结合位点不多,作用开始时所获得的传感信号弱。因此,SPR传感细胞首先面临的是提高灵敏度。还有,分子对细胞刺激响应的检测需要长时间,最好能达到一个细胞生长周期,长时间保持细胞的活性和持续实时传感也是所面临的。
针对上述细胞响应传感的要求,基于本课题组完成国家基金“科学仪器专项”的研究成果——SPR双分差动干涉成像检测生物分子相互作用,提出了SPR双分差动干涉(简称SPR干涉)成像传感细胞法,设计专用于细胞检测的微流体池,构建适于检测细胞响应的相位传感系统,进行大蒜素刺激胃癌细胞的检测。实验结果表明,不仅实现了灵敏检测大蒜素刺激胃癌细胞的响应,而且获得量化的SPR信号响应值。
1 实验平台
1.1 SPR干涉成像传感系统
SPR干涉成像传感细胞法的内涵是将从载有细胞的传感芯片反射的光分成2束且同时产生偏振干涉,成为2束光强互补的干涉光,同时成像在2片CCD上,采集图像解算得到传感面折射率变化。实现该方法的传感系统结构如图1所示[16-17],其基本工作原理:波长为635 nm激光由4 μm单模光纤输出,经准直器准直、偏振片调制和扩束镜扩束后射入Kretschmann棱镜,激发SPR。反射光经1/2波片、远心透镜、成像透镜和偏振分束棱镜后,将传感表面干涉成像在2片CCD上,可同时采集到相位差为π的2帧图像。干涉图像所对应的光强可用式(1)和式(2)分别表示

式中,E为入射光的振幅;θ为偏振方向与入射面夹角;φs、φp和rs、rp分别为S和P偏振分量的反射系数和相位变化。
为了便于分析,定义折射率相关因子RIRF(Refractive Index Related Factor),它与同时获得2帧相干图像的关系为

由上式可知,一是RIRF与光强无关,避免了光强波动的影响;二是测量时θ固定,RIRF只与φs、φp和rs、rp有关,而发生SPR时rs和φs基本不变。只要Au膜表面的传感层折射率RI(Refractive Index)变化,rp和φp随即变化,RIRF完全与折射率变化一一对应。显然,所得到的即时传感表面的RIRF分布,不仅能真实地反映传感表面的折射率变化,而且光强波动对其无影响,精度可更高。
当药物分子经过细胞表面时,若其与细胞表面的有关受体特异结合,则导致传感表面折射率变化,该系统就能传感。不仅如此,药物分子结合后持续地刺激细胞,不断引起细胞内部生化反以及形态的变化,也能实时传感,从而非常有利于分析药物的作用。

图1SPR双分差动干涉成像传感系统的示意图
1.2 微流体池
微流体池必须既保证细胞生长的微环境,又能满足SPR成像检测的要求,不同于通道式检测的结构,如图2所示。从图2可见,它包含4个培养腔,用PDMS(poly-dimethylsiloxane)浇注而成,每个腔的容积为200 μL,细胞在此培养。1只热敏电阻被浇注在细胞培养室中,作为温度传感元件。Kretschmann棱镜位于细胞培养室之下,其上表面依次镀有2 nm Cr和40 nm Au;棱镜的下表面贴有TEC(半导体加热/制冷片),作为加热/制冷器件。

图2 微流体池结构示意图
用1块硬铝底板、2块PMMA(有机玻璃)侧板和1块PMMA顶板,将所述的三部分固定为一体。PMMA进样板固定在PMMA顶板上,使得每个细胞培养腔都具有独立的进样和出样通道,各自形成一个密闭的培养环境,防止污染。PID闭环控制系统由热敏电阻、TEC和控制电路组成,保证细胞生存在类似于生物体的恒温下。PID控制算法采用分段控制和变速积分算法,如式(4)所示

其中,U(KT)是PID控制输出即输出电流值,N为常量,e为偏差值,T是采样间隔时间,KP、Ki和Kd为PID系数,α1和α2为变速积分系数。在此,选择N= 1.2 A、T=0.5 s、e0=2℃、e1=0.5℃、α1=1、α2=0.4。KP、Ki和Kd通过多次实验调整后确定。当KP、Ki和Kd分别设为2、0.02和130时,实测结果:流体池恒温在37℃,波动为±0.1℃,既适宜胃癌细胞的生长,又能满足SPR检测精度达到10-5RIU的要求。
2 实验
2.1 细胞和试剂
BGC823细胞取自北京市肿瘤防治研究所。非CO2型细胞培养液购自Gibco,胎牛血清购自HyClone,11-Mercaptoundecanoic acid(MUA)、N-Hydroxysuccinimide(NHS)、N-(3-Dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride(EDC)和Poly-l-lysine(PLL)购自Sigma-Aldrich。
2.2 Au膜功能化化学修饰
必须将Au膜表面功能化修饰后,细胞才能在其上贴附生长。首先,将1 mmol/L MUA的酒精溶液滴在金膜表面,浸泡24 h,形成自组装膜。接着,用酒精和去离子水洗净并吹干,又将100 mg/mL的NHS水溶液和50 mg/mL的EDC水溶液按1∶1混合后,滴在金膜表面,浸泡30 min,活化自组装膜。最后,用去离子水清洗并吹干,再将35 μg/mL PLL水溶液滴在活化的自组装膜上,浸泡4 h,包裹一层PLL,保证细胞的贴附生长。
2.3 细胞培养状态监测
微流体池的4个细胞培养腔分成2组,其中实验组有3个,对照组只有1个。
将微流体池安置SPR双分差动干涉成像传感系统中。待温度恒定后,实验组的2个培养腔中注入高浓度细胞悬浮液(4×105/mL),还有一个培养腔中注入低浓度细胞悬浮液(2×105/mL),对照组中只注入纯细胞培养液。培养5h,整个过程由成像传感系统实时监测。培养完成后,用显微镜观察细胞的生长状态。
2.4 大蒜素刺激胃癌细胞的检测
细胞培养与前述相同。首先,将细胞密度为4 ×105/mL的悬浮液接种到微流体池的4个培养腔中,培养3 h,使细胞在芯片表面贴壁。然后,其中2个培养腔内的培养液被置换成含有30 μg/mL大蒜素的细胞培养液,作为实验组,另外2个培养腔中的培养液被置换成纯细胞培养液,作为对照组。培养6 h,整个过程由成像系统实时检测。检测完成后,再用显微镜观察2组细胞的状态。
2.5 实验数据分析

图3 同时采集的相位差为π的2帧干涉图像
在细胞培养或大蒜素刺激过程中,成像传感系统同时采集相位差为π的2帧干涉图像,如图3所示。根据式(3),计算机实时处理,便得到即时传感芯片表面对应的RIRF分布图,如图4所示。整个过程持续进行,便可得到一系列RIRF分布图。由图4可见,共有4个区域的RIRF分布,每个区域反映所对应培养腔内的细胞状态。同时还可见,为了方便数据处理,在每一区域中选取4个小部分,图中所示为矩形框,该区域的SPR信号值为这4小部分RIRF的平均值。由所得到的RIRF分布图,就可实时计算出RIRF随着时间变化SPR的信号曲线,反映出细胞的培养状态或对大蒜素的刺激响应。

图4 某一时刻芯片表面RIRF分布
3 结果和讨论
3.1RIRF和折射率的对应关系
活细胞的折射率约为1.36左右,高于通常的生物分子溶液(1.333左右),因此系统的检测范围应更高。不同的甘油溶液对应着不同的折射率,由此可获得不同折射率的甘油溶液,用以标定RIRF与折射率的关系曲线。设光的入射角为62°,分别测试折射率为1.352~1.369的甘油溶液所对应的RIRF,结果如图5所示。由图可见,当折射率在1.352~1.369变化时,RIRF与折射率为线性关系,且120 RIRF/ 1 RIU。因此,该系统能满足活细胞检测要求。

图5RIRF和RI的对应关系
3.2 细胞培养状态
细胞培养状态的检测结果如图6所示,由图6可得出:
(1)对照组的信号曲线接近水平,表明该系统的基线漂移小,有利于高精度检测。
(2)2条高浓度细胞悬浮液的SPR信号曲线趋势一致,表明系统重复性较好,也为后续的阵列检测奠定了基础。可是,略有差异,可能是在接种细胞时2个腔内接种的细胞数量未能保证严格相等所致。
(3)实验组的每条SPR信号曲线都是先斜率大,而后越来越小。对应实验过程分析,当细胞悬浮液刚接种到微流体池中时,细胞受重力作用,细胞会快速沉淀到芯片表面,此时芯片表面质量快速增加,SPR信号变化最大。其后,细胞在芯片表面贴附伸展,表面质量变化变缓,对应SPR信号变化越来越小。在细胞接种2 h后,BGC823细胞已基本在芯片表面完全贴附,SPR信号随之变化很小。由此可见,SPR能够动态监测细胞的贴附生长过程。
(4)由前述分析还可得出,高低浓度细胞悬浮液的最终SPR信号响应值分别约为0.87 RIRF和0.40 RIRF,SPR信号的最终响应值正比于细胞接种浓度。

图6细胞培养状态检测SPR信号
图7 所示为2组细胞的显微照片。由图可见,浓度高组的细胞数量明显多于低浓度组,即高浓度组芯片表面质量变化更大,这与图6中所示的SPR信号曲线一致。从图中还可见,细胞贴壁生长状态良好,展现正常的生理机能,表明该微流体池能满足细胞生存的生理条件要求,保证检测的可靠进行。

图72 组细胞的显微照片
3.3 大蒜素刺激细胞响应
大蒜素对胃癌细胞系BGC823刺激响应的检测结果如图8所示。曲线1和曲线2分别是2个实验组培养腔内细胞被大蒜素刺激后的RIRF曲线,曲线3和曲线4分别是2个对照组培养腔内细胞的RIRF曲线。从图8可看出,曲线1和2明显低于曲线3和4,表明大蒜素可抑制BGC823细胞的增殖。可是,曲线1和2没有重叠,导致的原因可能如同4.2所述。从图8还可得出,实验组和对照组的最终响应值分别为0.15 RIRF和0.35 RIRF。
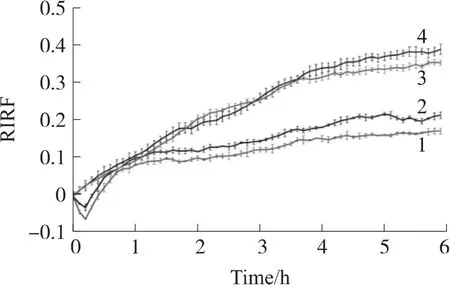
图8 大蒜素对胃癌BGC-823细胞刺激响应信号
图9所示为2组细胞的显微图片。从图中可见,刺激组的细胞形态不同于对照组,折光性变强,出现了明显的凋亡细胞的形态。实验组的细胞受到大蒜素刺激后,其增殖能力低于对照组细胞,且形态发生变化,引起RIRF信号变小。

图92 组胃癌BGC-823细胞的显微照片
4 结论
综合上述实验结果与分析,可得出如下结论:
(1)所构建的SPR干涉成像传感细胞响应系统能真实地反映传感表面的折射率变化,且光强波动对其无影响,有利于进行高精度细胞检测。
(2)所设计的微流体池的恒温在(37±0.1)℃,胃癌细胞在其中贴附生长良好,且能满足SPR检测精度对温度的要求,适用于药物刺激细胞检测。
(3)在大蒜素刺激的6 h内,实验组和对照组的最终响应值分别为0.15 RIRF和0.35 RIRF,差异具有统计学意义,表明大蒜素对胃癌细胞系BGC823的增殖具有抑制作用。
在活细胞水平上检测药物刺激响应具有挑战性。研究还是初步的,我们将不断完善检测系统,持续提高精度和可靠性,丰富有关工艺技术,拓宽检测领域,力争建立完整的药物刺激细胞响应检测技术平台,为药物发现和临床化疗方案优化做出贡献。
[1]Miron T,Rabinkov A,Mirelman D,et al.The Mmode of Action of Allicin:Its Ready Permeability through Phospholipid Membranes May Contribute to Its Biological Activity[J].Biochemical et Biophysica Acta,2000,1463:20-30.
[2]Hiroyuki F,Kaoru S,Kama O,et al.Biological and Cchemical Stability of Garlic-Derived Allicin[J].J Agric Food Chem,2008,56: 4229-4235.
[3]Suby O,Ruby J A,Gopal S,et al.Allicin(from Garlic)Induces Caspase-Mediated Apoptosis in Cancer Cells[J].European Journal of Pharmacology,2004,485:97-103.
[4]Xiao D H,Tpinto J,Soh J W,et al.Induction of Apoptosis by the Garlic-Derived Compound S-Allymercaptocysteine(SAMC)is Associated with Microtubule Depolymerization and c-Jun NH2-Terminal Kinas 1 Activation[J].Cancer Research,2003,63:6825-6837.
[5]Suarez M F,Ting A Y.Fluorescent Pprobes for Super-Resolution Imaging in Living Cells[J].Molecular Cell Biology,2008(9):929-943.
[6]Velasco-Garcia M N.Optical-Biosensor for Probing at the Cellular Level:A Review of Recent Progress and Future Prospects[J].Seminars in Cell and Development Biology,2009,20:27-33.
[7]Karlsson R.SPR for Mmolecular Interaction Analysis:A Review of Emerging Application Areas[J].Journal of Molecular Recognition,2004,17:151-161.
[8]Robelek R.Surface Pplasmon Resonance Sensors in Cell Biology: Basic and Application[J].Bioanal Rev,2009(1):57-72.
[9]刘儒平,王程,徐万帮,等.基于生物素-亲和素放大的SPR传感器检测大肠杆菌研究[J].传感技术学报,2013,26(6):757-761.
[10]谢永红,王耀玲,程小丽,等.SPR生物传感器在急性白血病髓系抗原CD33检测中的应用[J].传感技术学报,2011,24(1): 1-4.
[11]Michihiro H,Tomoko T,Hajime S,et al.Real-Time Analysis of Ligand-Induced Cell Surface and Intracellular Reaction of Living Mast Cells Using a Surface Plasmon Resonance-Based Biosensor[J].Analytical Biochemistry,2002,302:28-37.
[12]Yuhki Y,Hidenori S,Tomoko T,et al.The SPR Signal in Living Cells Reflects Changes other than the Area of Adhesion and the Formation of Cell Constructions[J].Biosensors and Bioelectronics,2007,22:081-1086.
[13]Chen K X,Obinata H,Takashi I.Detection of G Protein-Coupled Receptor-Mediated Cellular Response Involved in Cytoskeletal Rearrangement Using Surface Plasmon Resonance[J].Biosensors and Bioelectronics,2010,25:1675-1680.
[14]王大千.SPR双分差动干涉成像阵列检测生物分子相互作用技术[D].北京:清华大学精密仪器系,2012.
[15]Alexander W P,Halter M,Alessandro T,et al.Using Surface Plasmon Resonance Imaging to Probe Dynamic Interactions between Cells and Extracellular Matrix[J].Cytometry Part A,2010,77A: 895-903.
[16]余兴龙,王大千,张玮,等.SPR双分差动干涉成像生物分子相
互作用分析仪[J].清华大学学报,2013,53(2):160-166.
[17]张玮,邓焱,王大千,等.制冷双CCD采集系统在SPR=成像中的应用[J].仪器仪表学报,2011,32(8):1751-1756.

窦福印(1985-),男,汉族,清华大学精密仪器系博士研究生,主要研究方向为SPR生化传感器,fuyindou@163.com;

王鹏(1977-),男,汉族,清华大学精密仪器系副教授,博士,主要研究方向为传感器材料、传感器和智能仪器,peng@mail.tsinghua.edu.cn;
余兴龙(1948-),男,汉族,清华大学精密仪器系教授,博士生导师,1970年毕业于清华大学精仪系,研究重点为分子相互作用检测、细胞检测,jyxyxl@ mail.tsinghua.edu.cn。
基于SPR干涉成像传感法检测大蒜素刺激胃癌细胞的响应*
窦福印1,王鹏1*,邢蕊2,邓士杰1,吕有勇2,余兴龙1
(1.清华大学精密仪器系精密测试技术及仪器国家重点实验室,北京100084; 2.北京大学肿瘤医院/北京市肿瘤防治研究所恶性肿瘤发病机理及转化研究教育部重点实验室分子肿瘤学实验室,北京100142)
针对细胞响应传感的要求,提出了SPR干涉成像传感细胞响应的方法,设计制作新颖的微流体池,构建用于活细胞水平分子传感和检测的系统。在此基础上,先检测和分析细胞在微流体池中的培养状态,再检测大蒜素对人胃癌细胞系BGC823刺激响应。实验结果表明,胃癌细胞贴附生长良好,微流体池可提供细胞生存的微环境;6 h后大蒜素刺激和对照的SPR信号响应值分别为0.15 RIRF和0.35 RIRF,大蒜素对胃癌细胞系BGC823细胞具有明显抑制作用。在持续提高精度、可靠性以及丰富有关工艺技术后,有可能建立完整的药物刺激细胞响应检测技术平台,为药物发现和临床化疗方案优化做出贡献。
SPR干涉成像;微流体池;活细胞检测;大蒜素;胃癌细胞系BGC823
R197.39
A
1004-1699(2014)04-0432-06
2013-11-18修改日期:2014-03-24
C:7230J
10.3969/j.issn.1004-1699.2014.04.003
项目来源:国家自然科学基金项目(30970757,30727001)
- 传感技术学报的其它文章
- Design a Composite Bio-Signal Monitoring System Based on SOPC*
- A Method of the CMUT Array Design and Imaging Simulation Based on MATLAB*
- Preparation of AChE/IL-GR/CHI/GCE Enzyme Electrode and Its Application for Chlorpyrifos Pesticide*
- Preparation and Application of Sensitive Enzymeless Sensor for Hydrogen Peroxide Based on Prussian Blue/PDDA-Graphene Modified Electrode*
- An Improved Routing Algorithm Based on SPIN for WSN in Straight Narrow Tunnel
- Research on Acoustic Localization Technology for PIG*

