川芎嗪降低咖啡因诱导的PC12细胞凋亡的研究
, ,
(江苏省中医院 检验科,南京 210029)
川芎嗪降低咖啡因诱导的PC12细胞凋亡的研究
王佳,高峰,张春兵*
(江苏省中医院 检验科,南京 210029)
目的 分析川芎嗪预处理大鼠肾上腺嗜铬细胞瘤克隆化细胞株PC12细胞后咖啡因诱导的细胞凋亡情况,探讨川芎嗪治疗脑缺血再灌注损伤的机制。方法 采用川芎嗪预处理PC12细胞后,制备咖啡因细胞损伤模型,通过CCK-8法活细胞检测、Hoechst-33342染色、流式细胞术、RT-PCR分析细胞凋亡发生机制。结果 川芎嗪预处理后,PC12细胞的存活数提高,细胞未见大量凋亡小体形成、总体凋亡率降低,caspase3、caspase-8、caspase9活性降低,线粒体膜电位提高,Bax/Bcl-2比值降低。结论 川芎嗪预处理后能降低咖啡因诱导的PC12细胞凋亡。
川芎嗪;PC12细胞;脑缺血性损伤;凋亡
脑缺血/再灌注损伤是多种机制参与的一种复杂的病理生理过程,多种环节因素之间又互相作用。抑制脑缺血再灌注是目前有效治疗脑卒中的关键。川芎嗪(tetramethylpyrazine,TMPz)能减轻脑缺血再灌注性脑损伤程度,具有显著的缺血后脑保护作用[1],前期研究以及其他实验报道,川芎嗪可以穿透血脑屏障,降低缺血再灌注损伤区神经元的凋亡。PC12细胞表达神经生长因子(NGF)受体,NGF可诱导产生神经表型,广泛用于神经系统疾病的体外研究。钙超载是导致神经细胞死亡的“最后共同通路”[2]。细胞内游离钙的增加通常是细胞外钙的内流或细胞内钙库释放所致。咖啡因是兴奋中枢神经系统最常用的一种黄嘌呤制剂,作为细胞肌浆网理阿诺碱受体(ryanodine receptor)的激动剂,能引发对ryanodine敏感的钙库释放[3]。因此,咖啡因常被用于制备神经元钙离子超载模型[4]。本研究目的在于通过制备咖啡因PC12细胞损伤模型,探讨川芎嗪脑缺血再灌注损伤保护作用与细胞凋亡的关系。
1 材料
1.1 药品与试剂 川芎嗪:中国药品生物制品检定所(中国);胎牛血清、马血清、DMEM培养基:Gibco(新西兰);咖啡因:Sigma(美国);明胶:Sigma(美国);CCK-8试剂盒:Dojindo(日本);Active Caspase-3 Staining Kit,Active Caspase-8 Staining Kit和Active Caspase-9 Staining Kit:Biovision(美国);罗丹明:Invitrogen(美国);RT-PCR试剂:宝生物(日本)。
1.2 PC12细胞 大鼠肾上腺嗜铬细胞瘤细胞克隆株PC12细胞,购自中国科学院细胞库(上海)。
1.3 仪器 流式细胞仪:Becton Dickinson(美国);ABI7500实时荧光定量PCR仪:Applied Biosystems(美国);UV2401紫外分光光度计:岛津(日本)。
2 方法
2.1 细胞培养及药物作用
2.1.1 细胞培养及传代 PC12细胞疏松贴壁生长,完全培养液含10% 胎牛血清和10%马血清的高糖DMEM培养液,培养于含5%CO2的37 ℃细胞培养箱,70%单层后传代,以1∶4的比率传至新细胞培养瓶中,2 d后半量换液。
2.1.2 咖啡因模型[1]建立 0.25%胰酶消化,制备成单细胞悬液,计数,接种到96孔培养板,105cells/每孔,100 μL完全培养液,隔天换液,生长至单层。加入5 mM咖啡因,孵育12 h后,轻轻去除培养基;换上不含咖啡因的新鲜培养基培养。
2.1.3 川芎嗪保护实验 预先用川芎嗪(0、0.1、1、10 mM)处理PC12细胞,孵育60 min后,轻轻去除培养基;洗涤,换液,生长至单层。
2.2 观察指标
2.2.1 CCK-8法检测细胞毒性 操作步骤严格按照试剂说明书进行。
2.2.2 Hoechst-33342染色观察 2×105细胞接种24孔细胞培养板,培养板中预先置放用明胶包被的玻片。0 mM和1 mM川芎嗪预处理后,制备细胞损伤模型,培养48 h,取出含有细胞单层的玻片,4 ℃用4%多聚甲醛固定10 min,加入5 μg/mL Hoechst-33342染液于玻片上,室温避光孵育10 min,再用双蒸水洗3遍,荧光显微镜观察拍照,激发波长为350 nm。
2.2.3 流式细胞术分析Caspase-3、8、9 制备300 μL细胞悬液(105细胞/100 μL),操作步骤严格按照试剂说明书进行。
2.2.4 流式细胞术观察细胞线粒体膜电位 0.25%胰酶消化PC12细胞形成单细胞悬液,接种96孔细胞培养板中,每孔105细胞/100 μL,加入罗丹明123染液5 μg/mL;37 ℃,5% CO2孵育15 min;完全培养基洗细胞2次;重悬细胞于培养基中,37 ℃,5% CO2孵育60 min;流式细胞仪检测:激发波长488 nm,发射波长530 nm。
2.2.5 实时荧光定量PCR
2.2.5.1 总RNA提取 培养瓶单层细胞经0.25%胰酶消化,无菌生理盐水洗涤3次,3 000 r/min,离心5 min收集细胞,采用TRIzol提取总RNA,操作步骤严格按照试剂说明书进行。
2.2.5.2 反转录 反应体系5×PrimescriptTMBuffer、2 μL,PrimescriptTMRT Enzyme MixⅠ、0.5 μL,Oligo dT Primer(50 uM)、0.5 μL,Random 6 mers(100 uM)、0.5 μL,Total RNA、2 μg,RNase Free H2O、6.5 μL。反应条件:37 ℃,15 min;85 ℃,5 s。
2.2.5.3 PCR 探针及引物,Bcl-2 forward:5’-TGCGCTCAGCCCTGTG-3’,Bcl-2 reverse:5’-GGTAGCGACGAGAGAAGTCATC-3’,Bcl-2 probe:5’-CCACCTGTGGTCCACCTG-3’;Bax forward:5’-CAAGAAGCTGAGCGAGTGTCT-3’,Bax reverse:5’-CAATCATCCTCTGCAGCTCCATATT-3’,Bax probe:5’-CCAGTTCATCTCCAATTCG-3’;GAPDH forward:5’-GTGCCAA AAGGGTCATCATCTC-3’,GAPDH reverse:5’-GGTTCACACCCATCACAAACATG-3’,GAPDH probe:5’-TTCCGCTGATGCCCC-3’。探针5’标记FAM,3’标记ECLIPSE。
反应体系(3个体系相同):cDNA、2 μL,2×Premix EX Taq、12.5 μL,引物(10 uM)、各0.5 μL,探针、1 μL,dH2O、8.5 μL。反应条件(3个条件相同):95 ℃预变性45 s;95 ℃变性5 s,52 ℃退火、延伸35 s,扩增40个循环;在52 ℃退火、延伸步骤中采集荧光信号。
3 结果
3.1 川芎嗪降低咖啡因神经细胞毒性 咖啡因具有细胞毒性。应用不同浓度的川芎嗪处理咖啡因(5 mM)PC12细胞模型,川芎嗪呈剂量依赖性的提高细胞存活率,降低咖啡因神经细胞毒性,P<0.05。见图1。
3.2 川芎嗪抑制过氧化氢诱导的细胞凋亡
3.2.1 咖啡因(5 mM)模型中,PC12细胞的细胞核固缩,凋亡小体形成 1 mM川芎嗪预处理组,细胞核荧光强度均匀一致,未见大量凋亡小体。见图2。
3.2.2 咖啡因致PC12损伤模型中,可以检测到caspase-3、caspase-8和caspase9的活化;川芎嗪预处理组,caspase-3、caspase-8和caspase9的活化减弱,且呈剂量依赖性。见表1。

表1 川芎嗪调控咖啡因模型组Caspase活性
注:Group 0:0 mM 川芎嗪+0 mM咖啡因;Group 1:0 mM 川芎嗪+5 mM咖啡因;Group 2:0.1 mM川芎嗪+5 mM咖啡因;Group 3:1 mM 川芎嗪+5 mM咖啡因;Group 4:10 mM川芎嗪+5 mM咖啡因。与Group 0比较,#P<0.05;与Group 1比较,△P<0.05。
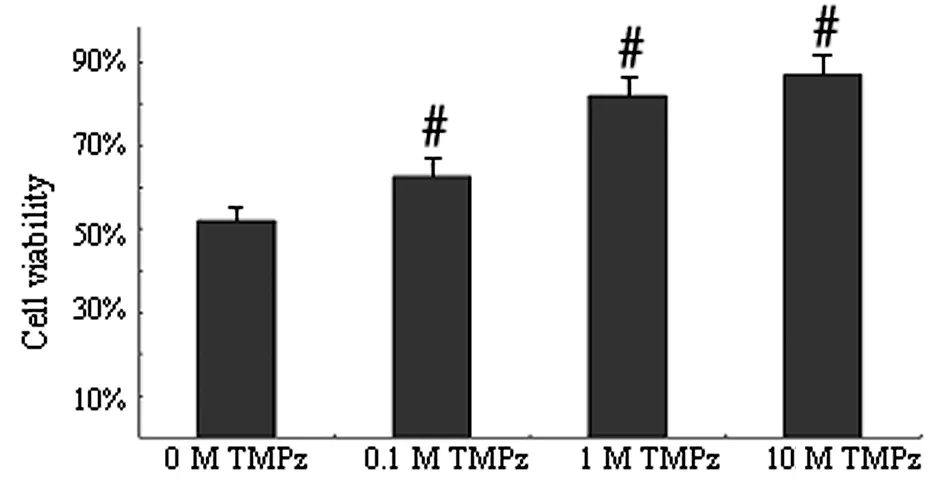
注:0M TMPz组比较,#P<0.05。
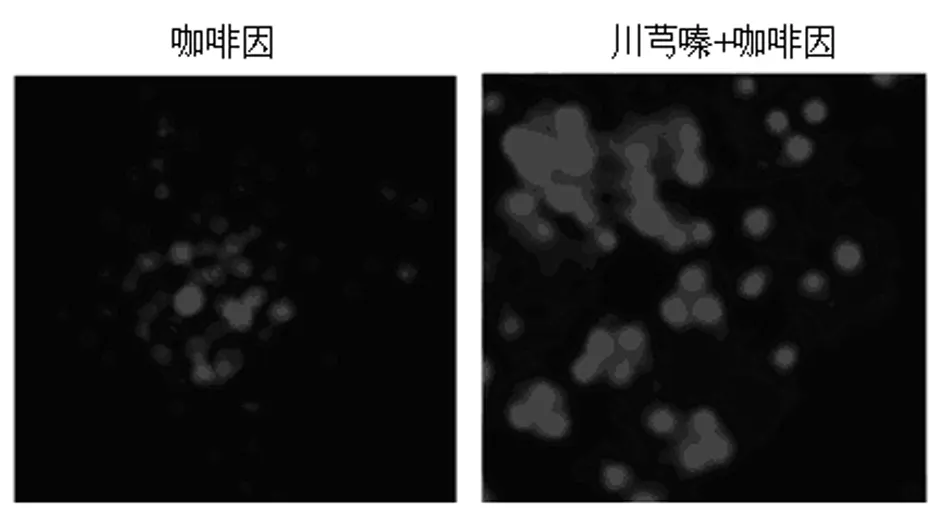
图2 咖啡因诱导细胞凋亡及川芎嗪保护效应—Hoechst 33342染色(×40倍)
3.2.3 川芎嗪对咖啡因降低线粒体膜电位具有拮抗作用 咖啡因模型组,可见荧光显著增强,表明线粒体膜电位下降;而经过川芎嗪预处理后,荧光强度减弱,且亦可观察到剂量依赖性,表明川芎嗪可以剂量依赖性的提高线粒体膜电位,抑制PC12细胞凋亡。见图3。
3.2.4 川芎嗪调控Bax/Bcl-2通路抑制细胞凋亡 咖啡因模型组,Bax/Bcl-2显著升高,P<0.05;川芎嗪预处理后,Bax/Bcl-2呈现剂量依赖性降低,P<0.05。见图4。

注:Red line(Group 0),Green line(Group 1),Blue line(Group 2),Black line(Group 3),Purple line(Group 4),分组同表1。
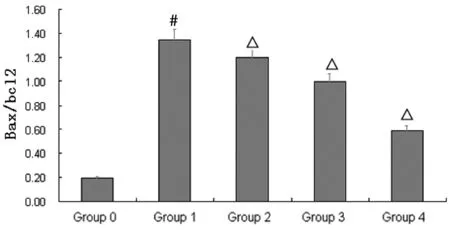
注:分组同表1。与Group 0比较,#P<0.05;与Group 1比较,△P<0.05。
4 讨论
脑缺血/再灌注损伤后通常出现神经细胞死亡和迟发性神经细胞死亡两种形式,后者是一种细胞主动性死亡,称之为凋亡,是脑缺血/再灌注损伤的最重要形式[5]。凋亡主要通过两条途径来实现的,一条是外源性途径,又称为死亡受体途径,因其是通过特定的死亡配体(如FasL,TNF)与细胞表面的死亡受体(如Fas,TNFR)相互作用而介导的,从而激活胞内的凋亡酶:起始酶caspase-8→caspase-3;或切割Bcl家族成员Bid蛋白→细胞色素c释放→caspase 9→放大caspase-3活化[6]。另一条是内源性途径,也称为线粒体途径,因其通过线粒体相关的Bcl-2家族调控细胞色素c的释放。胞浆中与Apaf-1,dATP,caspase-9前体反应形成凋亡复合物。Caspase-9前体经活化后激活caspase-3[7]。此途径为脊椎动物最普遍的细胞死亡途径。结果显示咖啡因通过外源性和内源性途径诱导PC12细胞凋亡,川芎嗪则抑制Caspase-3、8、9活化从外源性和内源性途径降低咖啡因诱导的PC12细胞凋亡。
线粒体跨膜电位的降低是细胞凋亡早期的不可逆事件,在各种促细胞凋亡信号作用下,线粒体通透性转运孔不可逆过度开放,导致线粒体跨膜电位崩解,呼吸链解耦联,线粒体基质渗透压升高,内膜肿胀,释放出膜间促凋亡蛋白,最终引起细胞凋亡。在多数条件下,线粒体内钙离子的过度聚积可使膜通透性转运孔开放,引起线粒体功能障碍启动神经元的死亡和凋亡[5]。而咖啡因作为细胞肌浆网理阿诺碱受体的激动剂,能引发钙库释放[3],笔者观察到咖啡因模型组,线粒体膜电位下降,而川芎嗪可抑制钙的超载,提高线粒体膜电位,抑制细胞凋亡。
Bax属于Bcl-2(B cell lymphoma/leukemia-2)基因家族,Bcl-2通过阻断细胞凋亡而促进细胞存活,维持细胞生存。而Bax与Bcl-2功能相反,诱导细胞凋亡。Bcl-2和Bax的表达强度决定细胞命运,Bax占优势时促进细胞死亡,Bcl-2占优势时阻止细胞死亡[8]。
研究发现川芎嗪预处理可以抑制PC12细胞凋亡,这种作用可能是通过调控caspase-3,8,9活性、线粒体膜电位及Bax/Bcl-2平衡实现的。
[1]Tang Q,Han R,Xiao H,et al.Neuroprotective effects of tanshinone IIA and/or tetramethylpyrazine in cerebral ischemic injury in vivo and in vitro[J].Brain Res,2012,1488:81-91.
[2]Young KW,Pinon LG,Bampton ET,et al.Different pathways lead to mitochondrial fragmentation during apoptotic and excitotoxic cell death in primary neurons[J].J Biochem Mol Toxicol,2010,24(5):335-341.
[3]Domeier TL,Blatter LA,Zima AV.Changes in intra-luminal calcium during spontaneous calcium waves following sensitization of ryanodine receptor channels[J].Channels (Austin),2010,4(2):87-92.
[4]Santo Domingo J,Fonteriz RI,Lobaton CD,et al.Ca2+dynamics in the secretory vesicles of neurosecretory PC12 and INS1 cells[J].Cell Mol Neurobiol,2010,30(8):1267-1274.
[5]石静,卿晨.线粒体膜电位改变与细胞凋亡[J].中国民族民间医药杂志,2011,20(7):20-21.
[6]Kuramoto N,Seko K,Sugiyama C,et al.Trimethyltin initially activates the caspase 8/caspase 3 pathway for damaging the primary cultured cortical neurons derived from embryonic mice[J].J Neurosci Res,2011,89(4):552-561.
[7]Rodriguez-Berriguete G,Galvis L,Fraile B,et al.Immunoreactivity to caspase-3,caspase-7,caspase-8,and caspase-9 forms is frequently lost in human prostate tumors[J].Hum Pathol,2012,43(2):229-237.
[8]王彤,刘存志,刘玉珍,等.Bcl-2/bax基因调控机体细胞凋亡的机制研究进展[J].中国老年学杂志,2008,28(16):1658-1660.
StudyontetramethylpyrazineprotectingPC12cellfromapoptosisinducedbycaffeine
WANG Jia,GAO Feng,ZHANG Chunbing*
(Jiangsu Provincial Hospital of Traditional Chinese Medicine,Nanjing 210029,China)
ObjectiveTo analyze whether tetramethylpyrazine could protect PC12 cell from apoptosis induced by caffeine in order to explore the mechanism of tetramethyipyrazine in the treatment of cerebral ischemia reperfusion injury.MethodsAfter the PC12 cells were cultured by tetramethylpyrazine,caffeine was added to induce the apoptosis of PC12 cells.Various methods,including CCK-8 live cell test,Hoechst-33342 staining,flow cytometry and quantitative reverse transcription/polymerase chain reaction(RTPCR),were used to analyze the mechanisms involved in the process.ResultAfter the pretreatment,tetramethylpyrazine reduced the apoptosis of PC12 cells.The number of PC12 cells increased compared with decreased apoptosis rate.Tetramethylpyrazine could improve the activity of caspase 3,8,9 and the electric potential of mitochondrial membrane and the rate of Bax/Bcl 2 dropped in response to tetra methylpyrazine.ConclusionsThe pretreatment with tetramethylpyrazine could reduce the apoptosis of PC12 cells damaged by caffeine.
tetramethylpyrazine;PC12 cells;ischemic injury of brain;apoptosis
10.13463/j.cnki.cczyy.2014.01.006
江苏省自然科学基金资助项目(BE2010768);国家自然科学基金资助项目(81171659)。
王 佳(1980-),女,硕士,主管技师。研究方向:医学免疫学研究。
] 张春兵,男,博士,主任技师,电子信箱:gaof-1218@163.com。
R285.5
:A
2095-6258(2014)01-0014-04
2013-09-24)
*[

