术前应用MRI评估直肠癌T分期的价值
崔书发 王锡山
近年来MRI的技术不断发展成熟,其应用的优势非常之大,直肠在盆腔中位置局限,游离程度有限、固定,因此,应用MRI检查时产生的伪影小,MRI设备具有腔内线圈、相控阵线圈、体外线圈的不同形式,因此可多方位检查直肠癌的存在,并且借助其较高的软组织分辨率,其已经成为直肠癌检查中的常选内容。MRI可以进行矢状位、冠状位的不同方位检查,并且可以重建图像,因此MRI在直肠癌的术前诊断中可以准确分期,可以清楚显示各个层次的肠壁及肿瘤浸润程度、肿瘤浸润直肠系膜的程度。MRI判定直肠癌分期的准确率高。在MRI检查直肠癌N分期的过程中,其诊断的准确率不如T分期高。目前大宗研究表明MRI对直肠癌术前T分期检查意义明显。
然而,我们不断思考,在临床实践中面对不同的患者,不同的因素是否会影响到MRI对直肠癌T分期的准确率判定,研究不同的影响MRI判定直肠癌T分期的因素及其意义,是临床实践中个体化治疗的一部分,也是直肠癌综合治疗的重要组成部分。
材料与方法
一、一般资料
选择哈尔滨医科大学附属第二临床医院结直肠肿瘤外科2011年8月至2014年4月收治入院的60例病例资料,所选取的病例术前均行盆腔MRI检查且术后病理证实为直肠癌,实施手术方式为直肠癌扩大根治术(AR)或直肠癌腹会阴联合切除术(APR),不伴有多发癌、同时性癌及异时性癌。病例资料完善,其中男性28例,女32例。年龄42~84岁,中位年龄为63岁。术前MRI检查T1-2、T3、T4期病例个数分别为14、6、40。术后病理显示的T1-2、T3、T4期病例个数分别为16、0、44个。
PHILIPS 3.0T双源MRI设备。采用SENSE-XL-Torso线圈,Feet First,采用横断冠状及矢状位T2W1快速自旋回波(T-SE)序列,T1W1自旋回波(T-SE)序列。先后行以下全方位检查:T2矢状位TSE,T2TSE轴位,T1TSE轴位,T2TSE冠状位。其中T2矢状位TSE取TR 3356ms,TE110ms,层厚5 mm,间隔1 mm,层数24,FOV 250×250×143 mm,NSA 2次左右采集。T2TSE轴位取TR3231 ms,TE110 ms,层厚5 mm,间隔1 mm,层数24,FOV 250×250×132 mm,NSA 2次采集。选取普通塑料泡沫大小约30×10×10 cm一块。铅笔刀一把。
二、方法
1.入组病例标准:(1)原发于直肠的单发肿瘤,术后病理诊断为直肠癌且不伴有其它恶性疾病;(2)所选病例术前行直肠MRI检查,进行直肠癌T分期的判定;(3)入组的患者除原发直肠病灶外无肝脏及其它远处转移;(4)选取临床资料完整;(5)临床选取的患者行MRI检查前未进行放化疗等其它治疗;(6)所取病例均行限期直肠癌扩大根治术手术。
2.纳入观察指标:MRI术前评价直肠癌T分期、术后病理评价的直肠癌T分期、直肠系膜浸润程度(D1/D0)、体重指数BMI(BMI=体重/身高2,身高以米为单位,体重以千克为单位)、年龄、肿瘤最大直径、性别、肿瘤分化程度、肿瘤距离肛缘的距离、术前CEA、CA199、病理回报的神经侵犯、血管瘤栓、淋巴管瘤栓、淋巴结转移数目、术前贫血、手术方式、术后离体直肠影像学检查片。
3.T分期标准:T1期肿瘤侵犯层次为黏膜下层;T2期肿瘤侵犯层次到达固有肌层;T3期肿瘤表示已经穿透固有肌层达浆膜下或无腹膜覆盖的直肠旁组织层;T4期肿瘤表示穿透腹膜脏层或者累及其他邻近脏器。
4.直肠系膜浸润程度(D1/D0)定义:以肿瘤浸润直肠系膜最深处的平面、位置为测量平面,在MRI图像矢状位T2WI-TSE上直肠肠壁肌层外缘与病灶侵犯的外缘距离(D1)和所在平面中直肠系膜的厚度(D0)的比值规定为直肠系膜受浸润的程度(DI/D0),将D1/D0分为3度,I度为小于等于1/3,大于1/3小于等于2/3为II度,III度定义为大于2/3。
三、实验方法及数据记录
调取MRI工作站电脑数据并且观察报告及图像查询,根据T分期诊断标准,判定MRI显像时的直肠癌的T分期。调取电脑病例资料查询,根据T分期标准,对与MRI显像T分期对应的病例进行术后病理回报的T分期统计。将病理诊断的T分期与MRI诊断的T分期进行对比记录并分析。在MRI术前判定T分期过程确保一位主任医师及一位住院医师共同对MRI的术前直肠癌T分期进行对比判定、讨论得出一致的T分期结果。
1.统计纳入的影响因素:在检查的术前MRI图像矢状位T2WI-TSE上癌肿所在部位处,利用画图工具选择癌肿侵犯层次显示最重的层面,测量D1/D0的比值并记录。根据病例资料记录并计算患者的BMI数值,其中体重或身高资料不完善的资料可以电话联系随访进行记录计算。根据患者的病例资料统计患者的年龄、肿瘤最大直径、性别、肿瘤分化程度、肿瘤距离肛缘的距离、术前CEA、CA199、病理神经侵犯、血管瘤栓、淋巴管瘤栓、淋巴结转移数目、术前贫血、手术方式。
2.离体直肠标本MRI扫描:利用铅笔刀将塑料泡沫打磨成三块小的塑料泡沫块,大小分别为:4.0×3.0×0.5 cm、5.0×3.0×3.0 cm、5.0×3.0×3.0 cm。取一例行AR术的病例的离体直肠,在直肠离体0.5小时内将其送至哈尔滨医科大学附属第二医院MRI检查室进行MRI扫描。然后送归病理室。其中在切除直肠后立即将切除的离体直肠(肿瘤侵犯的直肠)用蒸馏水清冲洗干净,用铅笔刀剔除直肠远近端的吻合器钉及手术中的结扎线,观察肿瘤所在部位,避免破坏肠壁及肿瘤,将一块大小为4.0×3.0×0.5 cm的塑料泡沫块从直肠一端轻轻塞入直肠至肿瘤所在肠壁对侧部位,将所制作的2块大小为5×3×3 cm的塑料泡沫块从直肠两端轻轻塞入直肠至与第一块塑料泡沫对接,支撑肠腔。将离体直肠行MRI冠状位和矢状位检查。
四、统计学方法
在将MRI进行的术前T分期与术后病理T分期进行比较分析后,将所统计的病例分为两组:MRI术前T分期与术后病理T分期一致组和不一致组。分别将以上影响因素归类记录于表中。统计研究不同影响因素对MRI判定直肠癌T分期的准确率的影响意义。然后将BMI和D1/D0进行比较,统计并分析它们之间是否相互存在关系。运用sas 9.2统计软件进行数据统计学分析。用2检验进行单因素分析,如果期望频数小于5,则用Fisher确切概率法,单因素分析有意义的变量进行多因素logistic回归分析,利用Kappa系数进行一致性检验。
结 果
一、术前MRI诊断直肠癌T分期的准确率
MRI影像检查显示的T1-2期14例患者中,与病理T分期一致的例数为12例,另有2例病理诊断为T4期;MRI影像检查显示的T3期6例患者中,与病理T分期一致的例数为0例,有4例病理诊断为T1-2期,另有2例病理诊断为T4期;MRI影像检查显示的T4期40例患者中,与病理T分期一致的例数为40例,即病理T分期与直肠癌术前MRI检查T分期完全一致。术前MRI诊断直肠癌T分期中,总例数为60例,诊断与病理T分期一致的例数为50例,总体准确率为86.67%。进行Kappa检验显示一致性系数为k=0.703,P<0.0001,显示MRI术前诊断直肠癌T分期与术后病理T分期具有很强的一致性(表1)。
二、影响MRI术前评价直肠癌T分期的准确性的相关因素分析结果
对纳入的影响MRI术前评价直肠癌T分期的准确性的相关因素,用2检验进行单因素分析以及Fisher确切概率法进行统计显示:BMI和肿瘤最大直径有统计学意义(P<0.0001),直肠系膜浸润程度(D1/D0)、年龄、肿瘤分化程度、肿瘤距离肛缘的距离、术前CEA、CA199、性别、病理回报的神经侵犯、血管瘤栓、淋巴管瘤栓、淋巴结转移数目、术前贫血、手术方式无统计学意义(P>0.05):D1/D0的分度中,I度病例总共8例,有6例的术前MRI检查T分期跟病理T分期一致,2例不一致;II度病例总共26例,有20例的术前MRI检查T分期跟病理T分期一致,6例不一致;III度病例总共26例,有24例的术前MRI检查T分期跟病理T分期一致,2例不一致(表2)。
三、对BMI和肿瘤最大直径的统计分析结果
我们对纳入的影响因素进行单因素分析后,对影响术前MRI检查判定直肠癌T分期有统计学意义的指标,即BMI和肿瘤最大直径,进行多元logistic逐步回归分析。BMI的P值为0.0012,有统计学意义;其中BMI值在<25时,MRI术前诊断直肠癌T分期的准确率为95.8333%,BMI值在25-30时,MRI术前诊断直肠癌T分期的准确率为40.0000%,BMI值在≥30时,MRI术前诊断直肠癌T分期的准确率为0;肿瘤最大直径的P值为0.0981,无统计学意义(表3)。
四、对BMI和D1/D0的统计分析结果
统计BMI和D1/D0的相关系数及P值,P值为0.5509,得出这两个影响因素之间无统计学意义(表4)。
五、离体直肠MRI结果
我们对离体直肠1例标本进行MRI扫描,不论从矢状面还是冠状面可以见到离体直肠MRI与术前MRI判定肿瘤侵犯层次时,即在判定T分期方面具有很高的一致性。
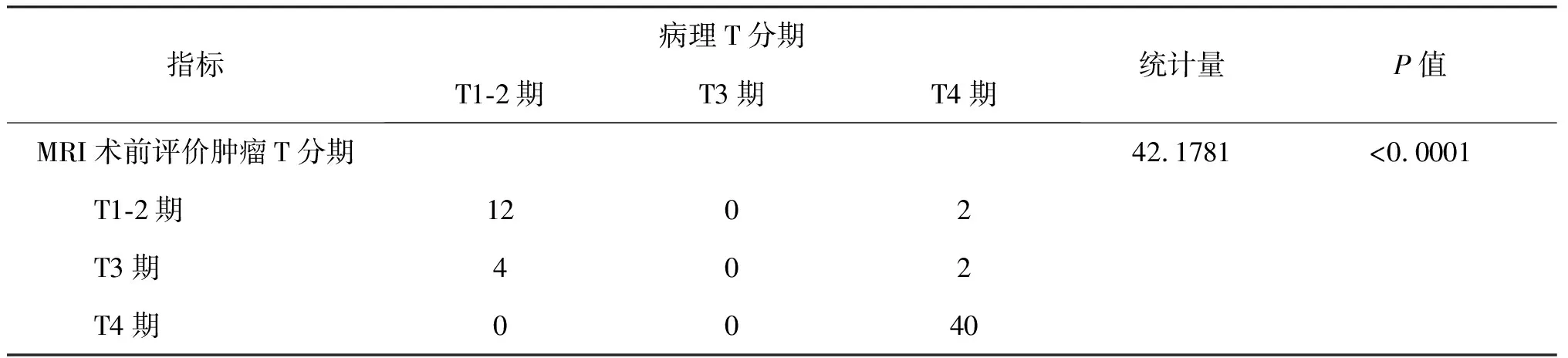
表1 应用MRI检查在术前诊断直肠癌T分期与术后病理T分期的对比情况表

表2 MRI检查的影响因素分析详细情况表
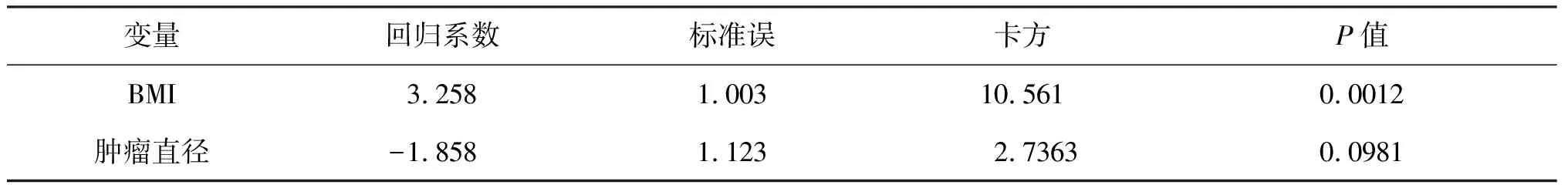
表3 患者BMI值和肿瘤最大直径统计分析表
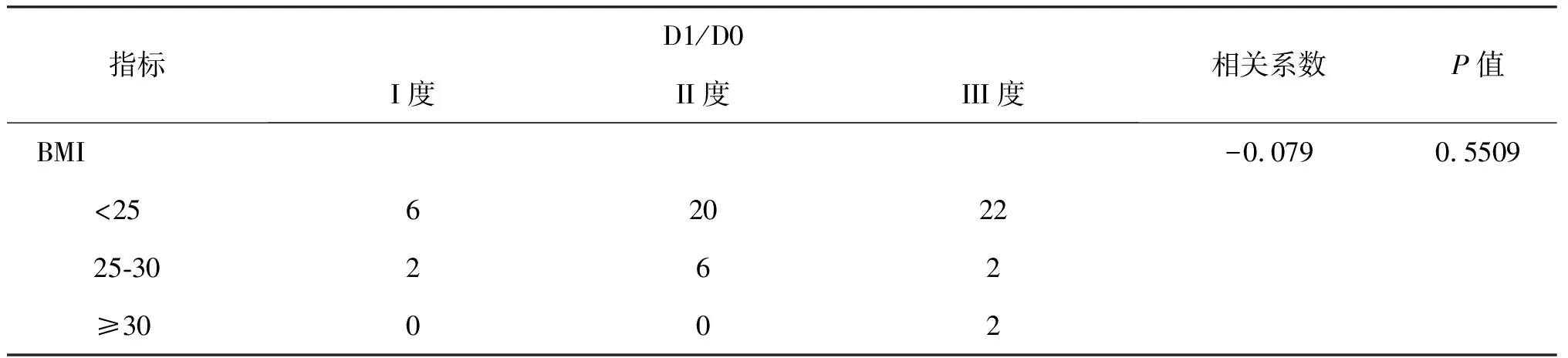
表4 患者BMI值和D1/D0情况分析表
讨 论
直肠癌在我国比较常见,死亡率较高,临床医生在诊疗的过程中经常需要根据不同的术前影像学检查分期来确定治疗的方案[36]。因为术前分期不同我们需要采用的治疗方案也就不同,所以需要我们在术前准确地对直肠癌的分期做出对判断,保证能够对直肠癌患者做出最佳的诊疗计划,使患者受益,应用MRI检查直肠系膜浸润程度从而在TME基础上实施手术,降低复发率[37-38]。目前对于术前直肠癌患者的分期主要依靠影像学检查,包括直肠腔内超声、CT、PET、MRI。但是不同的检查方式都有其各自的优缺点,都不能独自进行完全准确的直肠癌分期,需要根据患者的病情和医疗条件进行综合的检查和判定。
术前检查判定T分期是一项重要内容,目前MRI和直肠腔内超声应用比较广泛,MRI对于T3、T4期患者诊断率高,对T4期患者T分期诊断率可达到90%以上。PET检查可以发现微小的病灶,灵敏度高,对远处转移及骨转移诊断准确率高,对直肠癌原发病灶的诊断准确率效果更佳[39]。CT检查的准确率相对于以上检查相对较低,但是CT对肝脏转移以及其它部位的转移应用更广,特别适用于术后远处转移、复发的检查。在微小病灶检查方面MRI相对于CT而言更具有优势。不同的影像检查方法相结合,更能提高疾病的诊断准确率,为提供更好的临床治疗方案作出指导跟选择,为临床提供相对完整的诊疗信息。
早在1985就有学者报道MRI的作用,并且认为MRI的术前诊断价值高于CT的诊断。早期MRI检查确定直肠癌分期的原理依靠的是体线圈,这种方法不能很好地区分直肠各壁的不同结构,因此对于T分期诊断的准确率低。随后MRI检查的线圈不断得到改进,其诊断T分期的准确率不断得到提高。目前应用较广泛的腔内和相控阵线圈分辨力高,扫描范围广,并且能进行大范围的扫描成像,显著提高了直肠癌术前T分期的准确率。MRI分期的诊断在早期及中期(即T1-2、T3期)直肠癌患者中较低。对于直肠癌患者淋巴结转移的诊断,CT和MRI检查的准确率均不高,这是因为转移的淋巴结体积小,对于小的淋巴结的判定可能是转移性质的也可能是炎症作用于局部造成炎性肿大,并且在实际操作过程中很难区分正常淋巴结和转移淋巴结。目前影像学检查对于淋巴结的诊断仅停留在依靠形态的改变而判定,MRI可以根据信号强度来判定其良恶性[40]。MRI相对于CT检查而言,在肝转移的检查时更能检出相对微小的病灶。另外MRI可进行多种成像方法和方位。MRI检查不同的肠壁及周围层次可显示不同的信号变化,并且结合术后成像系统更能明确诊断。例如在判定筋膜层时显示低信号而在脂肪层显示高信号,肌层的信号低,粘膜下层信号程度相对较高,对于T1-2分期的检查显示低信号但难以分辨。目前我们可以肯定的MRI的优点是:软组织分辨能力强;可以较清楚地显像整块直肠系膜筋膜,对直肠癌环周切缘的阳性判断可靠性强;可以为淋巴结转移及其性质的判断提供依据;不同位置的直肠癌及肿瘤浸润的各种情况下MRI均可应用;操作性强,操作步骤简单不对诊断造成影响;对远处转移病灶亦可以检出。缺点:MRI检查对做过骨折等有金属植入的手术为禁忌,在判定T分期的过程中具有局限性,即对周围炎症增生和肿瘤病灶难以明确区分,对T2、T3的直肠癌患者预测分期区分能力差。
术前MRI诊断直肠癌T分期的准确率及一致性高(总体准确率为86.67%,k=0.703,P<0.0001),结果显示MRI诊断T1-2期的患者,准确率为85.7143%;MRI诊断T3期的准确率为0;T4期有报道为100%。影响MRI对直肠癌术前诊断T分期准确率的原因可能与临床医生的经验不足及病灶局部炎症反应或产生虚影有关,另外不同的患者直肠及系膜厚度的不同及肿瘤的浸润情况等都不尽相同,这也可能影响直肠癌术前分期的准确率。本研究显示T3期患者术前诊断准确率低,主要是样本中T3期患者较少,受影响因素的干扰可造成诊断的差异大。不同的文献对直肠癌术前MRI判定T分期已经有所研究,得出的结论均一致,与本研究相符。我们根据大宗的相关报道及本研究可以看到MRI的应用价值大,但是由于技术及操作的受限,很少有研究进行不同MRI设备下判定直肠癌的术前T分期的对比研究,现实中我们很难让患者在术前做多次MRI检查,因为我们面临的困难包括医院之间的协调问题、医疗浪费的问题、患者沟通及病情延误的问题等。应用单台的MRI判定不同患者的术前直肠癌T分期的统计分析显示,其结果可靠,并且肯定了MRI的应用价值。
目前很少有研究将患者不同的临床资料纳入研究,探索不同的因素对直肠癌术前MRI判定T分期的准确性的影响。大量的研究已经证实,但总体趋势在结直肠癌患者的个体化治疗效果的多学科综合治疗治疗前对判断分期的准确性,我们不断探讨和研究不同的患者应给予什么样的检查方法及不同的检查方法受不同因素的影响,针对不同的患者、不同的因素下我们可以了解术前MRI判定直肠癌T分期的差异。这不但对患者的检查及治疗具有指导意义,而且可以准确地实施个体化治疗,在MRI的诊断基础上进一步提高诊断的准确率及以后的治疗效果。根据临床上经常测量的有关指标及患者的可能影响MRI诊断准确性判定的自身指标,因此我们纳入了相关影响因素指标,即年龄、肿瘤最大直径、性别、肿瘤分化程度、肿瘤距离肛缘的距离、术前CEA、CA199、病理神经侵犯、血管瘤栓、淋巴管瘤栓、淋巴结转移数目、术前贫血、手术方式、BMI、D1/D0。统计学显示年龄在影响MRI对直肠癌术前T分期判定的准确率方面无意义,这可以说明我们在临床中对高龄患者跟年龄较小的患者行MRI检查时,结果不会产生年龄带来的差异;统计学显示直肠系膜浸润程度D1/D0在影响MRI对直肠癌术前T分期判定的准确率方面无意义,这可以说明我们在临床中对患者行MRI检查时,不同的直肠系膜浸润程度不会给检查结果带来影响,这可能与测量时的统计误差的存在有关,因为针对D1/D0不同的影像学医生的判定标准不统一,由于测量时截取MRI层面的不同其测量结果也不同,这些因素均可能影响结果的判定;统计学显示BMI在影响MRI对直肠癌术前T分期判定的准确率方面有意义,这可以说明我们在临床中对患者行MRI检查时,患者BMI不同会对MRI检查判定T分期的准确率造成影响,从数据中我们可以明显看出随着BMI的增大MRI术前判定直肠癌T分期的准确率降低,这可能是因为在BMI较高的患者中,直肠系膜及周围脂肪组织厚并且丰富,相对炎症反应及粘连相对BMI较小的患者难以与肿瘤进行区分,造成T分期准确率降低。因此我们面对BMI高的患者,在临床上可以结合或首先考虑采用直肠腔内超声检查。对于BMI低的患者,仅需行MRI检查就可准确判定直肠癌的准确率。在基层医院,对BMI高的患者只行直肠腔内超声检查也可以相对获得跟MRI同样的检查准确率,克服了基层医院资金不足的困难及减少患者所承担的费用,节省了医疗资源的浪费并避免过度检查。统计学显示性别在影响MRI对直肠癌术前T分期判定的准确率方面无意义,这可以说明我们在临床中对不同性别的患者行MRI检查时,结果不会产生性别带来的差异;统计学显示手术方式在影响MRI对直肠癌术前T分期判定的准确率方面无意义,这可以说明行两种不同手术方法时对患者行MRI检查的T分期准确率不会产生影响;统计学显示肿瘤的分化程度在影响MRI对直肠癌术前T分期判定的准确率方面无意义,因此,在患者肿瘤分化程度进行MRI检查的T分期的准确性并没有受到影响;肿瘤距离肛门的距离在影响MRI对直肠癌术前T分期判定的准确率方面无意义,所以我们可以排除肿瘤距离肛缘的距离对术前MRI检查判定T分期准确率的影响。
通过单因素分析和统计,P<0.05的BMI和肿瘤大小两项影响因素,有统计学意义,因此对BMI和肿瘤最大径进行多元Logistic逐步回归分析:变量BMI的P值为0.0012,变量肿瘤最大径的P值为0.0981,因此显示只有BMI对MRI诊断直肠癌的术前T分期的准确率有影响且相关。根据不同体型的患者我们计算出他们的BMI,当BMI不同时我们在决定是否行MRI时可以提供依据。探讨当前影响结直肠癌分期术前诊断准确性的因素研究尚未得到广泛的实施和应用。我们还需结合临床在实践中取得更多的数据,不断探索有哪些影响因素,通过多元logistic逐步回归分析,排除了其它影响因素之间对研究结果造成的影响,认为BMI作为研究的影响因素具有统计学意义。
对D1/D0及BMI进行的统计学分析显示,P=0.5509,相关系数为-0.079,无统计学意义,不同BMI患者跟D1/D0无相互影响,这样既从侧面说明BMI对直肠系膜浸润程度无关,我们又可以从中得出,直肠系膜浸润程度不受BMI影响。
通过术后1例直肠癌离体标本行MRI检查和术前MRI检查影像结果可以看出,两结果影像学表现相似,均为T3期,从另一个角度说明MRI术前诊断直肠癌T分期的准确性,但是由于采用塑料泡沫的显像与肿瘤对比性差,并且局部造成肿瘤的压迫,引起影像上存在一定的差异,离体直肠癌标本的MRI检查没有术前MRI扫描时患者脂肪等其它组织的影响,它们影像学表现相近。
[1] 韩洪秋,刘彤,赵丽中,等.第7版结直肠癌TNM分期(2010)的变化及意义.中华外科杂志,2010;48(21):1605-1606.
[2] Edge DR,ComptonCC,FritzAG,et al.AJCC Cancer Staging Manual(ed 7th Edition).New York:Springer,2010.
[3] Jessup JM,Gunderson LL,Greene FL,et al.2010 staging system for colon and rectal carcinoma.Ann Surg Oncol,2011:18:1513-1517.
[4] Bartram C,Brown G.Endorectal ultrasound and magnetic resonance imaging in rectal cancer staging.Gastroenterol Clin North Am,2002,31:827-839.
[5] Bipat S,Glas AS,Slors FJM,et al.Rectal cancer:local staging and assessment of lymph node involvement with endoluminal US,CT,and MR imaging-a meta-analysis.Radiology,2004,232:773-783.
[6] 温小恒,杨爱明,钱家呜.超声微探头在结直肠癌术前诊断中的价值.胃肠病学和肝病学杂志,2008,17(6):444-445.
[7] 高明勇,张永芬,卢瑞梁.无肠道准备直肠癌的MRI诊断和术前分期的价值.影像诊断与介入放射学,2004,13(3):177-180.
[8] Brown G,Richards CJ,Bourne MW,et al.Morphologic predictors of lymph node status in rectal cancer with use of high-Spatial resolution MR imaging with histopathologic comparison.Radiology,2003,227(2):371-377.
[9] Hussain SM,Outwater EK,Siegelman ES.Mucinous versus nonmucinous rectal carcinomas:differentiation with MR imaging.Radiology,1999,213(1):79-85.
[10] Dresen RC,Kusters M,Daniels-GooszenAW,et al.Absence of tumor invasion into pelvic structures in locally recurrent rectal cancer:prediction with preoperative MR imaging.Radiology,2010,256(1):143-150.
[11] Sauer R,Becker H,Hohenberger W,et al.Preoperative versus Postoperative chemoradiotherapy for rectal cancer.N Engl J Med,2004,351(17):1731-1740.
[12] 朱娟,徐永强,鲍克志,等.MRI在直肠癌术前评估的应用价值.安徽大学学报,2010,45(4):539-541.
[13] 卢爱国,周玮,尹华.直肠腔内超声在低位直肠癌术前分期的作用.中国内镜杂志,2002,8(3):17-18.
[14] Ren JH,Guo FJ,Dai WD,et a1.Study of endorectal ultra-sonography in the staging of rectal cancer.Chin Med J,2012,125:3740-3743.
[15] Gualdi GF,Casciani E,Guadalaxara A,et a1.Local staging of rectal cancer with transrectal ultrasound and endorectal magnetic resonance imaging:comparison with histologic findings.Dis Colon Rectum,2000,43:338-345.
[16] Rau B,Hunerbein M,Barth C,et a1.Accuracy of endoreetal ultrasound after preoperative radiochemotherapy in locally advanced rectal cancer.Surg Endose,1999,13:980-984.
[17] Vanagunas A,Lin DE,Stryker SJ.Accuracy of endoscopic ultrasound for restaging rectal cancer following neoadjuvant chemoradiation therapy.Am J Gastroenterol,2004,99:109-112.
[18] 齐振红,戴晴,姜玉新,等.直肠腔内超声对直肠癌术前新辅助放化疗疗效评估.协和医学杂志,2014,5(1):54-58.
[19] Puli SR,Bechtold ML,Reddy JB,et a1.Can endoscopic ultrasound predict early rectal cancers that can be resected endoscopically?A meta-analysis and systematic review.Dig Dis Sci,2010,55:1221-1229.
[20] Spinelli P,Schiavo M,Meroni E,et a1.Results of EUS in detecring perirectal lymph node metastases of rectal cancer:the pathologist makes the difference.Gastrointest Endosc,1999,49:754-758.
[21] Puli SR,Reddy JB,Bechtold ML,et a1.Accuracy of endoscopic ultrasound to diagnose nodal invasion by rectal cancers:a meta-analysis and systematic review.Ann Surg Oncol,2009,16:1255-1265.
[22] Cserni G.The influence of nodal size on the staging of colorectal carcinomas.J Clin Pathol,2002,55:386-390.
[23] Tan KK,Tsang CB.Staging of rectal cancer-Technique and interpretation of evaluating rectal adenocarcinoma,utl-4,N disease:2d and 3d evaluation.Semin Colon Rectal Surg,2010,21:197-204.
[24] 黄建荣,陈义波,周宇.MSCT与MRI在结直肠癌术前分期诊断中的价值比较.中外医学研究,2013,11(13):107-108.
[25] Kay T,Bayraktar Y.How useful is rectal endosonography in staging of rectal cancer?World J Gastroenterol,2010,16:69l-697.
[26] Ferndndez-Esparrach G,Ayuso-Colella JR,Sendino O,et a1.EUS and magnetic resonance imaging in the staging of rectal cancer:a prospective and comparative study.Gastrointest Endosc,2011,74:347-354.
[27] Samee A,Selvasekar CR.Current trends in staging rectal cancer.World J Gastroenterol,20l1,17:828-834.
[28] 邓海军,李国新,齐德林.直肠癌的术前影象学分期.世界华人消化杂志,2000,8(7):797-799.
[29] 汪晓东,吕东昊,李立,等.炎性介质CRP与SAA在结直肠癌术前分期的诊断价值.西部医学,2009,21(10):1713-1716.
[30] 顾晋.直肠肛门部恶性肿瘤.北京:北京大学医学出版社,2007:82-85.
[31] Klessen C,Rogajla P,Tanpitz M.Local staging of rectal cancer:the current role of MR.Eur Radiol,2007,17(2):379-389.
[32] Low RN,McCue M,Barone R,et al.MR staging of primary colorectal carcinoma:comparison with surgical and histopathologic findings.Abdom Imaging,2003,28(6):784-793.
[33] Blahd WH,Brown CV,Khonsary SA,et a1.PET scans of abdominal malignancy.World J Surg,1996,20:245-247.
[34] Reske SN.Current status of positron emission tomography in diagnosis of abdominal tumors.Praxis(Bern 1994),1999,88:52-58.
[35] 张晓鹏,孙应实.CT与MRI在直肠癌分期诊断中的应用.中国实用外科杂志,2010,30(10):831-834.
[36] 曹慧芳,史浩,柯勇,等.多层螺旋CT扫描在结直肠癌诊断和术前分期中的应用价值.医学影像学杂志,2007,17(7):716-719.
[37] Enker WE,Thaler HT,Cranor ML,et a1.Total mesorectal excision in the operative treatment of carcinoma of the rectum.J Am Coll Surg,1995,181(4):335-346.
[38] Mc Call JL,Cox MR,Wattchow DA.Analysis of local recurrence rates after surgery a1one for rectaI cancer.Int J Colorectal Dis,1995,10(3):126-l32.
[39] Keogan MT,Lowe VJ,Baker ME.et a1.Local recurrence of rectal cancer:evaluation with F-18 fluorodeoxyglucose PET imaging.Abdom Imaging,1997,22:332-337.
[40] Kim JH,Beets GL,Kim MJ,eta1.High-resolution MR imaging for nodal staging in rectal cancer:are there any criteriain addition to the size?Eur J Radiol,2004,52(1):78-83.

