萘酰亚胺类荧光分子探针的研究进展
李 辉, 董 毅, 郝志云, 杨新周, 朱以常
(德宏师范高等专科学校,云南 芒市 678400)
萘酰亚胺类荧光分子探针的研究进展
李 辉, 董 毅, 郝志云, 杨新周, 朱以常
(德宏师范高等专科学校,云南 芒市 678400)
荧光分子探针作为一种有效的金属离子检测手段,不仅使用方便,而且具有高灵敏度,高选择性等突出的优点. 作者综述了萘酰亚胺类荧光分子探针的最新研究进展;指出萘酰亚胺化合物具有独特的荧光化学性质(如荧光量子产率高、荧光发射波长适中、斯托克斯位移大、光稳定性好、结构易于修饰等),因此被广泛应用于荧光探针研究领域,并且在合成、离子识别、检测及细胞成像等方面不断取得新的应用.
萘酰亚胺;荧光;分子探针;研究进展
过渡金属及重金属在自然界中广泛地存在,他们中的一些元素在生命过程中具有重要的功能,而另外一些元素则在很低浓度时就对生物具有极强的毒性,因此这些物质的检测对生命、环境和医学科学以及工、农业生产等都有重要的意义[1]. 目前国际上比较先进的检测方法就是荧光分子探针检测法,此检测法不仅方法简便,而且在灵敏度、选择性、响应时间、原位测定(如荧光成像技术)以及利用光纤进行远距离检测方面均有突出优点,因此在传统的受体分子上连接荧光团,构造超分子荧光传感器用于识别金属离子的研究近年颇受重视[2].
目前应用广泛的荧光物质主要分为以下几种类型:萘酰亚胺类、罗丹明类、荧光素类、菁染料、BODIPY(氟硼二吡咯)类、喹啉类等,其中1,8-萘酰亚胺类化合物是近年来比较热门的功能材料. 1,8-萘酰亚胺是由1,8-萘酐制备而来的,1,8-萘酐本身没有荧光,在4-位引入如氨基等供电子基团后形成强的推拉电子体系,使电子容易激发,从而发出荧光[3]. 这类荧光团的分子结构具有如下几个特点[4-5]:共平面性;具有较大的共轭体系;分子结构中一端具有强的给电子能力,另一端具有强的吸电子能力,因此其分子结构中存在着一个大的“吸-供电子共轭体系”. 处于这样体系中的电子很易受到光的照射而发生跃迁,从而产生荧光,特别是4-位有强供电子基如氨基的衍生物都能够发射强的荧光.
萘酰亚胺类荧光团具有荧光量子产率高、荧光发射波长适中、斯托克斯位移大、光稳定性好和结构易于修饰等优点,已被广泛应用于荧光传感领域,被用来测定Na+[6]、Hg2+[7-9]、Cu2+[10-11]、Zn2+[12-13]等金属离子. 近些年来,研究人员主要致力于萘酰亚胺的萘环上的单取代和双取代的衍生物方面的研究,通过引入不同的取代基后得到新的化合物,并取得了一定成效.
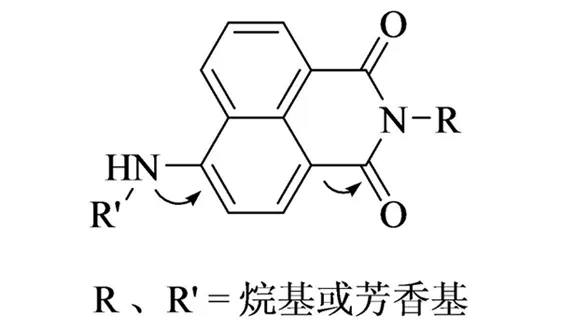
图1 萘酰亚胺衍生物的结构Fig.1 The structure of 1,8-naphthalimide derivatives
1 单取代萘酰亚胺衍生物
由于在萘酰亚胺的4-位上引入供电子基团之后会导致其荧光增强,因此对于单取代的萘酰亚胺类荧光探针主要是集中在1,8-萘酰亚胺的4-位取代的研究上.
2010年CHEN等人基于萘酰亚胺为荧光团,硫氮杂环为识别基设计合成了Hg2+的高选择性和高灵敏度的荧光传感器1[14],该探针在水溶液中识别Hg2+,其荧光强度增大5倍. 此外,探针和Hg2+的络合物可以选择性的识别Ag+,使其荧光猝灭. 细胞实验证明该探针可应用于生物系统中对Hg2+的检测.
XU等人设计合成了锌离子比率荧光分子探针2[15]. 在乙腈溶液中,该探针能够排除其他重金属和过渡金属离子的干扰,对锌离子显现出极高的选择性. Zn2+的加入使得2的荧光增强22倍,红移31 nm,发射绿色荧光. 有趣的是,Cd2+的加入也能够使其荧光增强21倍,蓝移38 nm,发射蓝色荧光,因此可以通过肉眼区分Zn2+和Cd2+. 该探针成功的应用于细胞内Zn2+的成像,和斑马鱼胚胎生长过程中Zn2+的检测.
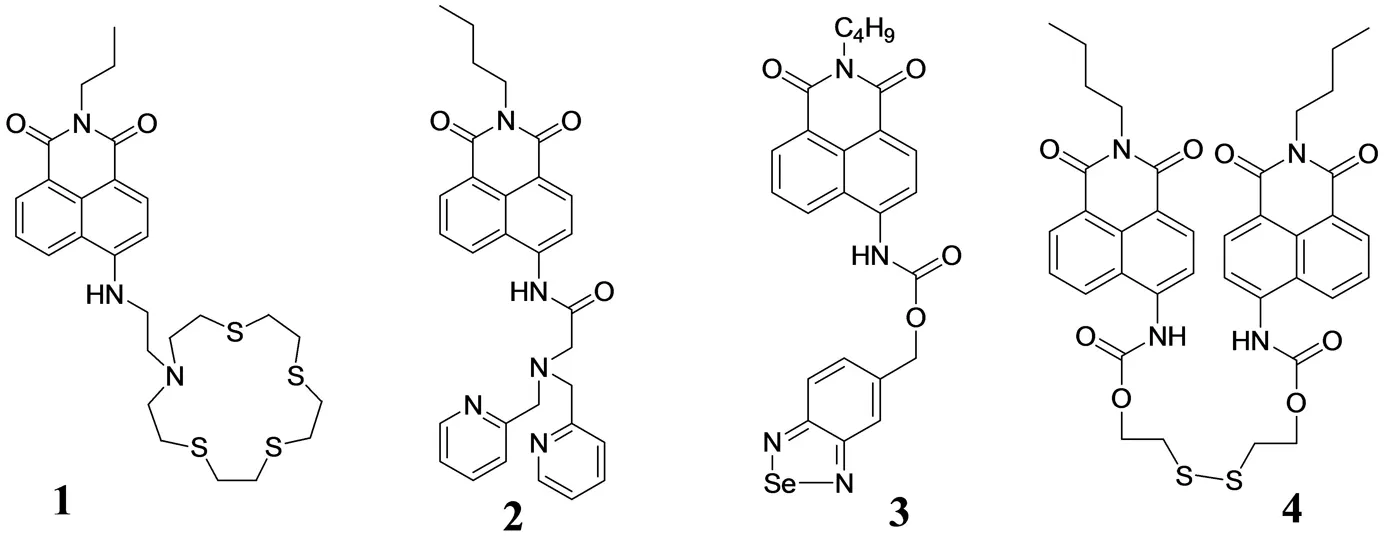
图2 单取代1,8-萘酰亚胺类荧光探针Fig.2 The substituted 1,8-naphthalimide fluorescent probes
ZHU基于ICT(分子内电荷转移)机理设计萘酰亚胺荧光分子探针3[16]和4[17]. 探针3对DTT(1,4-二硫苏糖醇)有很高的选择性且荧光发生66 nm红移,可以用肉眼直接观察到,颜色由无色变到绿玉色. 细胞成像实验进一步证实该探针可以应用于生物环境中DTT的检测及研究. 化合物4是以二硫醚基团为识别基设计出的硫醇类高选择性比率荧光分子探针. 随着硫醇的加入,探针4呈现出48 nm的荧光发射红移,且颜色由无色变成绿玉色,可用肉眼直接观察到. 最为重要的是,该化合物是第一个通过比率荧光方法检测生物体系中谷胱甘肽含量的探针.
XU等人[18]基于萘酰亚胺为荧光团及PET(光诱导电子转移)机理设计并合成了一个连有新颖受体的荧光探针化合物5. 在水溶液中,该探针是Ag+的一个高选择性的荧光开启探针,当有其他各种金属离子尤其是汞离子存在时,并不影响探针5对Ag+的高选择性. 同时,探针5与Ag+以1∶1方式进行结合,所形成的探针5-Ag+配合物在阴离子溶液中选择性识别I-,且荧光强度显著减弱;因此可以把探针5和Ag+所形成的配合物称作是碘离子的一个选择荧光“开-关”探针. 此外,通过活细胞的成像实验,该探针可以用来检测细胞内的Ag+.
LIU等人[19]基于1,8-萘酰亚胺和8-氨基喹啉荧光团设计并合成了Cu2+的一个新的比率荧光传感器6. 在水溶液中当有其他过渡金属离子存在时,该探针受到两个荧光团的共同作用对Cu2+呈现出高度选择性比率响应,同时探针的荧光强度增强. 此外,该探针还被成功应用到了人类乳腺癌细胞中对Cu2+的监测成像.
ZHANG等人[20]设计并合成了探针7,该探针以1,8-萘酰亚胺为荧光团. 在水溶液中以DPA(N,N-二(2-吡啶甲基)胺)为识别基团,对Zn2+表现出高的选择性并发生了大的荧光改变,这是因为探针与Zn2+结合之后,Zn2+抑制了探针的PET过程导致其荧光强度增大59倍并伴有29 nm的红移. 同时化合物7与Zn2+所形成的配合物,在各种阴离子存在的条件下对PPi(焦磷酸盐)有很好的选择性识别,其荧光发生23 nm蓝移并伴随有明显的荧光猝灭现象. 在生物学的应用方面,该探针已经被成功应用于C2C12细胞中Zn2+和PPi的检测.
KIM等人[21]设计并合成了F-的一个新型比色和比率的荧光传感器8,在乙腈溶液中,随着F-的加入,Si-O键断裂,探针8分解出一个4-氨基-1,8-萘酰亚胺绿色荧光化合物,最终导致探针的荧光发射光谱发生了49 nm的红移、溶液的颜色发生了显著的改变,由无色变成浅绿色,同时伴随着双光子吸收和发射比率变化. 此外,到目前为止,该探针是F-的第一个基于萘酰亚胺的双光谱比率荧光探针.
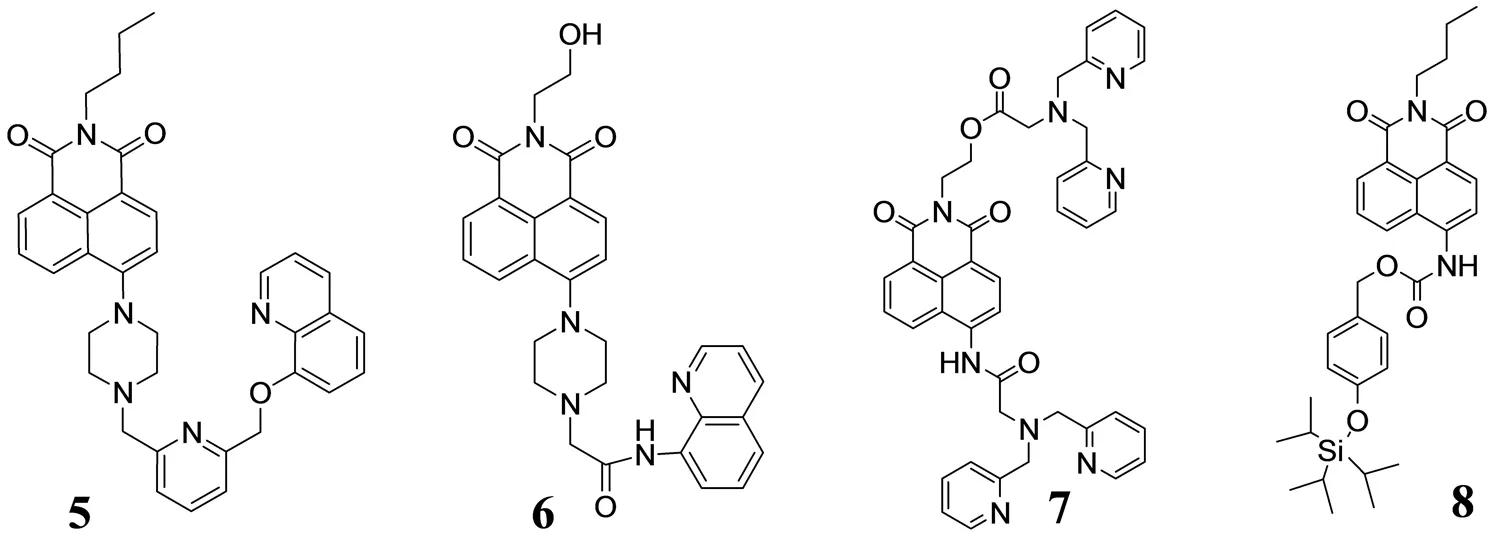
图3 单取代1,8-萘酰亚胺类荧光探针Fig.3 The substituted 1,8-naphthalimide fluorescent probes
CHEN等人[22]基于PET机理设计合成探针9,可在乙腈水溶液中选择性识别Cu2+,其荧光增强4.5倍,并以1∶1方式与Cu2+结合,因此该探针可以称作Cu2+荧光开启型探针. 值得注意的是,该探针对Cu2+表现出高的灵敏性,其对Cu2+的检测极限能够达到0.15 μmol·L-1.
KUMARM等人[23]基于荧光能量共振转移(FRET)机理设计合成了一个带有萘酰亚胺和罗丹明两个荧光团的探针10,该探针通过键能转移的方式在THF-H2O中选择性识别Hg2+,并伴有荧光峰红移,其荧光强度增强407倍,荧光量子产率增加9倍. 该探针与Hg2+所形成的配合物在KI溶液中荧光猝灭,但是随着Hg2+的加入,其荧光又恢复,这就暗示着该探针对Hg2+响应是可逆的. 此外,该探针还被成功用到前列腺癌症细胞中Hg2+的成像实验,这将有助于我们认识处于分子阶段的生物发展过程.
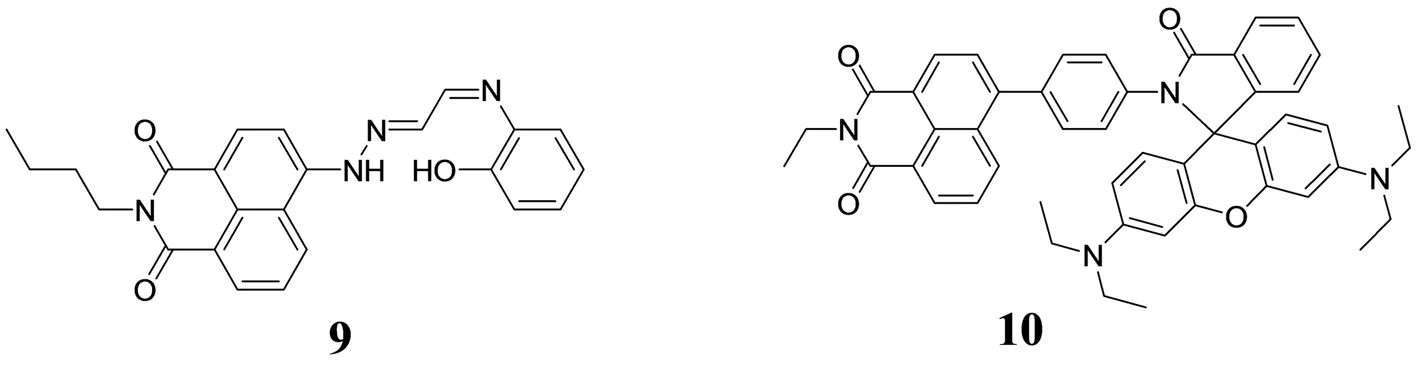
图4 单取代1,8-萘酰亚胺类荧光探针Fig.4 The substituted 1,8-naphthalimide fluorescent probes
2 双取代萘酰亚胺衍生物
近些年来经研究发现双取代萘酰亚胺衍生物在设计合成荧光分子探针方面有一些特别的优点,如具有更好的刚性结构以及金属离子结合位点,双取代的氨基易发生去质子化促进吸收以及发射光谱向长波方向移动等. 因此,研究人员主要在萘酰亚胺的4,5-位或3,4-位引入不同取代基作为受体,设计合成了一系列荧光探针.
XU基于ICT机理设计合成了新的4,5-二取代-1,8-萘酰亚胺衍生物11[24],该化合物为Cu2+离子的比率荧光传感器. 在纯水溶液中,随着Cu2+的加入,荧光发射发生蓝移,从534 nm蓝移至478 nm,荧光增强. 此外,在纯水中该传感器与Cu2+的络合物可以作为氰化物的比率荧光传感器.
QIAN等人设计合成了不对称取代4,5-二氨基-1,8-萘酰亚胺荧光传感器12[25],该探针在中性水溶液中专一识别Cu2+,当其受体与Cu2+结合后,与1,8-萘酰亚胺荧光团相连的仲胺发生去质子化,导致氮原子供电子能力增强,使得吸收峰发生50 nm红移并且产生较大的比色响应. 此外,在pH=6.0 ~ 12范围内探针不受溶液的酸碱性影响,该探针能够在强碱环境下检测Cu2+. 这是第一个能够在如此大的pH范围内检测Cu2+的荧光化学传感器.
QIAN等以1,8-萘酰亚胺为荧光团,2-氨基二苯胺为识别基团设计合成了可以用肉眼直接观察的Cu2+比色荧光传感器13[26],在中性水溶液中专一识别Cu2+,表现出对Cu2+很好的选择性和灵敏度,其分析检测极限为3.0 × 10-7mol·L-1,探针与Cu2+按1∶1络合,络合之后与1,8-萘酰亚胺荧光团相连的仲胺发生去质子化导致氮原子供电子能力增强,使得吸收峰发生78 nm红移并且带有比色响应.
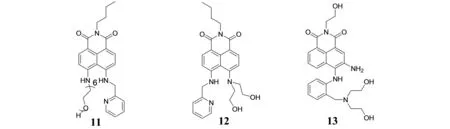
图5 双取代1,8-萘酰亚胺类荧光探针Fig.5 The disubstituted 1,8-naphthalimide fluorescent probes
CHEN等人[27]基于ICT机理设计并合成了N-丁基-4,5-二取代-1,8-萘酰亚胺(14),是Cu2+的一个新型比率、专一选择性的荧光分子探针. 该探针在乙醇-水溶液中比率响应Cu2+,并伴随着荧光颜色的改变,即由黄色变化到绿色;且与铜离子的结合比为1∶1,即使有其他的金属离子存在,也不影响该探针对Cu2+的专一选择性. 值得注意的是,该探针在人工培养的细胞中成功的检测到了Cu2+的存在并带有相同的荧光改变. 由于探针中两个羰基的引入使得与萘环相连的两个氨基的供电子能力减弱,导致了探针在识别Cu2+过程中发生了50 nm的蓝移. 这种带有羰基的传感器的设计思路对其他金属离子荧光传感器的设计和发展有一定的启示作用.
ZHANG等人[28]设计并合成了组氨酸和富含组氨酸蛋白质的一个高选择性比色和荧光增强的荧光分子探针15. 在中性稀的乙醇-水溶液中有20种天然氨基酸存在时,该探针可以高选择性和高灵敏度地识别组氨酸,且用肉眼可直接观察到溶液颜色由棕红色变成浅绿色;同时在537 nm处,该探针的荧光强度增大18倍,荧光量子产率增加99倍,是一个典型的荧光“关-开”型探针. 此外,该探针还可以检测到富含组氨酸的蛋白质并且成功应用到细胞内组氨酸和富含组氨酸蛋白质的检测,这预示着该探针具有一定的应用前景.
JANG等人[29]设计并合成了一种水溶性的T1(纵向弛豫)核磁共振成像造影剂16,该探针以1,8-萘酰亚胺为荧光团其萘环的4-位和5-位引入了Gd3+离子的螯合剂DTTA(二亚乙基三胺四乙酸). 在金属离子溶液中,该探针选择性识别Cu2+,由于Cu2+的顺磁性导致探针荧光猝灭,然而随着Cu2+的加入该探针的T1核磁共振成像信号增强. 这个新型探针造影剂可以被应用于活细胞中游离Cu2+的检测,同时通过该探针的合成与应用将更大程度的激发研究人员去设计并发展新型的探针用于活细胞中游离金属离子的检测.
李辉设计并合成了一系列3,4-二取代-1,8-萘酰亚胺衍生物荧光分子探针[30],在甲醇-水溶液中研究了他们的光谱性能,发现4-位氨基连接喹啉的3,4-二氨基-1,8-萘酰亚胺荧光探针17对Cu2+表现出良好的选择性络合促进的荧光增强识别现象,其荧光强度增加约5倍. 该探针与Cu2+结合后导致萘酰亚胺4-位氨基上的氢离去,氨基的供电子能力增强,促进了ICT过程,其最大吸收峰红移100 nm,可直接观察到溶液颜色由黄色变成紫红色. 因此,该探针是一个Cu2+变色响应同时荧光增强的双通道检测探针分子. 同时,该探针与Cu2+结合所形成的配合物是NO的第一个基于邻苯二胺型比色荧光探针[31].
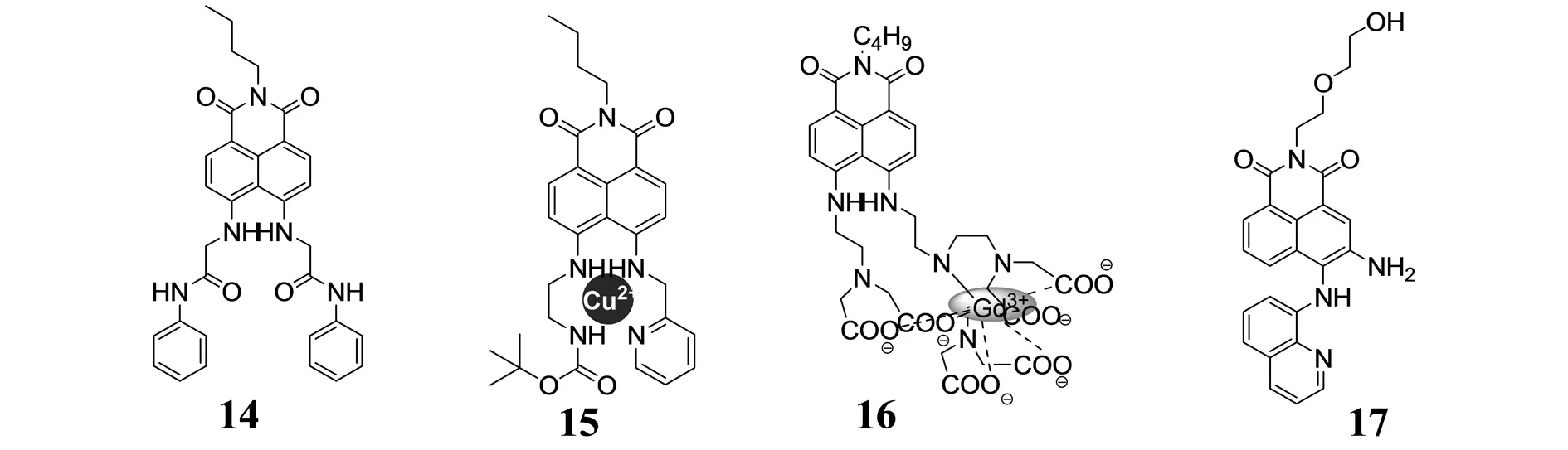
图6 双取代1,8-萘酰亚胺类荧光探针Fig.6 The disubstituted 1,8-naphthalimide fluorescent probes
3 结论与展望
基于萘酰亚胺独特的荧光化学性质,以萘酰亚胺为荧光团的荧光探针的研究已经成为了一个非常热门的研究领域,并且已初步应用于环境科学、生物学、分析化学等学科领域的研究. 目前虽然已有大量优秀的此类荧光探针被合成出来,并且其中部分性质优秀的探针已成功应用于细胞和生物体内金属离子、阴离子等的识别、检测和成像研究,但是如何更好地优化已有荧光探针的性能并进一步推进其在临床医疗、环境检测尤其是疾病诊断治疗等领域的实际应用,是我们所面临的一个重要问题. 此外,为了便于荧光探针的应用,实现荧光分子探针的集成化和非均相化也将是未来的研究重点.
[1]朱维平, 徐玉芳, 钱旭红. 具有重要生物学意义的重金属及过渡金属离子荧光分子探针[J]. 化学进展. 2007, 19(9): 1229-1238.
[2]马国春. 新型萘酰亚胺金属离子荧光探针的设计、合成及性能研究[D]. 天津: 天津大学博士学位论文, 2007.
[3]赵同丰, 赵德丰, 于华云,等. 1,8-萘酰亚胺类荧光材料的进展[J]. 染料工业,1997, 34(1): 8-15.
[4]王秀玲, 李亚明, 张华. 用于有机电致发光材料的萘酰亚胺类荧光染料的研究进展[J]. 染料与染色, 2005, 42(3): 1-4.
[5]AEXIOU M S, TYCHOPOUK V, GHORBANIAN S, et al. The UV-Visible absorption and fluorescence of some substituted 1,8-naphthlimides and naphthalic anhydrides [J]. J Chem Soc; Perkin Trans, 1990, 5: 837-842.
[6]HE Huarui, MORTELLARO M A, LEINER M J P, et al. Fluorescent chemosensor for sodium based on photoinduced electron transfer [J]. Anal Chem, 2003, 75(3): 549-555.
[7]LI Chunyan, ZHANG Xiaobing, YU Ruqin, et al. Naphthalimide-porphyrin hybrid based ratiometric bioimaging probe for Hg2+: well-resolved emission spectra and unique specificity [J]. Anal Chem, 2009, 81(24), 9993-10001.
[8]LIU Bin, TIAN He. A selective fluorescent ratiometric chemodosimeter for mercury ion [J]. Chem Commun, 2005, 25(1): 3156-3158.
[9]GUO Xiangfeng, QIAN Xuhong, JIA Lihua. A highly selective and sensitive fluorescent chemosensor for Hg2+in neutral buffer aqueous solution [J]. J Am Chem Soc, 2004, 126(8): 2272-2273.
[10]XU Yufang, LU Feng, QIAN Xuhong, et al. Highly sensitive and selective ratiometric fluorescent copper sensors: different binding affinities modulated by three separate side chains of naphthalimide [J]. Sci China Ser B: Chem, 2009, 52(6): 771-779.
[11]JISHA V S, THOMAS A J, RAMAIAH D. Fluorescence ratiometric selective recognition of Cu2+ions by dansyl- naphthalimide dyads [J]. J Org Chem, 2009, 74: 6667-6673.
[12]WANG Jiaobing, XIAO Yi, QIAN Xuhong, et al. A pH-resistant Zn(II) sensor derived from 4-aminonaphthalimide: design, synthesis and intracellular application [J]. J Mater Chem, 2005, 15: 2836-2839.
[13]HA N L, XU Zhaochao, SOOK K K. Pyrophosphate-selective fluorescent chemosensor at physiological pH: formation of a unique excimer upon addition of pyrophosphate [J]. J Am Chem Soc, 2007, 129(13): 3828-3829.
[14]CHEN Tao, ZHU Weiping, XU Yufang, et al. A thioether-rich crown-based highly selective fluorescent sensor for Hg2+and Ag+in aqueous solution [J]. Dalton Trans, 2010, 39: 1316-1320.
[15]XU Zhaochao, BAEK K H, YOON J. Zn2+-Triggered amide tautomerization produces a highly Zn2+-selective, cell-permeable, and ratiometric fluorescent sensor [J]. J Am Chem Soc, 2010, 132: 601-610.
[16]ZHU Baocun, ZHANG Xiaoling, TAN Weihong, et al. A highly selective ratiometric fluorescent probe for 1,4-dithiothreitol (DTT) detection [J]. Org Biomol Chem, 2010, 8: 1650-1654.
[17]ZHU Baocun, ZHANG Xiaoling, LI Yamin, et al. A colorimetric and ratiometric fluorescent probe for thiols and its bioimaging applications [J]. Chem Commun, 2010, 46: 5710-5712.
[18]XU Lin, XU Yufang, QIAN Xuhong, et al. A highly selective and sensitiveuorescence “turn-on” probe for Ag+in aqueous solution and live cells [J]. Dalton Trans, 2012, 41: 7212-7217.
[19]LIU Zhipeng, ZHANG Changlin, GUO Zijian, et al. Design and synthesis of a ratiometric fluorescent chemosensor for Cu(II) with a fluorophore hybridization approach [J]. Org Lett, 2012, 14(17): 4378-4381.
[20]ZHANG Junfeng, KIM S, KIM J S, et al. Pyrophosphate-selective fluorescent chemosensor based on 1, 8-naphthalimide-DPA-Zn(II) complex and its application for cell imaging [J]. Org Lett, 2011, 13(19): 5294-5297.
[21]ZHANG Junfeng, LIM C S, KIM J S, et al. A highly selective colorimetric and ratiometric two-photon fluorescent probe for fluoride ion detection [J]. Org Lett, 2011, 13(5): 1190-1193.
[22]CHEN Zhijun, WANG Limin, CHEN Li, et al. Highly selectiveuorescence turn-on chemosensor based on naphthalimide derivatives for detection of copper(II) ions [J]. Spectrochim Acta Part A: Mol and Biomol Spectrosc, 2013, 105: 57-61.
[23]KUMAR M, KUMAR N, KAUR T, et al. Naphthalimide appended rhodamine derivative: through bond energy transfer for sensing of Hg2+ions [J]. Org Lett, 2011, 13(6): 1422-1425.
[24]XU Zhaochao, PAN Jie, SPRING D R. Ratiometric fluorescent and colorimetric sensors for Cu2+based on 4,5-disubstituted-1,8-naphthalimide and sensing cyanideviaCu2+displacement approach [J]. Tetrahedron, 2010, 66: 1678-1683.
[25]HUANG Junhai, XU Yufang, QIAN Xuhong. A red-shift colorimetric and fluorescent sensor for Cu2+in aqueous solution: unsymmetrical 4,5-diaminonaphthalimide with N-H deprotonation induced by metal ions [J]. Org Biomol Chem, 2009, 7: 1299-1303.
[26]HUANG Junhai, XU Yufang, QIAN Xuhong. A colorimetric sensor for Cu2+in aqueous solution based on metal ion-induced deprotonation: deprotonation/protonation mediated by Cu2+-ligand interactions [J]. Dalton Trans, 2009: 1761-1766.
[27]CHEN Xiufu, WANG Jingyun, PENG Xiaojun, et al. A ratiometric and exclusively selective Cu(II)uorescent probe based on internal charge transfer (ICT) [J]. Tetrahedron, 2011, 67: 4869-4873.
[28]ZHANG Shenyi, YANG Chunmei, QIAN Xuhong, et al. Highly selective, naked-eye anduorescent “off-on” probe for detection of histidine/histidine-rich proteins and its application in living cell imaging [J]. Org Biomol Chem, 2012, 10: 1653-1658.
[29]JANG J H, BHUNIYA S, KIM J S, et al. Cu2+-Responsive bimodal (optical/MRI) contrast agent for cellular imaging [J]. Org Lett, 2013, 15(18): 4702-4705.
[30]李 辉. 3,4-二取代-1,8-萘酰亚胺衍生物荧光分子探针的合成及性能研究 [D].齐齐哈尔:齐齐哈尔大学硕士学位论文,2011.
[31]SUN Xiaolong, XU Yufang, QIAN Xuhong, et al. Copper-promoted probe for nitric oxide based ono-phenylenediamine: Large blue-shift in absorption anduorescence enhancement [J]. Anal Methods, 2012, 4: 919-922.
Researchprogressofnaphthalimide-based
fluorescentmolecularprobes
LI Hui, DONG Yi, HAO Zhiyun, YANG Xinzhou, ZHU Yichang
(DehongNormalCollege,Mangshi678400,Yunnan,China)
Fluorescent molecular probes as a kind of efficient means to detect metal ions exhibit the advantages of easy operation as well as high sensitivity and selectivity. This review summarizes the most recent research progress of naphthalimide-based fluorophore molecular probes. It is pointed out that naphthalimides exhibit unique fluorescent chemical properties (such as high fluorescence quantum yield, moderate fluorescence emission wavelength, large Stokes shifts, good light stability and good accessibility to structure modification). This is why naphthalimides are highly focused on the research field of fluorophore molecular probes. Besides, it is also pointed out that new progresses have been continuously made in the synthesis, ion recognition, detection and applications in live cell imaging of naphthalimide fluorescent molecular probes.
naphthalimide; fluorescence; molecular probe; research progress
2014-01-08.
李 辉(1985-),男,助教,研究方向为荧光分子探针. E-mail:ww.lihui@163.com.
O 644.3
A
1008-1011(2014)03-0311-06

