痂囊腔菌素A与咔唑化合物间的光致电子转移
劳文剑 , 李 聪 , 台 虹, 尤进茂
(1.中国科学院 兰州化学物理研究所, 甘肃 兰州 730000; 2.云南大学 化学科学与工程学院, 云南 昆明 650091;3.云南省第一人民医院, 云南 昆明 650032; 4. 曲阜师范大学 化学化工学院,山东 曲阜 273165)
痂囊腔菌素A与咔唑化合物间的光致电子转移
劳文剑1*, 李 聪2, 台 虹3, 尤进茂4
(1.中国科学院 兰州化学物理研究所, 甘肃 兰州 730000; 2.云南大学 化学科学与工程学院, 云南 昆明 650091;
3.云南省第一人民医院, 云南 昆明 650032; 4. 曲阜师范大学 化学化工学院,山东 曲阜 273165)
研究了咔唑、咔唑-9-乙酸、3-溴-咔唑-9-乙酸在缺氧条件下对天然苝醌化合物痂囊腔菌素A(简记为 EA)的荧光猝灭行为;由竹红菌甲素(HA)和乙素(HB)的荧光寿命估算了EA在乙腈中的荧光寿命,并进而计算了三个咔唑化合物的双分子猝灭速度常数. 结果表明,三个咔唑化合物在EA的可见光吸收区无光吸收,据此推测其对EA的荧光猝灭作用归因于咔唑化合物作为电子给体而EA作为电子受体的光致电子转移作用. 三个咔唑化合物的Stern-Volmer猝灭常数分别为698、704和1 063 L·mol-1;乙酸基对咔唑环的光致电子转移速率几乎没有影响,而溴原子取代能够增加咔唑化合物对EA的荧光猝灭程度和光致电子转移速率. 此外,EA在乙腈中的荧光寿命为1.98 ns,而三个咔唑化合物的双分子猝灭速率常数分别为3.52×1011,3.56×1011和5.37×1011L·mol-1·s-1.
痂囊腔菌素A;咔唑化合物;光致电子转移;荧光猝灭

在天然苝醌化合物中,痂囊腔菌素A(EA)有着最高的单重态氧量子产率,是一种有应用前景的光敏剂[2],但由于其来源有限,因此相关的研究较少. 1998年,中国的李聪和台虹研究组掌握了实验室生物合成EA的方法,从而解决了其来源问题. 他们还深入研究了EA的光物理和光化学性质,测试了EA对人Hce8693盲肠癌细胞增殖周期的影响和细胞凋亡的诱导作用,合成一些EA衍生物并评价了光敏活性[3-5]. 此外,其他研究组也有一些新的发现,如EA对革兰氏阳性细菌具有光敏抑制作用[6],EA在光照下能杀死植物细胞[7],EA能静态猝灭肌红蛋白的内源荧光[8], 甲酰胺在DMSO中能动态猝灭EA的荧光[9].
咔唑化合物不仅是好的电子给体[10],是有机光导材料的原料,而且有强的生理活性,已作为药物使用. 咔唑化合物和EA在体外和体内有可能并存,因此研究它们之间的光致电子转移作用是有意义的. 本文中作者报道了EA与三个咔唑化合物(图1),即咔唑(carbazole)、9-咔唑乙酸(carbazol-9-yl-acetic-acid,CEA)和3-溴-9-咔唑乙酸(3-Br-carbazol-9-yl-acetic-acid,3-Br-CEA)之间的光致电子转移作用,目的是为了进一步了解EA的光物理性质和评价取代基对咔唑化合物光致电子转移速率的影响.

图1 EA和咔唑化合物的化学结构Fig.1 Chemical structures of EA and the carbazole compounds
1 实验部分
EA由云南大学李聪研究组通过生物合成制得[3]. 咔唑(分析纯)和乙腈购自北京化学试剂公司. 9-咔唑乙酸和3-溴-9-咔唑乙酸采用微波辐照的方法合成[11]. 乙腈加入P2O5回流4 h后蒸出备用. 紫外-可见光光谱仪是SPECORDUVVis型(AnalytikJenaAG,Germany). 荧光光谱仪是岛津RF-540型. 比色皿的规格为1 cm×1 cm×4 cm.
将EA配成1×10-5mol/L的乙腈溶液,将咔唑、9-咔唑乙酸和3-溴-9-咔唑乙酸分别配成5×10-3mol/L的乙腈溶液. 所有溶液均通氩气除氧. 实验中,首先分别单独测定这四个化合物的紫外-可见光谱和荧光光谱,然后分别测定EA和单个咔唑化合物的混合物的吸收光谱. 荧光猝灭实验测量单个咔唑化合物对EA荧光的猝灭. 测定时取EA溶液3 mL加入到比色皿中,依次取一定体积的单个咔唑化合物的乙腈溶液加入到比色皿中,测定荧光光谱.
2 结果与讨论
2.1 紫外-可见光谱
三个咔唑化合物的最长紫外-可见光的吸收波长比EA的短(表1). 咔唑化合物在这些特征吸收峰的长波方向没有可见光的吸收,而且这些特征吸收峰与EA的相距较远(> 100 nm) . 当波长> 400 nm时,EA与咔唑、咔唑-9-乙酸或3-溴-咔唑-9-乙酸混合物的吸收光谱只是EA本身的吸收光谱[8].

表1 四个化合物在乙腈中的紫外-可见光和荧光光谱特征峰Table 1 Characteristic peaks of the four compounds in acetonitrile
2.2 荧光光谱
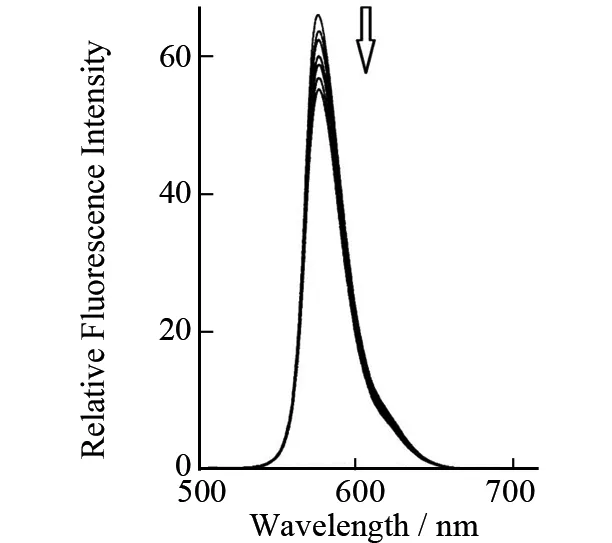
图2 3-溴-9-咔唑乙酸猝灭痂囊腔菌素A的荧光Fig.2 Fluorescence of Elsinochrome A quenched by 3-Br-Carbazol-9-yl-acetic acid
三个咔唑化合物的最长荧光激发波长和最大发射波长都比EA(584 nm)的短(表1). 由于EA与咔唑化合物的紫外吸收峰和荧光发射峰波长差异大,因此对EA和咔唑化合物的混合溶液,用470 nm激发波长可以选择性的激发EA. 咔唑、9-咔唑乙酸或3-溴-9-咔唑乙酸的加入,对EA的荧光有猝灭作用,但是没有改变荧光光谱的形状. EA的荧光强度随咔唑化合物的浓度增大而降低(图2). 咔唑化合物的紫外和荧光波长都比EA的短,因而激发单重态能量比EA高,所以猝灭作用不可能发生从激发态EA到咔唑化合物的能量转移. 张曼华等报道了在无氧条件下,竹红菌甲素(HA)和乙素(HB)的荧光被胺类化合物如N,N-二乙基苯胺猝灭,通过自由能(ΔG)的估算、吸收光谱、顺磁共振波谱和激光闪光光解的研究,认为是发生了从基态的胺类分子向激发态的竹红菌甲素光致电子转移的作用[12]. 张宏等观察到咔唑向荧光素的分子内的光致电子转移反应. 在这些研究的基础上,我们推断是发生了咔唑作为电子给体,EA作为电子受体的光致电子转移作用[10].
2.3 讨论
猝灭过程遵循Stern-Volmer方程:

其中F0为无猝灭剂时的荧光强度,F为加入给定浓度的猝灭剂时的荧光强度,KSV为Stern-Volmer猝灭常数,[Q]是猝灭剂的浓度,kq为双分子猝灭速度常数,τ0为荧光寿命. 图3是Stern-Volmer荧光猝灭曲线. 咔唑、9-咔唑乙酸和3溴-9-咔唑乙酸的KSV分别为:698 L·mol-1(R=0.984),704 L·mol-1(R=0.961)和1 063 L·mol-1(R=0.981). 咔唑和9-咔唑乙酸的KSV差别不大,这说明在乙腈溶液中乙酸基对咔唑环的给电子作用影响不大[13]. 3溴-9-咔唑乙酸的KSV较大,说明咔唑环上的溴原子对咔唑环的给电子作用影响较大[14].
李聪等报道EA、竹红菌甲素(HA)和乙素(HB)在环己烷中的三重态寿命分别为5.2、4.5和4.0 μs,与分子的平面性次序(EA>HA>HB)相符合[4]. 线性回归表明三个值在一条直线上(Y=-0.60X+5.77,R2=0.991,图4). HA和HB在乙腈中的τ0值分别为1.50和1.02 ns[12],其直线方程是Y=-0.48X+2.46. 由于结构的相似性,有可能可以用同一种构效关系来描述,认为EA的τ0值与HA和HB的也在这一条直线上(图4),那么EA的τ0值估计为1.98 ns. 由此可以估算出咔唑、9-咔唑乙酸和3溴-9-咔唑乙酸的kq值分别为3.52×1011,3.56×1011和5.37×1011L·mol-1·s-1.
HA和HB在乙腈中与电子给体BNAH间的光致电子转移的kq分别为1.84×1011和1.86×1011L·mol-1·s-1[15],则HA和HB的KSV应分别为276和190 L·mol-1,是EA与三个咔唑化合物间KSV值的18%~40%. HA、HB与电子给体N,N二乙基苯胺(DEA)之间发生电子转移作用的kq分别为0.228×1011和0.234×1011L·mol-1·s-1[12],HA和HB的KSV应分别为34和24 L·mol-1,仅是EA与三个咔唑化合物间KSV的2.2%~4.9%. 这说明EA与三个咔唑化合物之间的光致电子转移速率是比较大的,但是小于甲酰胺在DMSO中动态猝灭EA荧光的KSV(1 545 L·mol-1)[9].
EA与三个咔唑化合物之间的光致电子转移实验是在缺氧的情况下进行的. 根据HA和HB的光致电子转移的研究结果[1]我们推断,在光照条件下EA被激发到激发单重态(1EA),然后部分可以通过系间窜跃(isc)过渡到相对长寿命的三重态(3EA),它们与电子给体咔唑化合物发生电子转移反应,EA生成单电子还原产物半醌负离子自由基,咔唑化合物则生成氧化产物正离子自由基. 以EA与咔唑间的光致电子转移为例,反应式如图5所示.

图3 三个咔唑化合物的荧光猝灭曲线Fig.3 Fluorescence quenching curves of the three carbazole compounds

图4 痂囊腔菌素A、竹红菌甲素和乙素实测的三重态寿命和荧光寿命Fig.4 Triplet state and fluorescence lifetimes of elsinochrome A, hypocrellin A and B

图5 痂囊腔菌素A与咔唑之间的光致电子转移反应Fig.5 Photoinduced electrontransfer between elsinochrome A and carbazole
3 结论
在光照缺氧的条件下,三个咔唑化合物对EA的荧光猝灭作用是由EA与咔唑化合物间的光致电子转移作用引起的. EA是电子受体,咔唑化合物是电子给体. 乙酸基对咔唑环的光致电子转移速率几乎没有影响,但是咔唑环上的溴原子增加了EA的荧光猝灭程度和光致电子转移速率. 与HA和HB比较,EA与咔唑化合物之间的光致电子转移速率较大,这对光动力作用是有利的.
[1]蒋丽金, 何玉英. 竹红菌素类光敏剂的光物理光化学及光生物[J]. 科学通报, 2001, 45(19): 2019-2032.
[2]TARANEH A S, GIANLUCA N, TULLIO C, et al. Quantum yields of singlet-oxygen production by some natural quinoid fungal metabolites and derivatives [J]. Helv Chim Acta, 1992, 75(2): 531-538.
[3]李 聪, 汪汉卿, 陈远藤, 等. 苝醌类化合物的生物合成[J]. 热带作物学报, 1998, 19(增刊): 44-47.
[4]李 聪, 何严萍, 欧灵澄, 等. 痂囊腔菌素A的光物理和光敏化特性[J]. 科学通报, 2006: 646-649.
[5]台 虹, 兰 莉, 宋建新, 等. 痂囊腔菌素A的光敏活性探讨[J]. 现代仪器, 2000, 2: 21-25.
[6]张 俭, 何浩伟, 梁建平, 等. 痂囊腔菌素A的光敏生物活性[J]. 怀化学院学报, 2006, 25(2): 66-67.
[7]LIAO Huiling, CHUNG Kuangren.Cellular toxicity of elsinochrome phytotoxins produced by the pathogenic fungus,Elsino⊇fawcettiicausing citrus scab [J]. New Phytologist, 2008, 177: 239-250.
[8]马 菲, 周 林, 王 薇, 等. 痂囊腔菌素A 与肌红蛋白相互作用的光谱研究[J]. 2011, 31(6): 1601-1605.
[9]WEI G, MA L, YAN M, et al. Fluorescence quenching of Elsinochrome-A in presence of formamide [J]. Asian J Chem, 2009, 21(7): 5299-5304.
[10]张 宏, 张曼华, 沈 涛. 荧光素与咔唑分子内的光致电子转移反应[J]. 中国科学(B), 1997, 27(2): 158-163.
[11]LAO Wenjian, YOU Jinmao, SUN Xuejun, et al. Facile and rapid synthesis of 9H-carbazole-9-carboxylic acids under microwave irradiation [J]. Synth Commun, 2000, 30(19): 3491-3499.
[12]ZHANG Manhua,WENG Min, CHEN Shen, et al. Study of electron transfer interaction between hypocrellin and N,N-diethylaniline by UV-visible, fluorescence, electron spin resonance spectra and time-resolved transient absorption spectra [J]. J Photochem Photobiol A-Chem, 1996, 96: 57-63.
[13]LANDMAN U, LEDWITH A, MARSH D, et al. Structural variations and multiple charge transfer transitions between chloranil and Carbazole derivatives [J]. Macromolecules, 1976, 9(5): 833-839.
[14]胡义镇, 蒋丽金. 竹红菌乙素的光物理性质及外部重原子效应[J]. 科学通报, 1996, 41(3): 229-232.
[15]安静仪, 蒋丽金. 光诱导的竹红菌素和BNAH的电子转移[J]. 科学通报, 1992, 20: 1855-1858.
Photoinducedelectron-transferbetweenelsinochrome
Aandcarbazolechemicals
LAO Wenjian1*, LI Cong2, TAI Hong3, YOU Jinmao4
(1.LanzhouInstituteofChemicalPhysics,ChineseAcademyofSciences,Lanzhou730000,Gansu,China;
2.SchoolofChemicalScienceandTechnology,YunnanUniversity,Kunming650091,Yunnan,China;
3.TheFirstPeople'sHospitalofYunnanProvince,Kunming650032,Yunnan,China;
4.CollegeofChemistryandChemicalEngineering,QufuNormalUniversity,Qufu273165,Shandong,China)
The fluorescence quenching of elsinochrome A (denoted as EA), a natural perylenequinone, by carbazole, carbazol-9-yl-acetic acid, and 3-Br-carbazol-9-yl-acetic acid under anaerobic condition was studied. The fluorescence lifetime of EA in acetonitrile was estimated from the lifetimes of hypocrellin A and hypocrellin B; and the bimolecular quenching rate constants of the three carbazole compounds were calculated accordingly. Results indicate that the three carbazole compounds exhibit no absorbance in the visible light absorbance area of EA. Hence it can be inferred that they quench the fluorescence of EA by photoinduced electron transfer with carbazole compounds as the donors and EA as the acceptor. In the meantime, the quenching constants of the three carbazole compounds are 698, 704 and 1 063 L·mol-1, respectively. Besides, the acetic acid group has almost no effect on photoinduced electron transfer rate, while the substitution of bromine atom on carbazole ring increases the photoinduced electron transfer rate. Moreover, EA in acetonitrile has a fluorescence lifetime of 1.98 ns, and the bimolecular quenching rate constants of the three carbazole compounds are 3.52×1011, 3.56×1011and 5.37×1011L·mol-1·s-1, respectively.
elsinochrome A; carbazole compound; photoinduced electron transfer; fluorescence quenching
2013-12-21.
劳文剑(1968-),男,研究方向为分离分析科学.*
, E-mail: laowjbj@hotmail.com.
O 644.12
A
1008-1011(2014)03-0260-04

