糖精钠与牛血清白蛋白相互作用的荧光光谱研究
李 敏,刘立飞,王志军
(长治学院 化学系,山西 长治 046011)
糖精钠与牛血清白蛋白相互作用的荧光光谱研究
李 敏,刘立飞,王志军*
(长治学院 化学系,山西 长治 046011)
在模拟人体生理条件下,应用荧光和紫外-可见光谱法研究了糖精钠与牛血清白蛋白(BSA)之间的相互作用; 并计算了不同温度下的热力学参数、结合常数和结合位点数. 结果表明,糖精钠对BSA的猝灭机制属于形成复合物的静态猝灭过程;两者之间的作用主要是氢键或范德华力,作用的位点更靠近色氨酸;金属离子对两者的作用具有一定的影响.
糖精钠;牛血清白蛋白;相互作用; 荧光光谱
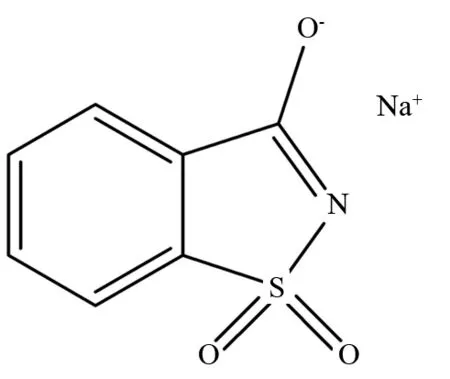
图1 糖精钠的结构式Fig.1 Structure of sodium saccharin
糖精钠又名磺酰苯甲酰亚胺钠,其结构如图1所示. 它的甜度是蔗糖的 500倍,在各种食品生产过程中都很稳定,是最古老的甜味剂[1],被广泛用于食品、饲料添加剂、日化等行业. 血清白蛋白是血浆中含量丰富,且具有载体作用的一种蛋白,能与多数的内源性和外源性化合物结合,在药物药效发挥方面起着重要的作用. 本文作者在模拟人体生理条件下,运用荧光、紫外-可见光谱法研究糖精钠与牛血清白蛋白(BSA)作用的光谱特征,为从分子水平上了解两者的作用机制提供重要信息.
1 实验部分
1.1 仪器与试剂
U-2910型双光束紫外分光光度计(日本日立);F-4600荧光分光光度计(日本日立); HWS26型电热恒温水浴锅(上海恒一科技有限公司);FA-2004B电子分析天平(上海越平科学仪器有限公司);pHS-3B 数字酸度计(上海雷磁仪器厂);可调式移液器;BSA(北京奥博星生物技术有限公司);糖精钠(天津市大茂化学试剂厂);硫酸镍、硫酸镉、硫酸锌、硝酸钴、硫酸铜(天津市风船化学试剂科技有限公司);所用试剂均为分析纯,实验用水为二次蒸馏水.
1.2 实验方法
1.2.1 荧光光谱测定
准确移取2 mL 0.50 μmol·L-1的Tris(pH=7.4)缓冲的BSA溶液于比色池中,用可调式移液器进行荧光滴定,每次加入10 μL 10 μmol·L-1的糖精钠水溶液,混合均匀;固定激发波长为290 nm,荧光发射狭缝宽度为5 nm,激发狭缝宽度为2.5 nm,记录300~500 nm波长范围内的发射光谱.
1.2.2 同步荧光光谱测定
固定BSA溶液的浓度,依次滴加一定量的糖精钠溶液,同步扫描Δλ分别为15和60 nm的荧光激发光谱.
2 结果与讨论
2.1 糖精钠和BSA作用的荧光光谱
由于BSA分子中存在着酪氨酸、色氨酸等能够发射荧光的芳香性氨基酸残基,所以它是一种典型的内源荧光物. 当用波长为290 nm的光进行激发,BSA分子中色氨酸残基的荧光发射峰位于340 nm附近. 从图2可知,随着糖精钠浓度的增加,BSA的荧光强度呈规律性降低,说明糖精钠对BSA的荧光有明显的猝灭作用.
2.2 猝灭机制的讨论和结合常数的测定
荧光猝灭由于猝灭机制的不同可分为静态猝灭和动态猝灭[2]两种,其中动态猝灭时,猝灭常数会随温度的升高而增大;静态猝灭则正好相反. 糖精钠对BSA荧光猝灭作用类型可根据Stern-Volmer方程[3-6]进行判断.
方程式中F和F0分别代表加入和不加糖精钠时BSA的荧光强度;Q为猝灭剂糖精钠的浓度;Ksv和Kq分别为动态猝灭常数和动态猝灭速率常数;τ0为荧光分子在无猝灭剂存在时的平均寿命(生物大分子荧光寿命平均约为10-8s[7-9]).
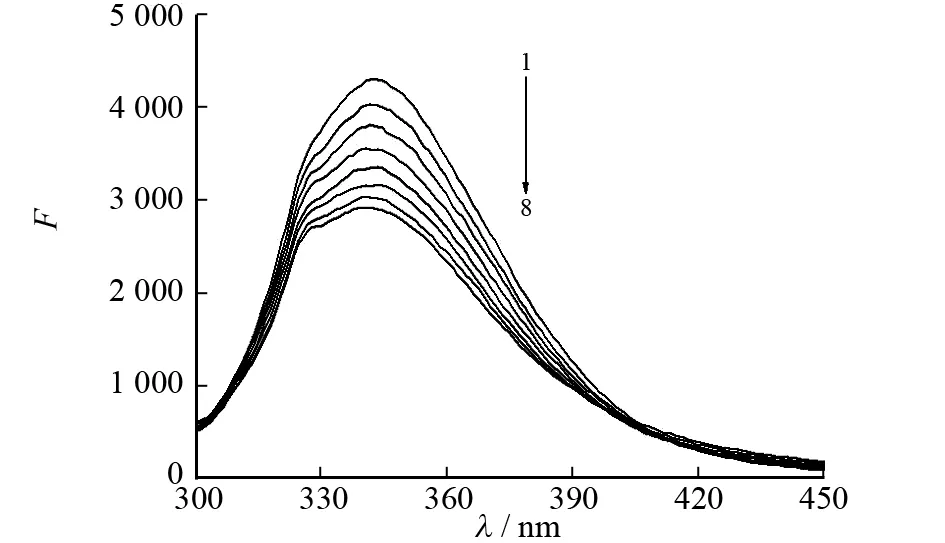
c(BSA)=0.50 μmol·L-1,λex=290 nm c(糖精钠)=0, 0.05, 0.10, 0.15, 0.20, 0.25, 0.30, 0.35 μmol·L-1
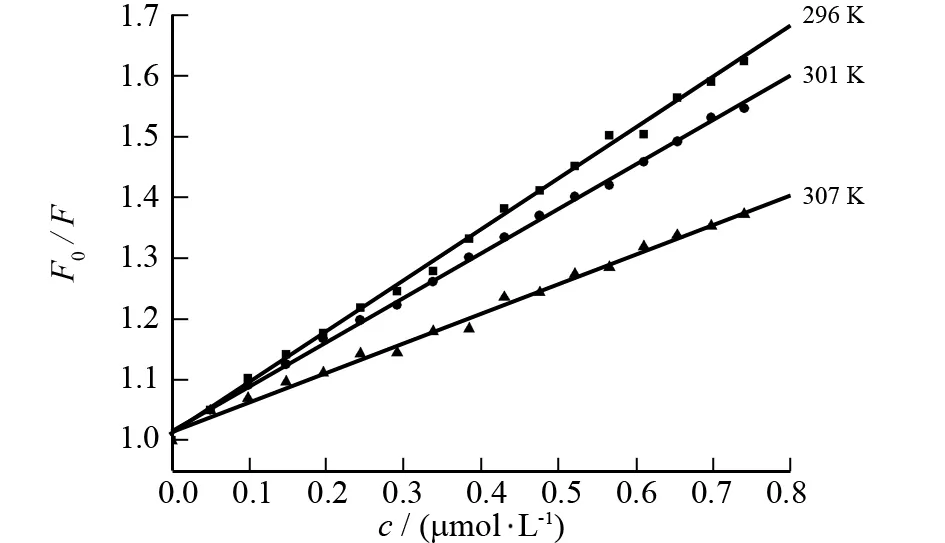
图3 不同温度下的Stern-Volmer曲线Fig.3 Stern-Volmer curves at different temperatures
根据不同温度下的荧光猝灭图(图3)计算出296,301和307 K三个温度下的Ksv和Kq,数据列于表1. 从表中可以看出,Ksv随温度的升高而减小,并且Kq值都明显大于生物大分子最大扩散碰撞猝灭常数2.0×1010L·mol-1·s-1,从而可推断出糖精钠对BSA的荧光猝灭是静态猝灭过程.
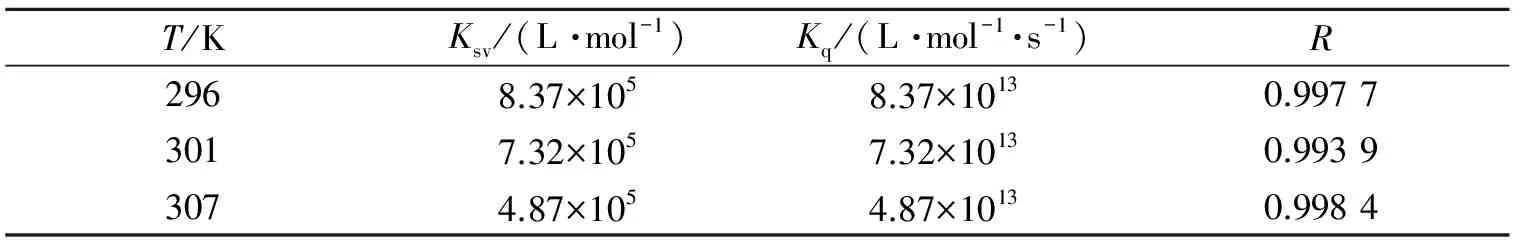
表1 不同温度下糖精钠与BSA结合的Ksv和KqTable 1 Ksv and Kq of saccharin sodium with BSA at different temperatures
2.3 结合位点数和结合常数
在静态猝灭过程中,猝灭剂与物质荧光强度的关系常用公式(2)表示[10]:

用lg[(F0-F)/F]对lgQ作图,可求得对应直线的斜率和截距,进一步计算得到结合位点数n和结合常数Ka. 表2列出了不同温度下糖精钠与BSA的结合常数和结合位点数,结果表明糖精钠与BSA的某一位点通过某种较强的作用形成了复合物.
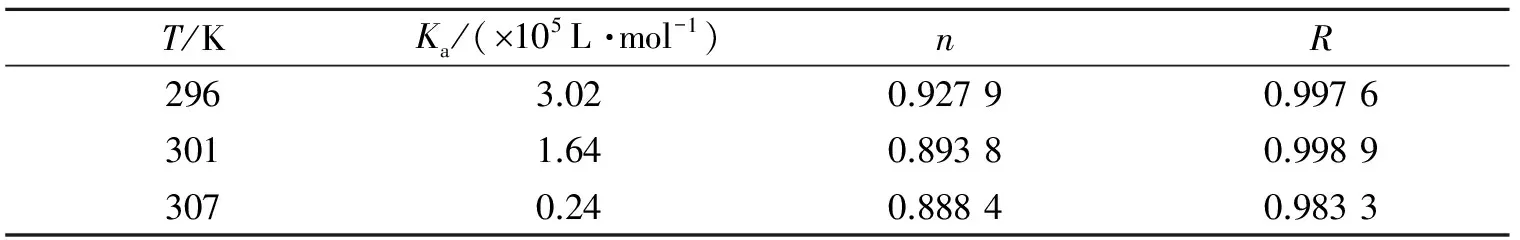
表2 不同温度下糖精钠和BSA作用的结合位点数n和结合常数KaTable 2 Binding binding-site numbers and constants of saccharin sodium with BSA at different temperatures
2.4 热力学参数和作用类型
生物大分子与其他小分子化合物之间的作用主要包括范德华力、氢键、疏水作用以及静电引力等. 作用类型可根据Ross理论[11]中提出的反应热力学参数ΔH、ΔS、ΔG的变化来确定,并且它们之间满足以下关系式. 其中,当温度在一定范围内变化时,反应焓变ΔH可视为定值.
由表3可以看出,ΔG<0,表明BSA与糖精钠的作用是自发进行的;ΔH<0,ΔS<0,表明两者之间的作用力主要是氢键或范德华力.
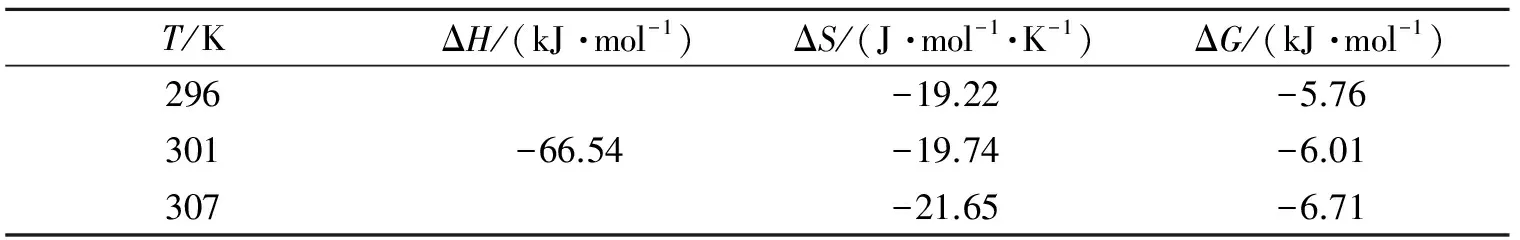
表3 BSA与糖精钠作用的热力学参数Table 3 Thermodynamic parameters of interaction between BSA and sodium saccharin
2.5 糖精钠对BSA构象的影响
同步荧光光谱可以提供荧光发射基团附近微环境的变化信息. BSA在Δλ=60 nm和Δλ=15 nm的同步荧光分别对应于色氨酸残基和酪氨酸残基的特征光谱,由此可以通过它们最大发射波长和荧光强度的改变来判断BSA构象的变化.
通过BSA的同步荧光光谱图4可知,随着糖精钠浓度的增加,色氨酸残基和酪氨酸残基的最大发射波长没有明显变化,但两者的荧光强度却都有降低,并且色氨酸残基荧光强度降低得更为明显. 这表明糖精钠与BSA的作用位点更靠近色氨酸残基,原因可能是加入的糖精钠使得色氨酸残基所在的疏水腔部分打开,色氨酸残基有所外露,伸向水相,导致荧光强度降低.
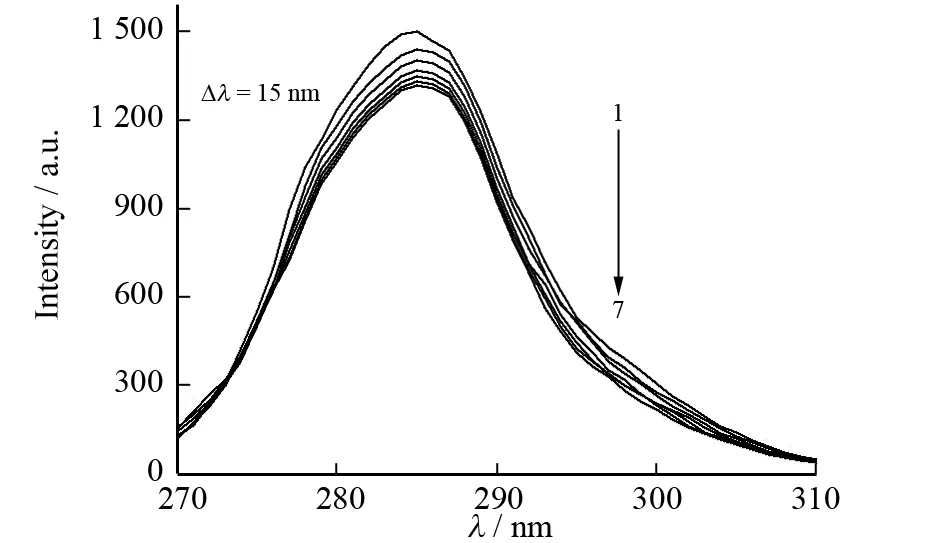
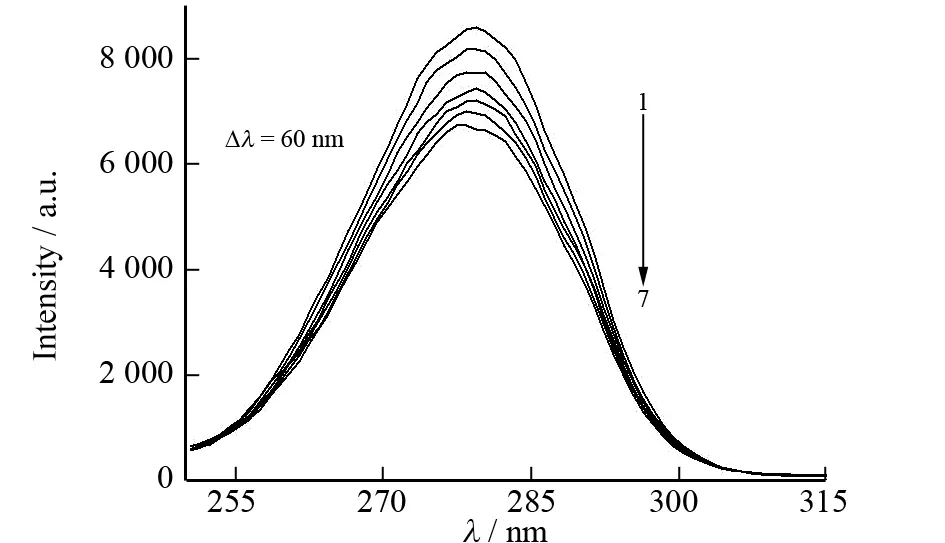
c(BSA)=0.50 μmol·L-1;1→7: c(糖精钠)=0、0.05、0.10、0.15、0.20、0.25、0.30 μmol·L-1
2.6 结合距离计算
由Förster偶极-偶极无辐射能量转移理论[12-13]可知,当供体的荧光发射光谱和受体的吸收光谱发生重叠,且供体与受体足够接近,即两者之间的最大距离不超过7 nm,会产生非辐射能量转移,最终导致荧光体的荧光猝灭. 据此理论,非辐射能量转移效率E、临界能量转移距离R0和供体与受体之间的结合距离r间满足下列关系:
式中F和F0为不同情况下供体的荧光发射强度;K2为取向因子,一般取值为2/3;N为折射指数,值为1.336;Ф为供体的荧光量子产率,取0.118[14];J为供体发射光谱与受体吸收光谱的重叠积分;F(λ)和ε(λ)分别为在波长λ处供体的荧光强度和受体的摩尔吸光系数.
在296 K下,BSA的荧光光谱和糖精钠的吸收光谱如图5所示. 将图5中光谱重叠部分积分,可求得J=8.14×10-15cm3·mol-1·L,计算得到能量转移效率E=0.29和结合距离r=2.75 nm,据此推断糖精钠和BSA之间发生了非辐射能量转移.
2.7 不同的金属离子对猝灭的影响
金属离子参与了生命体的许多重要的生理活动. 本文初步研究了五种过渡金属离子Zn2+、Co2+、Ni2+、Cu2+、Cd2+对糖精钠与BSA猝灭的影响. 从图6中可以看出在这些离子存在的条件下糖精钠对BSA的荧光同样具有猝灭作用,并且五种离子都对体系具有协同猝灭的作用.
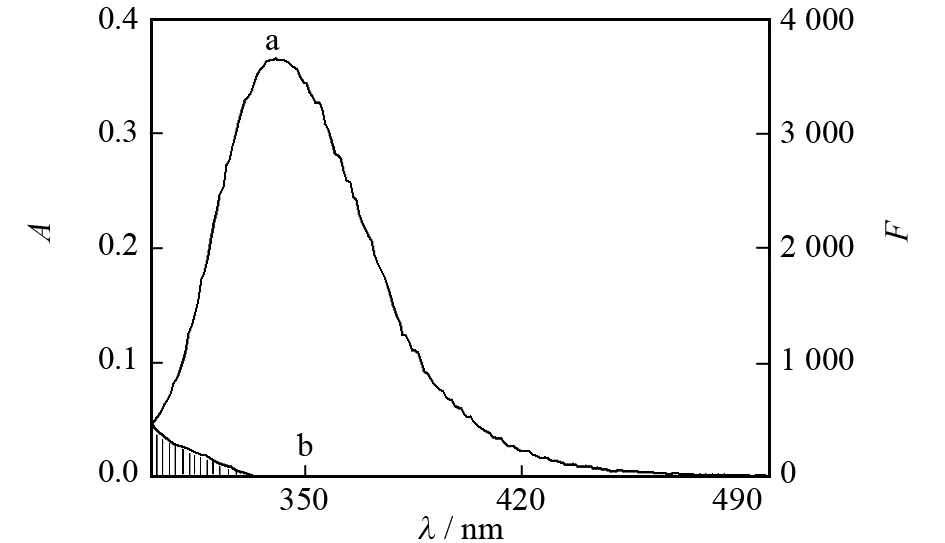
图5 BSA荧光光谱(a)和糖精钠吸收光谱(b)的重叠光谱图Fig.5 Overlap of the fluorescence spectrum of BSA and the absorption spectrum of saccharin sodium
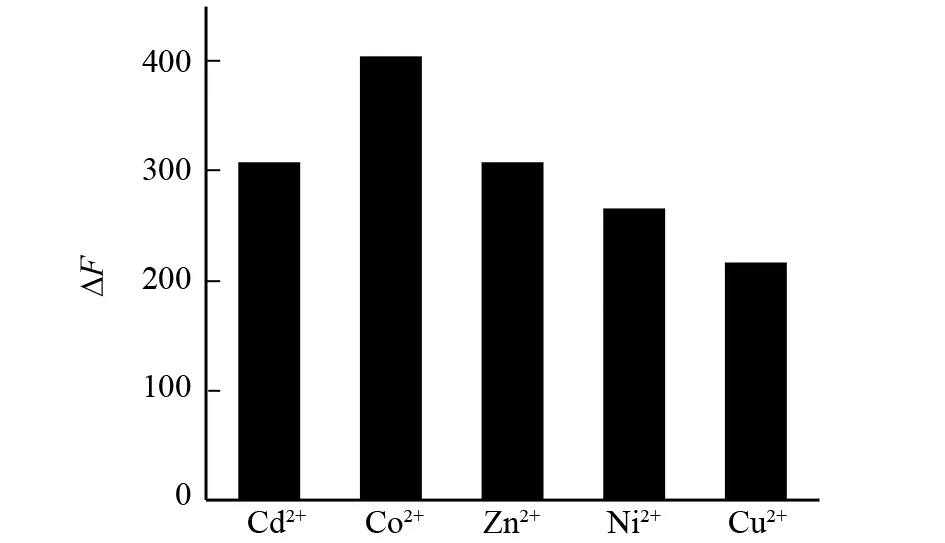
图6 金属离子对糖精钠与BSA荧光猝灭的影响Fig.6 The interaction of saccharin sodium and BSA in the presence of different metal ions
3 结论
糖精钠对BSA的荧光猝灭属于由氢键或范德华力作用形成复合物的静态猝灭过程;在296,301和307 K糖精钠与BSA之间的结合常数分别为3.02×105、1.64×105和2.4×104L·mol-1,结合位点数分别为0.927 9、0.893 8和0.888 4. 同步荧光光谱显示两者的结合位点更接近于色氨酸;同时金属离子的存在对两者的作用产生一定的影响.
[1]张卫民. 中国甜味剂的现状[J]. 监督与选择, 2004, 24(9): 64-67.
[2]许金钩, 王尊本. 荧光分析法[M]. 北京: 科学出版社, 2006: 64-72.
[3]杨 频, 高 飞. 生物无机化学原理[M]. 北京: 科学出版社, 2002: 495-496.
[4]张志恒, 李彩瑞, 马晶军, 等. 荧光法研究木犀草素与人血清白蛋白的相互作用[J]. 光谱与光谱分析, 2008, 28(5): 1135-1139.
[5]赫春香, 赵 静, 何长涛. 紫杉醇与牛血清白蛋白的相互作用研究[J]. 辽宁师范大学学报:自然科学版, 2010, 33(4): 465-468.
[6]尚永辉, 孙家娟, 刘 静. 水飞蓟素与牛血清白蛋白相互作用的荧光光谱研究[J]. 化学研究, 2011, 22(2): 1-3.
[7]WANG Yanqing, ZHANG Hongmei, ZHANG Gencheng, et al. Spectroscopic studies on the interaction between silicotungstic acid and bovine serum albumin [J]. J Pharmaceut Biomed, 2007, 43(5): 1869-1875.
[8]XIAO Jianbo, CHEN Jingwen, CAO Hui, et al. Study of the interaction between baicalin and bovine serum albumin by multi-spectroscopic method [J]. J Photoch Photobio A, 2007, 191(2): 222-227.
[9]JIANG Chongqiu, GAO Mingxia, HE Jixiang. Study of the interaction between terazosin and serum albumin synchronous fluorescence setermination of terazosin [J]. Anal Chim Acta, 2002, 452(2): 185-189.
[10]LI Jingci, LI Ning, WU Qiuhua, et al. Study on the interaction between clozapine and bovine serum albumin [J]. J Mol Struct, 2007, 833(1): 184-188.
[11]FÖRSTER T, SINANOGLU O. Modern quantum chemistry [M]. New York:Academic Press, 1996.
[12]倪永年, 刘根兰, 苏少景. 异烟肼与牛血清白蛋白相互作用的机理[J]. 南昌大学学报, 2008, 32(2): 126-129.
[13]王志军, 梁瑞瑞, 雷海英. 肌醇与牛血清白蛋白相互作用的荧光光谱研究[J]. 化学研究, 2012, 23(1): 64-66.
[14]孙艳涛, 张玉璞, 毕淑云, 等. 牛血清白蛋白与保泰松和布洛芬相互作用的荧光光谱研究[J]. 高等学校化学学报, 2009, 30(6): 1095-1100.
Studyofinteractionbetweensaccharinsodiumandbovineserum
albuminbyfluorescencespectrometry
LI Min, LIU Lifei, WANG Zhijun*
(DepartmentofChemistry,ChangzhiInstitute,Changzhi046011,Shanxi,China)
The interaction of saccharin sodium with bovine serum albumin (BSA) under simulated physiological conditions was investigated by fluorescence spectrometry and ultraviolet-visible light absorption spectrometry, and the binding constants, number of binding sites and thermodynamic parameters under different temperature were calculated. Results show that the quenching of BSA by saccharin sodium is a static quenching procedure involving complex formation. The interaction between BSA and saccharin sodium is dominated by Van der Waals forces or hydrogen bond, and the binding site of saccharin sodium and BSA is close to tryptophan residue. In addition, metal ions influence the interaction of saccharin sodium and BSA to some extent.
saccharin sodium; bovine serum albumin; interaction; fluorescence spectrometry
2013-11-23.
国家自然科学基金(20121024),山西省高校科技开发项目(2013159)和长治学院校级资助项目(201222).
李 敏(1978-),女,讲师,主要从事生物无机化学, E-mail:czxylm@126.com.*
, E-mail:czxywzj@sxu.edu.cn.
O 657.39
A
1008-1011(2014)03-0264-05

