异丙酚对大鼠脑损伤后脑组织MMP-9表达的影响
孙正清 盖成林 苏芳 杨天德
·论著·
异丙酚对大鼠脑损伤后脑组织MMP-9表达的影响
孙正清 盖成林 苏芳 杨天德
目的观察异丙酚对大鼠脑损伤后脑组织MMP-9表达的影响,探讨异丙酚的脑保护作用机制。方法91只雄性Wistar 大鼠随机分为假手术组、伤后0.9%氯化钠溶液组、伤后异丙酚治疗组。异丙酚给药量为临床麻醉相关剂量(100 mg/kg):冷冻伤后15 min腹腔注射异丙酚50 mg/kg,1次/2 h后再次追加相同剂量。采用颅骨外脑冷冻伤法,运用液氮冷冻器局部冷冻大鼠左侧顶部脑组织60 s制作冷冻伤即脑损伤模型。分别于冷冻伤后2、6、24 h处死并收集脑组织标本,采用干湿重法测定脑水含量,RT-PCR法检测MMP-9基因的mRNA表达,免疫组化法测定MMP-9的蛋白表达。结果伤后0.9%氯化钠溶液组在伤后各时点伤侧脑组织含水量均显著高于假手术组(P<0.01),脑冷冻伤后24 h最高;在伤后6 h、24 h,伤后异丙酚治疗组脑组织含水量与0.9%氯化钠溶液组比较均显著降低,差异有统计学意义(P<0.05或<0.01)。假手术组脑组织MMP-9 mRNA水平表达很低,脑冷冻伤后2 h,0.9%氯化钠溶液组MMP-9 mRNA水平较假手术组明显升高,6 h最高,24 h仍保持在较高水(P<0.01);在伤后6 h及24 h,伤后异丙酚治疗组脑组织MMP-9 mRNA水平与0.9%氯化钠溶液组比较均显著降低,差异有统计学意义(P<0.05或<0.01)。假手术组脑组织MMP-9蛋白未见明显阳性表达,脑冷冻伤后2 h,0.9%氯化钠溶液组MMP-9蛋白阳性表达水平较假手术组明显升高,6 h最高,24 h仍保持在较高水平(P<0.01);在伤后6 h及24 h,伤后异丙酚治疗组脑组织MMP-9 蛋白表达水平与0.9%氯化钠溶液组比较均显著降低,差异有统计学意义(P<0.05或<0.01)。结论临床麻醉相关剂量的异丙酚可以减轻脑损伤后脑水肿。此种作用可能与异丙酚抑制MMP-9的表达有关。
异丙酚;脑创伤;基质金属蛋白酶-9;脑水肿
脑水肿是颅脑损伤最常见、最严重的继发损伤之一,也是颅脑损伤患者致死致残的重要原因。创伤性脑水肿是一种混合型脑水肿。由于血管源性脑水肿在创伤性脑水肿的形成、颅内压增高及继发性脑损害中的重要作用,以保护颅脑损伤后血脑屏障,减轻血管源性脑水肿的救治措施成为备受关注的课题。近期的研究显示全麻药异丙酚可以减轻创伤性脑水肿[1],降低缺血性脑损伤后血脑屏障通透性,促进血脑屏障功能的恢复[2]。但异丙酚通过何种机制来达到此种脑保护效应研究尚少。近期,基质金属蛋白酶(MMPs)在血管源性脑水肿的研究中受到广泛关注。脑损伤后MMP-9表达增高,参与血脑屏障破坏及继发性脑损害[3,4]。本研究我们采用脑冷冻伤这一经典的血管源性脑水肿模型,以异丙酚腹腔注射为干预,观察异丙酚对脑损伤后MMP9的影响,探讨异丙酚的创伤性脑保护机制。
1 材料与方法
1.1 实验动物及分组 清洁级雄性 Wistar 大鼠91 只,体重230 ~250 g,由第三军医大学大坪野战外研所提供。随机分为假手术组:只切开头皮而未行冷冻伤处理;伤后0.9%氯化钠溶液组:冷冻伤后15 min腹腔注射0.9%氯化钠溶液5 ml/kg,0.5 h后再次追加相同剂量,根据观察时间不同,分为3个亚组,即冷冻伤后2、6、24 h组;伤后异丙酚治疗组:冷冻伤后15 min腹腔注射异丙酚50 mg/kg,0.5 h后再次追加相同剂量,也分为2、6、24 h 3个亚组。其中49只用于测量脑组织含水量及检测脑组织MMP-9 mRNA的表达(假手术组及每个亚组均含7只),42只用于MMP-9免疫组化检测(假手术组及每个亚组均含6只)。
1.2 动物模型制备 参照文献[5]的方法制备动物模型。1%戊巴比妥钠(45 mg/kg)腹腔麻醉大鼠,待角膜及翻正反射消失后,俯卧位固定于立体定位仪上,碘氟消毒头部皮肤,沿正中切开头皮,分离骨膜,暴露左顶颅骨。将内盛丙酮的冷冻器直接浸泡入液氮中预冷,使冷冻器温度为液氮温度(-196℃)。将直径5 mm冷冻头垂直置于矢状缝左旁开5.5mm为圆心的骨面上(冷冻头前缘至冠状缝),冷冻60 s,造成左顶叶脑皮层的冷冻伤。手术室温度为25℃,术中电灯泡照射维持肛温为37~37.5℃。术毕自由进食水。
1.3 脑水含量测定 采用干湿重法。在各个时间点,大鼠断头取脑,去除小脑及脑干,在冻伤灶周围(距冻伤灶3 mm内的左半球后1/2部分)取大小约110 mg脑皮质全层组织块(包括灰质和白质),以滤纸吸去表面液体,在5 min之内用分析天平称量左右脑组织湿重。之后将其放入52℃的医用电烤箱72 h,再分别称量脑组织干重(2次测量之差小于0.2 mg)。按Elliott公式计算脑组织含水量,脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.4 RT-PCR检测MMP-9 mRNA的表达 在各个时间点,大鼠断头取脑,在生理盐水冰面上迅速取冻伤灶周围(距冻伤灶3 mm内的半球前1/2右部分)脑组织,置入液氮中保存待用。取冻伤灶周围组织50 mg,按RNAex Reagent 说明书提取总RNA。按试剂盒说明书进行cDNA第一链的合成(逆转录,RT),然后进行PCR扩增。 PCR引物由上海博亚生物技术有限公司设计合成。MMP-9引物序列:上游引物:5’-ACTTTGTAGGGTCGGTTCTG3’下游引物:5’-CCTAATGCCCAGTAGAGAGC-3’,PCR产物344 bp。内参照GAPDH引物序列:上游引物:5’-CTTCACCACCATGGAGAAGGC-3’,下游引物:5’-GGCATGGACTGTGGTCATGAG-3’,PCR产物237 bp。MMP9引物浓度为10 pmol/μl,内参照GAPDH引物浓度为50 pmol/μl。
反应总体系为20 μl,5×PCR Buffer 5 μl,TaKaRa Ex TaqTMHS 0.125 μl,上游特异性PCR引物1.0 μl,下游特异性PCR引物1.0 μl,内参照GAPDH上游引物0.2 μl,内参照下游引物0.2 μl,cDNA 2 μl,加灭菌超纯水至20 μl。MMP-9扩增程序:94℃ 2 min 1次,94℃ 30 s,55.5℃ 30 s,72℃ 1 min,30循环;72℃ 5 min终末延伸。
PCR产物分析:将PCR产物在1.8%琼脂糖凝胶上电泳,样品加样量均为6 μl(PCR产物5 μl+loading buffer 1 μl),在0.5×TBE中100V电泳40 min,经凝胶成象仪处理成像,将图像输入图像分析软件系统(Quantity One-4.4.0,BIO-RAD),计算出PCR产物密度含量,用目的基因扩增量与内参照基因扩增量的比值来表示所要检测基因的相对表达量。基因的相对表达量=目的基因光密度值/内参照基因光密度值×100%。
1.5 免疫组化技术检测MMP-9蛋白水平的表达 冷冻伤后各相应时相点大鼠经1%戊巴比妥钠(60 mg/kg)深麻醉,剪开胸前臂,暴露心脏,经左室插入静脉针头直达主动脉,快速灌注肝素生理盐水,剪开右心耳放血,待流出液体清亮后(约需0.9%氯化钠溶液200 ml),再以4%多聚甲醛溶液灌注45 min,约300 ml固定。迅即断头取脑,以冻伤灶为中心切取冠状脑组织块,4%多聚甲醛溶液4℃固定24 h,常规石蜡包埋。使用时将石蜡包埋的脑组织连续冠状切片(厚5 μm),隔5取1,参照SABC试剂盒说明行MMP-9免疫组化检测。阴性对照片用PBS代替一抗,阳性对照用试剂盒内附阳性对照片。
镜下观察胞浆有棕黄色颗粒者为阳性细胞。采用医学图像分析软件(Leica Qwin,德国),进行分析。每组随机选择6张免疫组化染色片(免疫组化染色强度大致一致),每张切片随机选取6个高倍视野,用图像分析软件对染色结果进行灰度分析,以平均灰度值代表蛋白表达水平:蛋白表达强则灰度值低,反之则高。

2 结果
2.1 脑组织含水量的测定结果 在伤后2、6、24 h,伤后0.9%氯化钠溶液治疗组伤侧脑组织含水量均高于假手术组,差异有统计学意义(P<0.01),24 h最高;在伤后6、24 h,伤后异丙酚治疗组脑组织含水量与伤后0.9氯化钠溶液治疗组比较均显著降低,差异有统计学意义(P<0.05或<0.01)。见表1。
表1脑组织含水量

组别脑组织含水量假手术组78.06±0.53伤后0.9%氯化钠溶液治疗组 2h79.04±0.58# 6h80.12±0.71# 24h81.19±0.90#伤后异丙酚治疗组 2h78.79±0.53* 6h79.24±0.52#△ 24h80.05±0.82☆
注:与假手术组比较,*P<0.05,#P<0.01;与伤后0.9%氯化钠溶液组比较,△P<0.05,☆P<0.01
2.2 脑组织MMP-9 mRNA的表达 经紫外分光光度计测定提取的总RNAOD260 /OD280的值为1.7~2.0,说明提取的总RNA纯度良好。利用选定的逆转录条件和设定的二对引物对49份标本进行检测,分别得到MMP-9 344 bp和GAPDH 237 bp的扩增产物。内参照GAPDH在237 bp处亮度均衡,在各反应系中扩增结果基本一致,证实PCR反应基本真实地反应了MMP-9mRNA在脑组织中的表达。
3组光密度的比值结果,假手术组脑组织MMP-9 mRNA水平表达很低,脑冷冻伤后2 h,0.9%氯化钠溶液组MMP-9 mRNA 水平较假手术组明显升高,6 h最高,24 h仍保持在较高水平(P<0.01);在伤后6 h及24 h,伤后异丙酚治疗组脑组织MMP-9 mRNA水平与0.9%氯化钠溶液组比较均降低,差异有统计学意义(P<0.01)。见表2、图1。
表2伤侧脑组织MMP-9mRNA表达
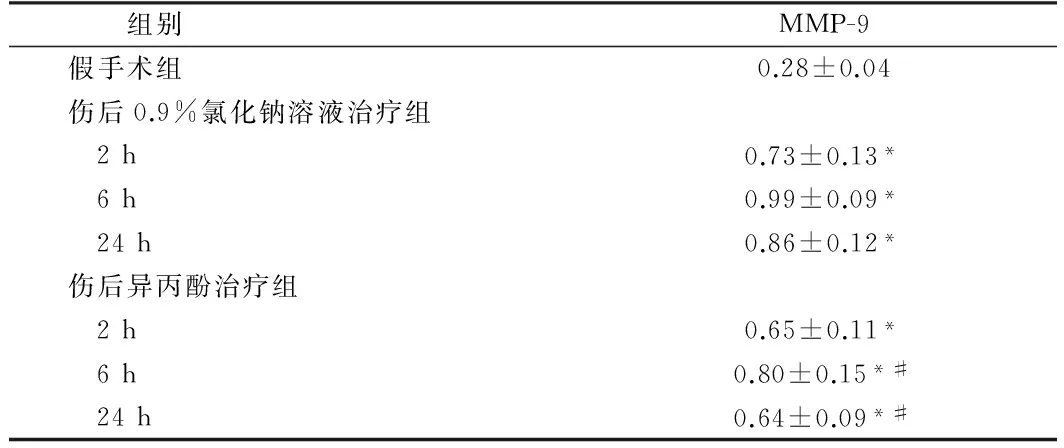
组别MMP-9假手术组0.28±0.04伤后0.9%氯化钠溶液治疗组 2h0.73±0.13* 6h0.99±0.09* 24h0.86±0.12*伤后异丙酚治疗组 2h0.65±0.11* 6h0.80±0.15*# 24h0.64±0.09*#
注:与假手术组比较,*P<0.01;与伤后0.9%氯化钠溶液组比较,#P<0.01

图1 脑冷冻伤后3组MMP-9 mRNA表达情况
2.3 MMP-9蛋白表达结果 假手术组脑组织MMP-9蛋白未见明显阳性表达,脑冷冻伤后2 h,0.9%氯化钠溶液组MMP-9蛋白阳性表达水平(蛋白表达强则灰度值低,反之则高)较假手术组明显升高,6 h最高,24 h仍保持在较高水平(P<0.01);阳性细胞的主要来源于冻伤灶周围的神经元、胶质细胞、微血管内皮细胞,冻伤中心区无表达。在伤后6 h及24 h,伤后异丙酚治疗组脑组织MMP-9蛋白表达水平与0.9%氯化钠溶液组比较均显著降低,差异有统计学意义(P<0.05或0.01)。见表3、图2~7。
表3伤侧脑组织MMP-9蛋白表达灰度值

组别MMP-9灰度值假手术组243.93±4.65伤后0.9%氯化钠溶液治疗组 2h156.45±4.14* 6h145.04±4.04* 24h152.25±4.40*伤后异丙酚治疗组 2h158.90±3.35* 6h151.77±5.09*# 24h158.85±2.83*△
注:与假手术组比较,*P<0.01;与伤后0.9%氯化钠溶液组比较,#P<0.05,△P< 0.01

图2 假手术组脑组织MMP-9(免疫组化×400) 图3 脑冷冻伤后2 h 0.9%氯化钠溶液组MMP-9(免疫组化×400)
3 讨论
创伤性脑水肿是一种混合性脑水肿,其病理生理机制一直处于探索之中[6]。其中血脑屏障受损及血管源性脑水肿的发生机制更是备受关注。颅脑损伤时,血脑屏障受损,使其在形态和功能两方面都发生改变,通透性改变是血脑屏障功能障碍的最重要表现。血脑屏障破坏后血液中毒性物质进入脑内,离子平衡失调引起脑水肿,可导致颅内压升高引起脑疝,往往是病人死亡的主要原因。紧密连接的开放、小泡转运的增强、内皮细胞的损伤、基底膜的破坏及星形神经胶质细胞的损伤都可引起BBB通透性增加,导致血管源性脑水肿。
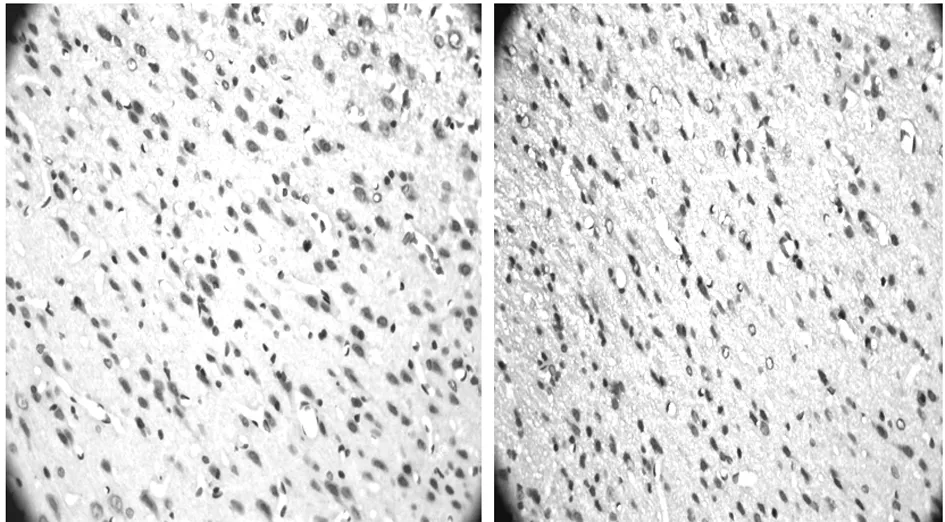
图4 脑冷冻伤后6 h伤后0.9%氯化钠溶液组MMP-9(免疫组化×400) 图5 脑冷冻伤后24 h伤后0.9%氯化钠溶液组MMP-9(免疫组化×400)

图6 脑冷冻伤后6 h伤后异丙酚治疗组MMP-9(免疫组化×400) 图7 脑冷冻伤后24 h伤后异丙酚治疗组MMP-9(免疫组化×400)
近期,基质金属蛋白酶(MMPs)在血管源性脑水肿的研究中受到广泛关注。MMPs是一组降解细胞外基质蛋白的锌依赖蛋白酶,其表达和活性的升高可引起BBB通透性增加。研究显示MMPs主要是MMP-9在颅脑损伤后表达增高,参与BBB的破坏及继发性脑损害[3,4]。在脑冷冻伤模型,使用基质金属蛋白酶非特异性抑制剂MMI270,可明显减轻血脑屏障的通透性、脑水肿及继发性损害[7]。在本实验中,我们应用RT-PCR技术从基因水平考察MMP-9的表达,应用免疫组化从蛋白水平考察MMP-9的表达。实验结果显示,脑冷冻伤后2 h脑组织MMP-9表达显著升高,24 h仍保持在较高水平。与Morita-Fujimura等[8]应用酶谱法测定了小鼠冷冻伤模型MMP-9蛋白的表达情况相似。MMP-9阳性表达主要见于冻伤灶周围神经元、胶质细胞、血管内皮细胞、中性粒细胞等,冻伤中心坏死区无表达。与文献报道关于MMP-9阳性细胞分布[9]基本一致,说明冻伤灶周围残存的神经元、胶质细胞等被激活,表达并分泌MMP-9,介导血脑屏障基底膜及神经组织的损伤。至于脑冻伤后涉及MMP-9活性表达的机制还不清楚。Morita-Fujimura等[8]研究显示冷冻伤后活性氧的生成可促使MMP-9诱导并激活,进而加重内皮细胞的损伤和血管源性脑水肿的发展。应用SOD1转基因技术或基因敲除技术在其他的脑损伤模型也证实了活性氧可诱导并激活MMP-9,进而破坏BBB。由此可见,活性氧自由基不仅直接损害内皮细胞,还可以通过诱导并激活MMP-9,降解ECM,致使BBB完整性被破坏。MMP-9基因启动子区具有AP-1(激动剂激活蛋白)的结合位点,脑冷冻伤时AP-1结合活性的增高可诱导MMP-9的表达,某些及早基因c-fos和c-jun可作用于AP-1结合位点。脑损伤后活性氧生成诱导了c-fos和c-jun的表达,后者激活了MMP-9的AP-1区,致使MMP-9表达增加。结合以往的资料,我们认为脑冷冻伤后MMP-9的诱导及激活是BBB损坏、血管源性脑水肿形成发展的重要机制之一。
在伤后6 h及24 h,伤后异丙酚治疗组脑组织MMP-9 mRNA及蛋白表达水平与0.9%氯化钠溶液组比较均显著降低。提示异丙酚具有抑制MMP-9基因表达的作用。而且与对脑水的影响基本平行,说明异丙酚可能通过抑制MMP-9基因表达来发挥对脑损伤后BBB的保护作用,减轻创伤后脑水肿。研究表明,异丙酚可抑制癌症患者MMP-9的表达[10],可抑制脑缺血再灌注时脑组织MMP-9的表达上调来发挥脑保护作用[2]。在脑损伤时,增高的ROS可诱导MMP-9的转录与表达,异丙酚具有抗过氧化损伤的作用[11],异丙酚可能通过清除ROS 来介导对MMP-9的抑制作用。但具体的机制还需要进一步研究。
1 李岩,陈国忠,刘韧等.异丙酚减轻大鼠创伤性脑水肿及相关机制的研究.医学综述,2009,15:1410-1412.
2 纪风涛,蓸铭辉,梁建军,等.异丙酚预先给药对大鼠局灶性脑缺血再灌注时脑组织p-JNK、MMP-9和AQP-4表达的影响.中华麻醉学杂志,2010,30:1357-1360.
3 Hayashi T,Kaneko Y,Yu S,et al.Quantitative analyses of matrix metalloproteinase activity after traumatic brain injury in adult rats.Brain Res,2009,1280:172-177.
4 Higashida T,Kreipke CW,Rafols JA,et al.The role of hypoxia-inducible factor-1α,aquaporin-4,and matrix metalloproteinase-9 in blood-brain barrier disruption and brain edema after traumatic brain injury.J Neurosurg,2011,114:92-101.
5 孙正清,杨天德,王显旺,等.大鼠冷冻伤血管源性脑水肿模型的建立与评价.四川医学,2005,26:827-829.
6 Marmarou A.Pathophysiology of traumatic brain edema:current concepts.Acta Neurochir Suppl,2003,86:7-10.
7 Kawai N,Kawanishi M,Okada M,et al.Treatment of cold injury-induced brain edema with a nonspecific matrix metalloproteinase inhibitor MMI270 in rats.J Neurotrauma,2003,20:649-657.
8 Morita-Fujimura Y,Fujimura M,Gasche Y,et al.Overexpression of copper and zinc superoxide dismutase in transgenic mice prevents the induction and activation of matrix metalloproteinases after cold injury-induced brain trauma.J Cereb Blood Flow Metab,2000,20:130-138.
9 Rosenberg GA,Cunningham LA,Wallace J,et al.Immunohistochemistry of matrix metalloproteinases in reperfusion injury to rat brain:activation of MMP-9 linked to stromelysin-1 and microglia in cell cultures.Brain Res,2001,893:104-112.
10 Deegan CA,Murray D,Doran P,et al.Anesthetic technique and the cytokine and matrix metalloproteinase response to primary breast cancer surgery.Reg Anesth Pain Med,2010,35:490-495.
11 Yamaguchi S,Hamaguchi S,Mishio M,et al.Propofol prevents lipid peroxidation following transient forebrain ischemia in gerbils.Can J Anaesth,2000,47:1025-1030.
EffectofpropofolonneuronalMMP-9expressionafterbraininjuryinrats
SUNZhengqing,GAIChenglin,SUFang,etal.DepartmentofAnesthesiology,No.230HospitalofPLA,Heilongjiang,Dandong118000,China
ObjectiveTo observe the effect of propofol on neuronal MMP-9 expression after brain injury in rats and to explore its action mechanisms in neuroprotective effects.MethodsNinety-one health male Wistar rats were randomly divided into sham-operation group,saline group(saline treatment after brain injury),propofol group(propofol treatment after brain injury).Propofol dose was clinical anesthesia relevant dose(100mg/kg),which was injected intraperitoneally 15 min after brain frostbite,once every 2 hours.The brain frostbite models were established by skull external intelligence frostbite method,then the brain tissues were collected at 2,6,24 hours after frostbite.The brain water content was detected by dry wet weight method;the expression levels of MMP-9 mRNA were detected by RT-PCR;expression levels of MMP-9 protein were detected by immunohistochemistry.ResultsThe brain water content in saline group in different time points was significantly higher than that in sham-operation group(P<0.01),which peaked at 24 hours after brain frostbite.The brain water content in propofol group was significantly lower than that in saline group at 6,24 hours after brain frostbite(P<0.05 orP<0.01).The expression levels of MMP-9 mRNA in sham-operation group were decreased,however,which in saline group were significantly increased at 2 hours after brain frostbite,as compared with those in sham-operation(P<0.01),which peaked at 6 hours,continued at 24 hours(P<0.01).The expression levels of MMP-9 mRNA in propofol group were significantly decreased at 6,24 hours after brain frostbite,as compared with those in saline group(P<0.05 orP<0.01).The expression levels of MMP-9 protein in saline group were significantly increased at 2 hours after brain frostbite,as compared with those in sham-operation group,which peaked at 6 hours,continued at 24 hours(P<0.01).The expression levels of MMP-9 protein in propofol group were significantly decreased at 6h,24h after brain frostbite,as compared with those in saline group(P<0.05 orP<0.01).ConclusionPropofol at clinical anesthesia relevant dose can relieve brain edema after brain injury,which may be correlated to the inhibitory effect of propofol on expression of MMP-9.
propofol;traumatic brain injury;MMP-9;brain edema
10.3969/j.issn.1002-7386.2014.16.001
118000 辽宁省丹东市,中国人民解放军第230医院麻醉科(孙正清、盖成林、苏芳);第三军医大学附属新桥医院麻醉科(杨天德)
杨天德,400038 第三军医大学附属新桥医院麻醉科;
E-mail:31011@ sina.com
R 614
A
1002-7386(2014)16-2405-05
2014-04-02)

