热塑性纳米纤维的制备及功能化
刘琼珍,周 舟,李沐芳,刘 轲,赵青华,王 栋
(武汉纺织大学材料科学与工程学院,湖北 武汉 430200)
1 前 言
纳米纤维是指直径小于100 nm而长度较长的线状材料,实际中通常把直径小于1 000 nm的材料也称为纳米纤维,其比表面积将比微米级纤维高上100倍。聚合物纳米纤维由于具有高的比表面积,其结构中大量的官能团能够暴露在表面,因而,可通过对其表面官能团进行功能化改性,从而赋予其更多的功能性。改性的功能纳米纤维及纳米纤维膜制品目前在生物医学工程材料,传感器,过滤材料,以及功能性防护服装材料等领域具有巨大的应用前景[1-9]。
制备纳米纤维的常见方法有熔喷法、海岛纺丝法和静电纺丝法等。熔喷法主要适用于高熔融指数的聚丙烯材料,纤维直径一般在微米级[10-11]。海岛纺丝法制备热塑性纳米纤维具有诸多局限性,如昂贵的共轭纺丝机,复杂的喷丝头设计,两种能够形成海岛结构的聚合物,还有海岛成分的溶解和分离过程中的环境和经济问题。到目前为止,海岛技术仅能够制备直径在700 nm以上的PET和PA66纤维[14-18]。目前,纳米纤维的生产主要依赖静电纺丝法,但是,静电纺丝目前仍存在生产效率低、加工成本高等问题。此外,静电纺丝需要使用一些有机溶剂,带来环境友好方面的问题,同时增加回收设备成本[8]。同时,静电纺丝法目前无法制备高熔点和高粘度的热塑性纳米纤维,特别是直径为100 nm左右的热塑性纳米纤维。
基于此,王栋博士在美国期间同导师孙刚教授开发了一种新型高产出环境友好型热塑性纳米纤维的制造工艺[11-15],即熔融挤出相分离法,并以此生产出了聚酯、聚烯烃、聚酰胺、聚烯烃共聚物和热塑性聚氨酯等纳米纤维,其纤维直径可控制在80~500 nm范围。此方法成功攻克了采用传统的静电纺丝技术难以制备热塑性聚合物纳米纤维材料及采用熔喷法、熔融静电纺丝法又无法制备直径小于700 nm纤维的系列技术难题。因此,本综述主要以熔融挤出相分离法为基础,介绍热塑性纳米纤维的制备原理,功能化改性,以及由纳米纤维制备
纳米纤维膜的技术,并介绍王栋研究组近年来在纳米纤维功能化改性及纳米纤维膜的应用等方面所做的一些研究工作及取得的成果[16-24]。
2 热塑性纳米纤维及其膜制备原理及方法
热塑性纳米纤维的制备方法为熔融挤出相分离法,其基本原理为:将两种热力学互不相容的聚合物在双螺杆熔融挤出机中充分熔融共混、挤出,共混的聚合物熔体在挤出机和喷丝头内受到剪切和拉伸复合力场的作用而伸长变形,形成纳米纤维束,最后,去除基质聚合物,获得所需种类的热塑性纳米纤维,其原理见图1所示。此热塑性纳米纤维的制备工艺中,采用纤维素酯作为聚合物基质。采用纤维素酯的最大优势在于,它与大多数热塑性聚合物不相容,而且在后续的工艺中很容易通过丙酮将其从混合相中快速去除,去除的纤维素酯可以被循环回收利用。

图1 热塑性纳米纤维成形示意图Fig.1 Synthesis route of the thermoplastic nanofibers
目前,利用纤维素酯和多种热塑性聚合物的不相容体系,王栋等已成功且高效率地制备出几种热塑性纳米纤维,包括聚酯,聚烯烃和几种功能性共聚物等,如图2所示。利用此方法制备的热塑性纳米纤维为一系列轴向排

图2 几种热塑性纳米纤维的SEM照片:(a)CAB/iPP=80/20,(b)CAB/PTT=80/20,(c)CAB/PVA-co-PE=80/20,(d)CAB/TPU=80/20Fig.2 SEM morphologies of several thermoplastic nanofibers:(a)CAB/iPP=80/20,(b)CAB/PTT=80/20,(c)CAB/PVA-co-PE=80/20 and(d)CAB/TPU=80/20
列的纳米纤维集合体,具有聚合物结构可调控性及与现有纤维生产设备兼容性高等特点。此外,通过将纳米纤维涂覆在不同的基体表面,成功制备得到不同无纺布基体结构的纳米纤维膜,其示意图见图3。
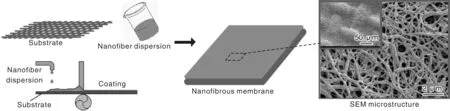
图3 纳米纤维膜的制备过程示意图及膜的SEM照片Fig.3 Schematic diagram of fabricating process and SEM image of nanofibrous membrane
3 热塑性纳米纤维的功能化及其应用
通过对表面含有官能团的热塑性聚合物纳米纤维进行功能化改性,可以实现其在多种领域的应用。本研究组目前通过对纳米纤维进行改性,已在生物传感器、过滤分离、抗菌和防污等领域的应用研究方面取得进展。
3.1 生物传感器领域
生物传感器(Biosensor)是对生物活性分子敏感并将其浓度转换为电信号进行检测的仪器。熟知的生物活性分子包括酶、抗体、抗原、微生物、细胞、组织、核酸等,这些活性分子可以用于监测环境中的有害物质、人体里的葡萄糖等[25-30]。然而在这些应用中,使用游离生物活性分子时,稳定性差、易失活,在催化反应后进行纯化、分离的工艺复杂且成本较高,所以,一般将这些生物活性分子固定在高分子微球或纤维材料上来提高生物分子的稳定性和重复利用性。但是,普通的高分子微球和纤维材料的比表面积较低,这就会导致较低的生物活性分子负载量,从而极大的降低生物传感的效率和灵敏度[28-30]。因此,具有高比表面积的纳米纤维材料便成为了一种具有优势的载体材料[9-22]。
王栋等人[18]采用熔融挤出相分离法成功制备了聚乙烯共聚甲基丙烯酸缩水甘油酯(PE-co-GMA)纳米纤维。由于PE-co-GMA是一种具备活性环氧基团的热塑性材料,而这种活性环氧基团则可以通过开环反应与蛋白质、酶等生物活性大分子中的氨基酸相连接[23-25],因此利用该纳米纤维制备生物传感器具有较大的潜力。其步骤是,首先采用丙二胺对制备出的纳米纤维表面进行处理,然后将此胺化后的纳米纤维进行酰化处理,最后将生物活性分子抗生素蛋白HRP接在纳米纤维表面,从而成功地实现了对PE-co-GMA纳米纤维表面进行抗生素蛋白HRP接枝的功能化处理,其原理和过程示意图示于图4中。
图5为不同直径的PE-co-GMA纳米纤维接枝HRP后的催化性能曲线,其催化性能用接枝的HRP与染料分子的作用的活度来评价(该染料分子在510 nm具有特征波长)。可见,这种高比表面积的纳米纤维在生物传感中具有相当高的活性、效率和灵敏性,即使在多次重复使用后,其生物传感仍然具有反应活性。
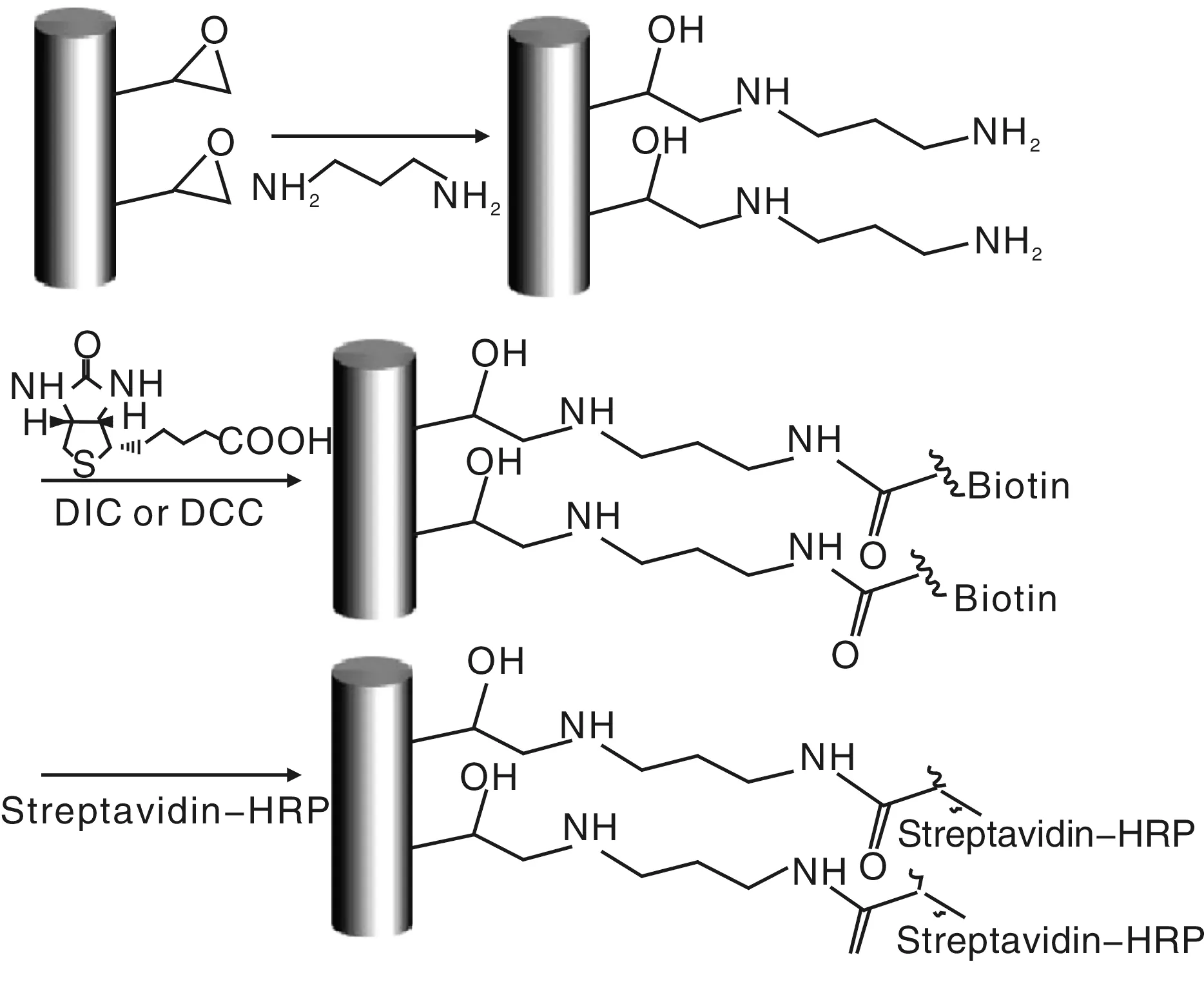
图4 PE-co-GMA纳米纤维接枝抗生素蛋白HRP的过程示意图Fig.4 Schematic diagram of synthesis route of the streptavidin-HRP immobilized PE-co-GMA nanofibers
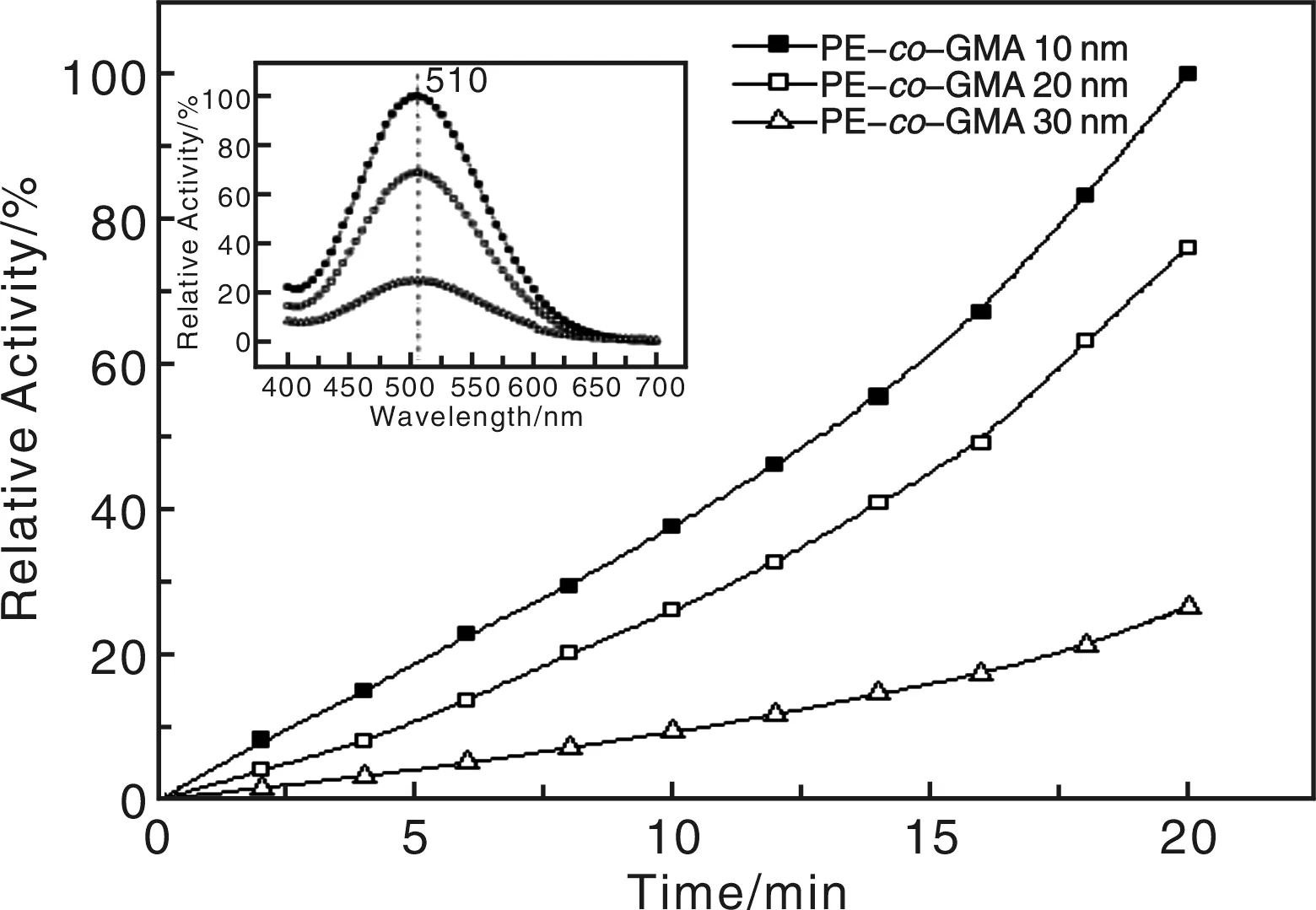
图5 不同直径的PE-co-GMA纳米纤维接枝HRP后的催化性能曲线Fig.5 Curves of catalytic activity of the dye solution acted with HRP for PE-co-GMA nanofibers grafted by HRP
3.2 过滤和分离领域
由于纳米纤维独特的大比表面积、良好的生物相容性以及低流阻性等特性,国内外很多学者致力于纳米纤维在改善过滤膜效率中的应用研究[26-31]。王栋等人[16]利用其制备的PVA-co-PE纳米纤维膜具有亲水性好、孔隙率高、孔径分布均匀等优点,探索了纳米纤维膜在水过滤方面的应用效果。以TiO2悬浮液截留率为计算标准制备的纳米纤维膜的过滤能力高达99.6%。研究表明,纳米纤维膜应用于过滤分离领域具有明显优势。
吸附、膜分离、过滤和离子交换等方法常被用来去除水中的重金属离子。其中,吸附由于操作简单、价格低廉、高效和选择性强,被广泛认为是最有效的方法。用于吸附重金属离子的吸附剂有很多种,吸附剂表面的螯合基团的数量决定了该材料对重金属离子的吸附容量。纳米纤维由于比表面积大、表面官能团多能吸附更多的金属离子,尤其是亲水性的纳米纤维,更能促进其与污水的浸润性,故在作为重金属离子吸附材料受到关注。此外,由于亚氨基二乙酸(IDA)被广泛应用于工业废水和饮用水中进行有毒、有害的重金属离子的去除,因此,通过接枝处理,将IDA引入到亲水性的纳米纤维表面,制备出的纳米纤维膜在吸附重金属离子领域具有巨大的应用潜力。
基于此设计思想,王栋等人通过熔融挤出相分离法制备了亲水性的PVA-co-PE纳米纤维,并利用三聚氯氰对其表面进行活化,随后通过亲核取代反应将IDA接枝至纳米纤维表面,成功制备出了表面固化IDA的亲水性PVA-co-PE纳米纤维,并采用涂覆的方法将该纳米纤维制备成了纳米纤维膜。图6为纳米纤维膜表面固化亚氨基二乙酸(IDA)及其吸附重金属离子的示意图。
图7为溶液中残留Cu2+的浓度与PVA-co-PE纳米纤维表面IDA接枝量的关系,并以纯PVA-co-PE纳米纤维作为对照样。该研究表明,表面接枝IDA的纳米纤维膜对重金属离子的吸附能力比纯PVA-co-PE纳米纤维膜强很多,且随着IDA浓度的增加,纳米纤维对铜离子的吸附能力增强。研究还发现,该纳米纤维膜对重金属离子的吸附具有一定的选择性,对金属离子的吸附能力Cu2+>Co2+>Zn2+> Ni2+>Mg2+。
3.3 高效抗菌领域
目前,很多方法能够使聚合物具备抗菌功效,如添加有机或无机杀菌剂、与包含抗菌基团的共聚物共聚以及接枝抗菌试剂至聚合物链段[1-10]等改性方法。由改性抗菌聚合物树脂加工成纤维和无纺布材料时,纤维的直径和表面亲疏水性对杀菌功能有着显著的影响。纤维直径越小,越多的接枝功能性单体能够被暴露在表面上发挥作用。纤维的亲水性越好,与活化溶液或细菌溶液的接触性越好,杀菌效果也就越好。因而,具有高比表面积的纳米纤维与传统微米级的相比,在抗菌纤维领域有着重要的应用潜力。
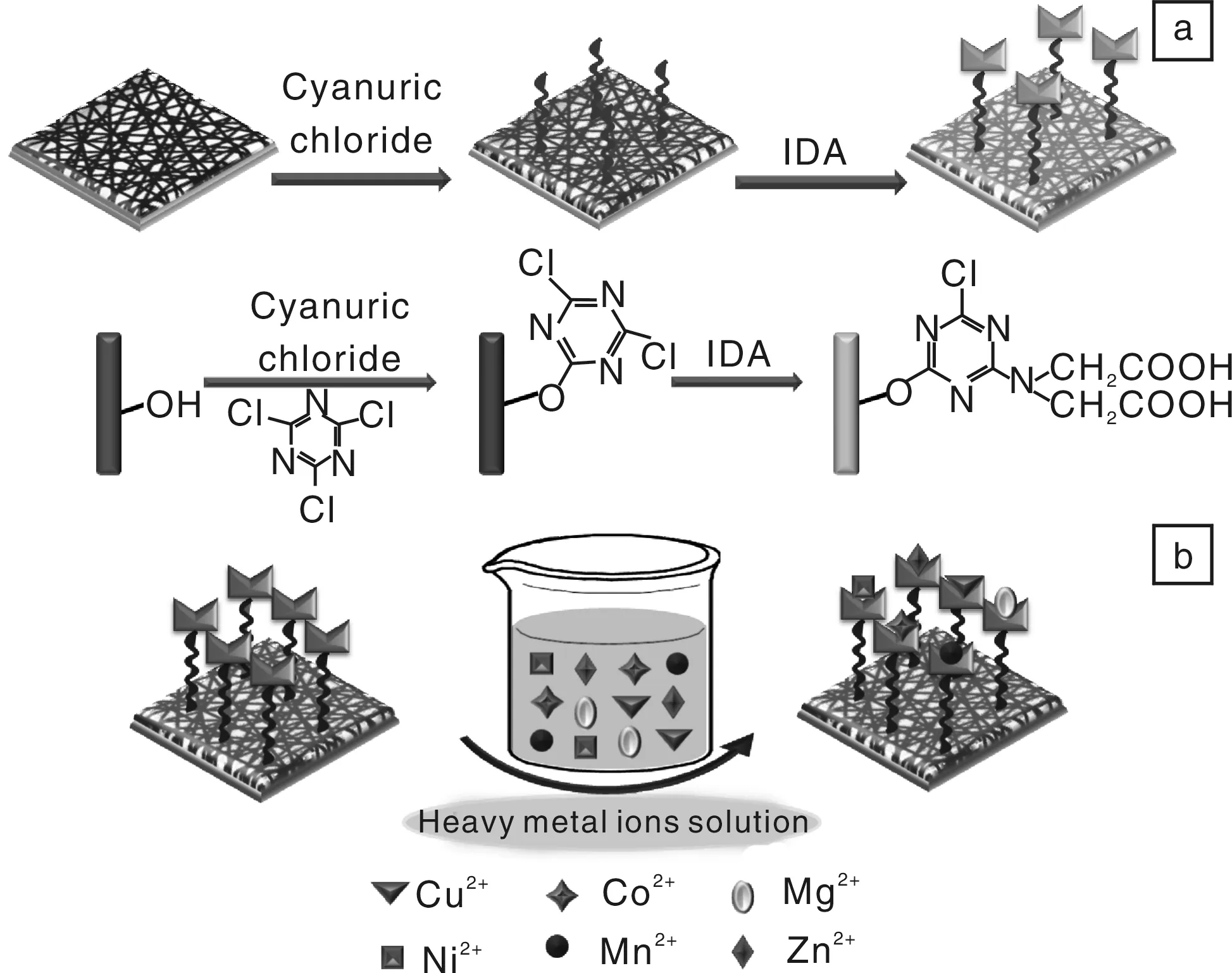
图6 纳米纤维膜表面固化亚氨基二乙酸(IDA)(a)及其吸附重金属离子(b)的示意图Fig.6 Schematic diagram of IDA immobilized(a) and heavy metalions absorbed(b) on surface of PVA-co-PE nanofiber membranes
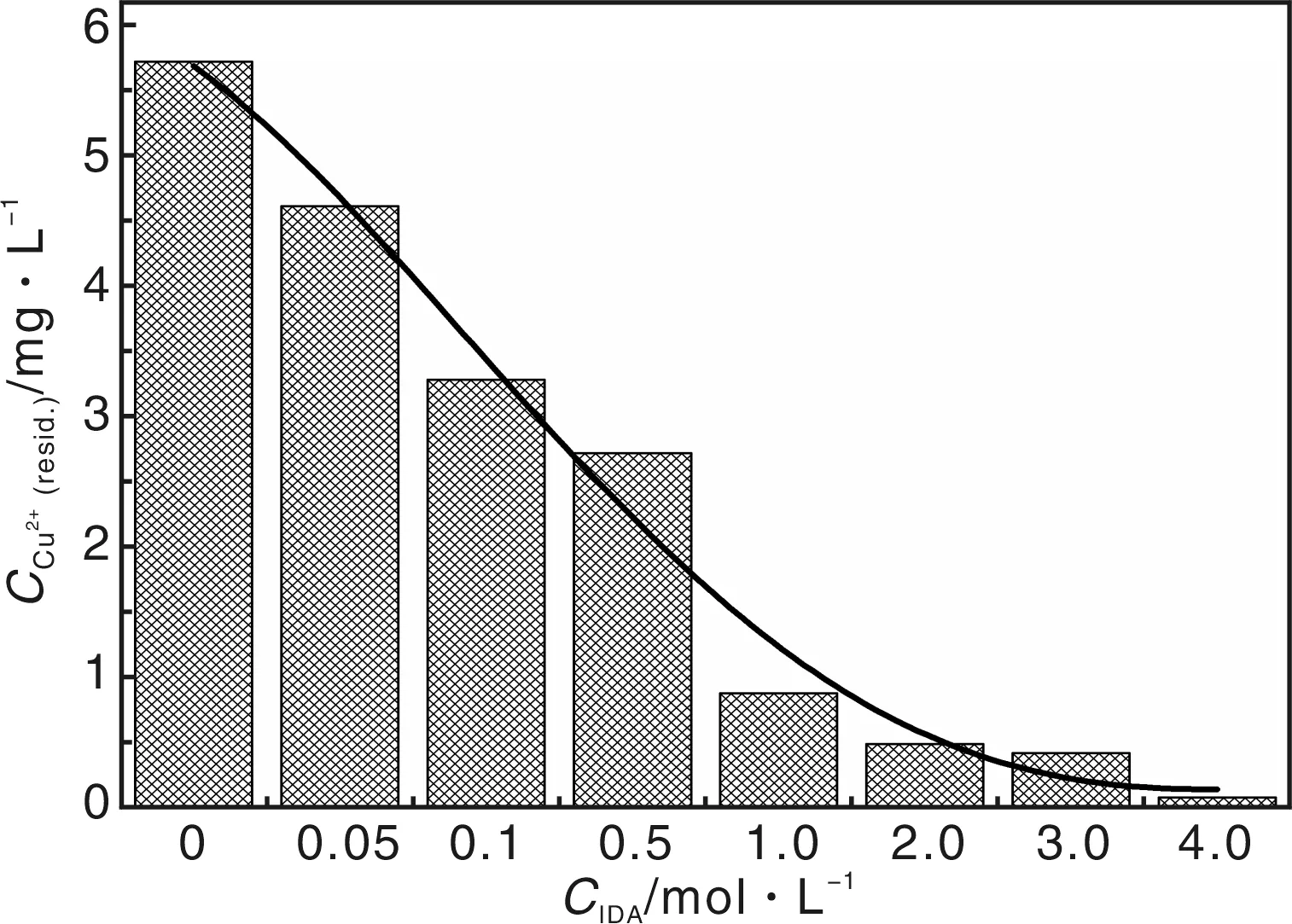
图7 溶液中残留的Cu2+含量与接枝的IDA浓度的关系(以未接枝IDA的纯PVA-co-PE作对照)Fig.7 Concentration of residual Cu2+ as a function of the concentration of grafted IDA(versus neat PVA-co-PE nanofiber)
王栋等人[23]将以卤胺类抗菌单体N, N-二烯丙基丙烯酰胺(NDAM)熔融接枝共聚到亲水性的PVA-co-PE聚合物主链上,然后将接枝共聚物制备成纳米纤维,经过氯活化后,制备出抗菌的纳米纤维,并观察了改性后的纳米纤维的抗菌效果。图8为PVA-co-PE纳米纤维与NDAM反应的示意图。
图9为未接枝和接枝NDAM的PVA-co-PE纳米纤维制备的两种超细纤维无纺布的抗菌效果对照的照片。由图9可见,NDAM接枝的PVA-co-PE超细纤维无纺布的营养液中,没有存活的细菌;而未接枝的PVA-co-PE超细纤维无纺布中有大量的大肠杆菌存在。研究发现,接触时间为10 min时,灭菌率已经高达99.999%。
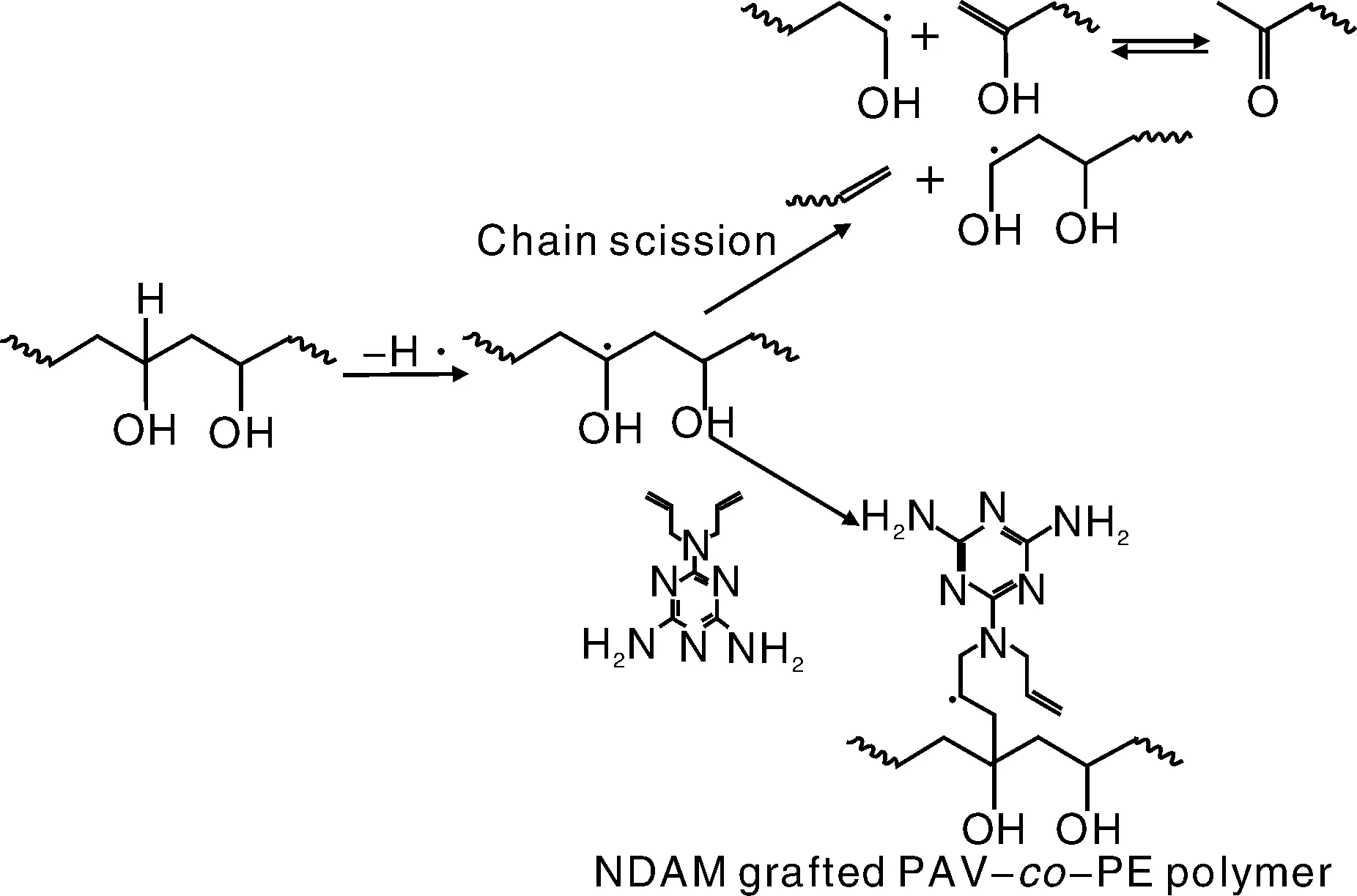
图8 PVA-co-PE纳米纤维与NDAM接枝的反应路线Fig.8 Synthesis route of NDAM reacting with PVA-co-PE nanofibers
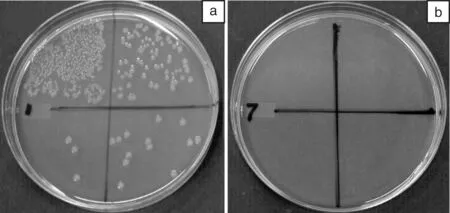
图9 超细纤维无纺布的抗菌检测结果照片:(a) 纯PVA-co-PE,(b) NDAM接枝乙烯基含量为32%的PVA-co-PEFig.9 Photos of the antibacterial test results of ultra-fine fibrous non-woven fabrics:(a) PVA-co-PE and (b) PVA-co-PE grafted by NDAM with 32% Vinyl
3.4 抗污领域
3.4.1 抗污材料
应用于组织工程的生物材料中,由于微生物在材料表面的粘附会在材料表面形成一层生物膜,从而导致材料失效。此外,非特异性蛋白质也会吸附在材料表面导致不可控的生物反应,从而导致血小板粘附或血栓。因而,抗污染材料的表面在生物材料或生物传感器方面有广泛的应用[32]。
两性离子由于其优异的抗非特异性蛋白吸附性,被人们广泛关注。两性离子聚合物如硫代甜菜碱类聚合物等代表了新型的可以替代传统的聚乙二醇类聚合物的抗非特异性蛋白吸附材料。因此,有两性离子结构的聚合物既能保证其结构又能提升其生物相容性。
“点击”化学作为一种高效的、温和的方法,在各种材料表面改性方面已经取得了很大的进展。该反应是聚合物表面和小分子之间的界面反应,操作方便且不需要合成产物的纯化过程。王栋等[24]采用点击化学法制备表面磺胺两性离子的PVA-co-PE纳米纤维膜,其合成路线如图10所示。首先将PVA-co-PE纳米纤维膜用三聚氯氰活化,然后分别接枝NaN3或炔丙胺得到“可点击”的PVA-co-PE纳米纤维膜,然后采用点击化学的方法分别在表面构建磺胺两性离子DEPAS和DMPS-N3。为证实两性磺胺功能化的PVA-co-PE 纳米纤维膜的抗非特异性蛋白吸附能力,用牛血清蛋白测试纳米纤维膜表面的抗吸附测试。研究发现,纳米纤维表面的两性磺胺离子能通过静电作用增强与水结合的能力,形成的亲水层能抵抗蛋白质的粘附。
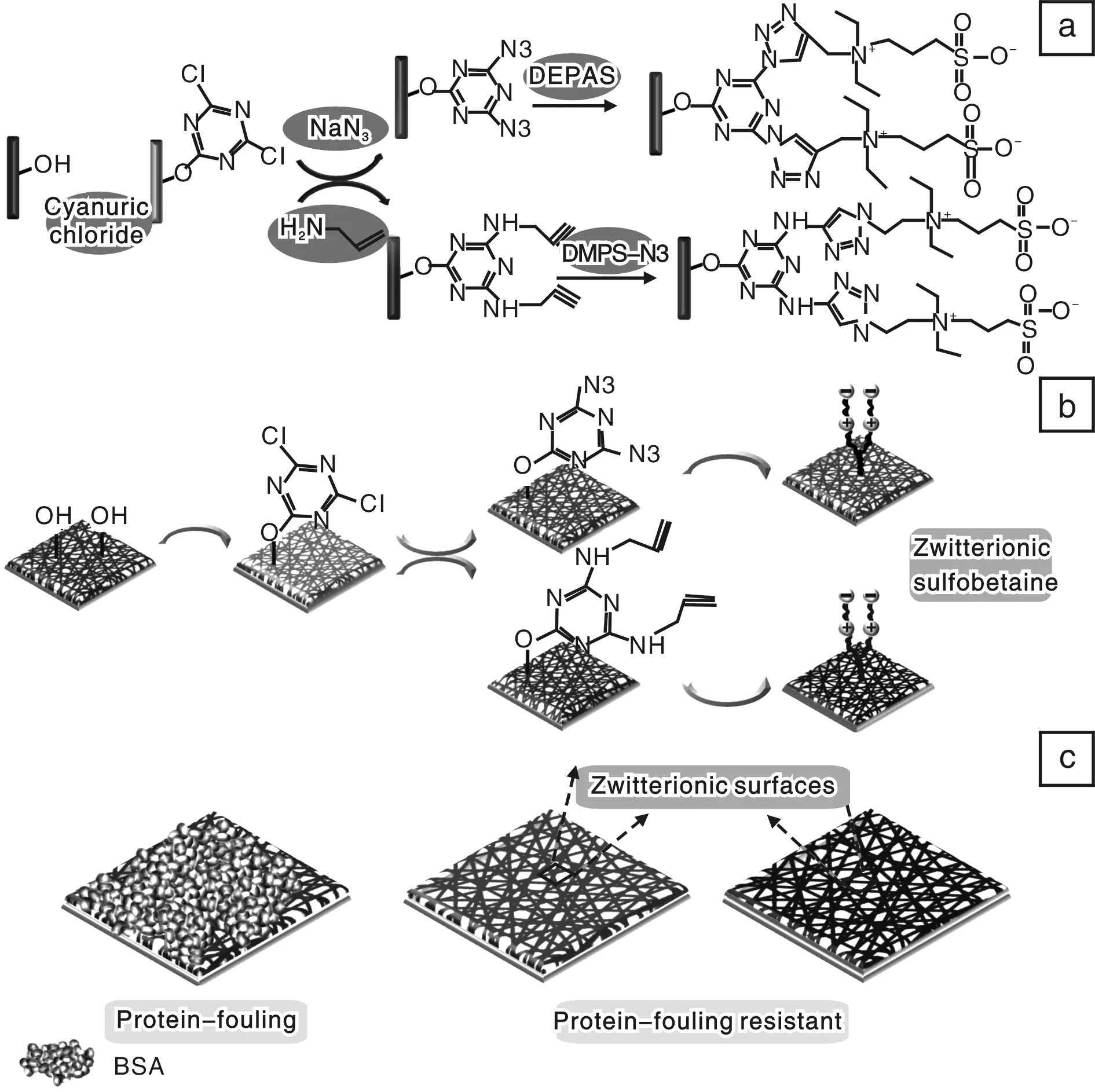
图10 磺酸两性离子功能化PVA-co-PE纳米纤维膜制备过程及抗非特异性蛋白吸附示意图:(a)“点击”反应,(b)膜结构,(c)抗污染性能[24]Fig.10 Zwitter-ionic sulfobetaine functionalized PVA-co-PE nanofiber membranes and their nonspecific protein resistance performance:(a)click reaction,(b)membrane structure, and (c)antifouling property[24]
王栋等人进一步通过表面原子转移自由基聚合(SI-ATRP)方法制备了表面含有两性磺胺离子的PVA-co-PE纳米纤维膜,探索这种新型抗污纳米纤维膜的抗菌性能。研究发现,表面两性磺胺离子的纳米纤维膜菌落数比纯纳米纤维的少很多。通过计算,其抗菌率达到99.46%。该抗菌原理在于,纳米纤维表面接技的两性磺胺离子所带的正电荷能将表面带负电荷的细菌吸引过来,进一步通过破坏细菌的细胞的结构而杀灭细菌。当细菌死后,两性磺胺离子的表面的负电荷能将杀死的细菌尸体排斥出去,重新激活抗菌功能。因而,表面接枝两性磺胺离子的纳米纤维膜还具有优良的抗菌性能。
3.4.2 光诱导自清洁功能膜
近几年,随着不断增长的环境问题如水和空气污染,以及不断增加的诸如致病微生物,有毒化学物质,污染物等危害,激发了人类对防护材料极大的研究兴趣。由于聚合纳米纤维膜的高孔隙率,大比表面积,低基重以及小的纤维直径,它被认为是理想的过滤媒介,能应用于过滤器和防护服。但是,纳米纤维膜上活性功能团的缺失使得其不仅不能中和或者分解有害污染物,而且不能消除堵塞的活性微生物的繁殖。这样由于释放的有害物质能引起二次污染,使纳米纤维膜抵抗污染物和微生物的功效大打折扣。因此,研发对环境无污染的抗有害微生物的纳米纤维薄膜十分必要。
有研究者将具有光催化性能的纳米颗粒加入不同种类的聚合物纳米纤维进行复合,但由于聚合物基质对活性颗粒的包覆大大降低了光催化效率,且材料的机械性能较差[11-17]。而有机光催化复合材料能克服上述缺陷[18-21]。
王栋等人[20]以熔融挤出相分离法制备的亲水性的PVA-co-PE纳米纤维薄膜为基体,将具有光催化活性的、带负电荷的2-AQS、2,6-AQS或2,7-AQS蒽醌磺酸钠单体和带正电荷的聚乙烯亚胺分子通过静电自组装在PVA-co-PE纳米纤维表面,从而制备了一种新的光诱导自清洁的纳米纤维薄膜,其示意图见图11。该研究以不同的纳米纤维结构对于降解以二氯酚靛酚(DCIP)、
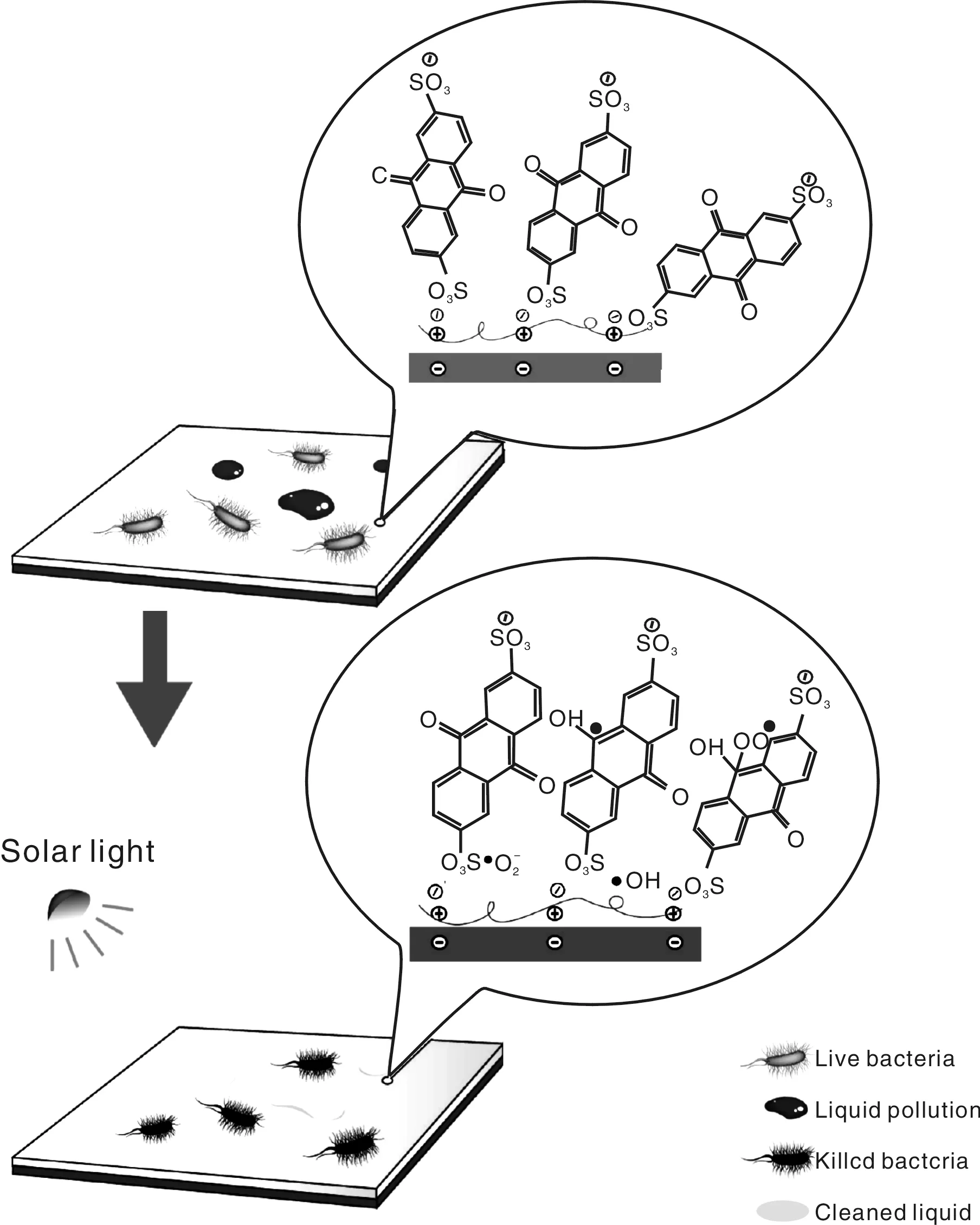
图11 光诱导自清洗功能的叠层结构纳米纤维膜的灭菌机理Fig.11 Sterilization mechanism of photoinduced self-cleaning layer-by-layer structured nanofiber membranes
直接红23号为代表的污染物的效果和大肠杆菌的抗菌效率来验证纳米薄膜的抗污功能。
研究发现,在长波紫外线照射下,所有组装有3种AQS化合物的PVA-co-PE纳米纤维薄膜都能分解二氯异丙醚 (DCIP),组装2,6-AQS的PVA-co-PE纳米纤维薄膜能在0.5 h内分解77%的DCIP,经2 h分解98%。研究还表明,纳米纤维薄膜上3种化合物的光反应性顺序为2,6-AQS>2-AQS>2,7-AQS。 以大肠杆菌进行测试发现,组装有2,6-AQS化合物的纳米纤维薄膜的琼脂板上,长波紫外线(365 nm)照射1 h后,大肠杆菌的减少率为99.9999%(接枝浓度105~106CFU/M)。这表明,组装AQS的纳米纤维薄膜展示了极好的光诱导生物自清洗功能。
4 结 语
主要综述了由王栋研究组研发的一种将纤维素酯基体抽提来制备热塑性聚合物纳米纤维的新技术,提出了多组分体系中纳米纤维结构的形成和调控机理,为连续、有序热塑性高聚物纳米纤维结构的构筑提供了新途径。与此同时,通过对热塑性聚合物纳米纤维进行功能化改性,从而开拓了功能性纳米纤维材料在生物传感器、抗菌、过滤分离和抗污等领域的应用,例如,具有快速检测与灭菌等生物有害物质的协同功能的纳米纤维膜传感器,具有优异杀菌功能的纳米纤维膜,应用于水净化和重金属去除的高效过滤纳米纤维膜,抗非特异性蛋白吸附,以及在光照下具备自清洁自消毒功能的纳米纤维材料等功能化应用。
此外,聚合物纳米纤维材料在军用、生物工程、工业防护服、酶催化、锂电池隔膜、化妆品、空气和水过滤等方面,有更广阔的应用潜力尚待开发。
聚合物纳米纤维经过10余年的发展,在诸多领域已逐渐显示出可观的应用价值,但纳米纤维应用的春天还未真正到来。因此,在纳米纤维的开发和应用研究方面,在未来的工作中还必须考虑技术的经济性、环境友好性、回收利用的可循环性,以及产品的安全认证等问题,总之,研究者应为纳米纤维产品走向商业化竭尽努力,才能使其释放出巨大的应用潜力,以满足科技进步和社会发展的需求。
参考文献 References
[1] Huang Zhengming, Zhang Y Z, Kotaki M,etal. A Review on Polymer Nanofibers by Electrospinning and Their Applications in Nanocomposites [J].CompositesScienceandTechnology, 2003, 63:2 223-2 253.
[2] Darrell Reneker H, Iksoo Chun. Nanometre Diameter Fibres of Polymer, Produced by Electrospinning[J].Nanotechnology, 1996(7):216.
[3] Deitzel J M, Kosik W, McKnight S H,etal. Electrospinning of Polymer Nanofibers with Specific Surface Chemistry[J].Polymer, 2002, 43:1 025.
[4] Dersch R, Steinhart M, Boudriot U,etal. Nanoprocessing of Polymers: Applications in Medicine, Sensors, Catalysis, Photonics[J].PolymersforAdvancedTechnologies, 2005, 16:276.
[5] Wang Xianyan, Young-gi Kim, Christopher Drew. Electrostatic Assembly of Conjugated Polymer Thin Layers on Electrospun Nanofibrous Membranes for Biosensors[J].NanoLetters, 2004(4):331.
[6] Wang Xianyan, Christopher Drew, Soo-hyoung Lee,etal. Electrospun Nanofibrous Membranes for Highly Sensitive Optical Sensors[J].NanoLetters, 2002(2): 1 273.
[7] Yuris Dzenis. Spinning Continuous Fibers for Nanotechnology[J].Science, 2004, 304:1 917.
[8] Paul Dalton D, Kristina Klinkhammer, Jochen Salber. Direct in Vitro Electrospinning with Polymer Melts[J].Biomacromolecules, 2006(7): 686.
[9] Youngchul Lee, Larry C Wadsworth. Structure and Filtration Properties of Melt Blown Polypropylene Webs[J].PolymerEngineering&Science, 1990, 30: 1 413.
[10] Nakajima T.AdvancedFiberSpinningTechnology[M]. Cambridge: Woodhead Publishing, 1994.
[11] Dong Wang, Gang Sun, Bor-sen Chiou. A High-Throughput, Controllable, and Environmentally Benign Fabrication Process of Thermoplastic Nanofibers[J].MacromolecularMaterialsandEngineering, 2007, 292: 407-414.
[12] Wang D, Sun G, Chiou B S,etal. Controllable Fabrication and Properties of Polypropylene Nanofibers[J].PolymerEngineering&Science, 2007, 47(11): 1 865-1 872.
[13] Xue C H, Wang D, Xiang B,etal. Controlled and High Throughput Fabrication of Poly (Trimethylene Terephthalate) Nanofibers via Melt Extrusion of Immiscible Blends[J].MaterialsChemistryandPhysics, 2010, 124(1): 48-51.
[14] Wang D, Sun G, Chiou B S. Fabrication of Tunable Submicro-or Nano-Structured Polyethylene Materials from Immiscible Blends with Cellulose Acetate Butyrate[J].MacromolecularMaterialsandEngineering, 2008, 293(8): 657-665.
[15] Xue C H, Wang D, Xiang B,etal. Morphology Evolution of Polypropylene in Immiscible Polymer Blends for Fabrication of Nanofibers[J].JournalofPolymerSciencePartB:PolymerPhysics, 2010, 48(9): 921-931.
[16] Li M, Wang D, Xiao R,etal. A Novel High Flux Poly (Trimethylene Terephthalate) Nanofiber Membrane for Microfiltration Media[J].SeparationandPurificationTechnology, 2013, 116: 199-205.
[17] Dong H, Wang D, Sun G,etal. Assembly of Metal Nanoparticles on Electrospun Nylon 6 Nanofibers by Control of Interfacial Hydrogen-Bonding Interactions[J].ChemistryofMaterials, 2008, 20(21): 6 627-6 632.
[18] Wang D, Sun G, Xiang B,etal. Controllable Biotinylated Poly (Ethylene-co-Glycidyl Methacrylate)(PE-co-GMA) Nanofibers to Bind Streptavidin-Horseradish Peroxidase (HRP) for Potential Biosensor Applications[J].EuropeanPolymerJournal, 2008, 44(7): 2 032-2 039.
[19] Li M, Xue X, Wang D,etal. High Performance Filtration Nanofibrous Membranes Based on Hydrophilic Poly(Vinyl Alcohol-co-Ethylene) Copolymer[J].Desalination, 2013, 329: 50-56.
[20] Wang D, Liu N, Xu W,etal. Layer-by-Layer Structured Nanofiber Membranes with Photoinduced Self-Cleaning Functions[J].TheJournalofPhysicalChemistryC, 2011, 115(14): 6 825-6 832.
[21] Wang D, Wang K, Xu W. Novel Fabrication of Magnetic Thermoplastic Nanofibers via Melt Extrusion of Immiscible Blends[J].PolymersforAdvancedTechnologies, 2013, 24(1): 70-74.
[22] Wang D, Lin Y, Zhao Y,etal. Polyacrylonitrile Fibers Modified by Nano-Antimony-Doped Tin Oxide Particles[J].TextileResearchJournal, 2004, 74(12): 1 060-1 065.
[23] Wang D, Xu W, Sun G,etal. Radical Graft Polymerization of an Allyl Monomer onto Hydrophilic Polymers and Their Antibacterial Nanofibrous Membranes[J].ACSAppliedMaterials&Interfaces, 2011, 3(8): 2 838-2 844.
[24] Huang J, Wang D, Lu Y,etal. Surface Zwitterionically Functionalized PVA-co-PE Nanofiber Materials by Click Chemistry[J].RSCAdvances, 2013, 3(43): 20 922-20 929.
[25] Patel A C, Li S, Yuan J M,etal. In Situ Encapsulation of Horseradish Peroxidase in Electrospun Porous Silica Fibers for Potential Biosensor Applications[J].Nanoletters, 2006, 6(5): 1 042-1 046.
[26] Kim M S, Seo K S, Khang G,etal. Preparation of a Gradient Biotinylated Polyethylene Surface to Bind Streptavidin-FITC[J].BioconjugateChemistry, 2005, 16(2): 245-249.
[27] Wang Y, Hsieh Y L. Enzyme Immobilization to Ultra-Fine Cellulose Fibers via Amphiphilic Polyethylene Glycol Spacers[J].JournalofPolymerSciencePartA:PolymerChemistry, 2004, 42(17): 4 289-4 299.
[28] Li D, Frey M W, Baeumner A J. Electrospun Polylactic Acid Nanofiber Membranes as Substrates for Biosensor Assemblies[J].JournalofMembraneScience, 2006, 279(1): 354-363.
[29] Lei C, Shin Y, Magnuson J K,etal. Characterization of Functionalized Nanoporous Supports for Protein Confinement[J].Nanotechnology, 2006, 17(22): 5 531.
[30] Ko S, Jang J. Protein Immobilization on Aminated Poly (Glycidyl Methacrylate) Nanofibers as Polymeric Carriers[J].Biomacromolecules, 2007, 8(5): 1 400-1 403.
[31] Reneker D H, Chun I. Nanometre Diameter Fibres of Polymer, Produced by Electrospinning[J].Nanotechnology, 1996, 7(3): 216.
[32] Ma Z, Kotaki M, Yong T,etal. Surface Engineering of Electrospun Polyethylene Terephthalate (PET) Nanofibers Towards Development of a New Material for Blood Vessel Engineering[J].Biomaterials, 2005, 26(15): 2 527-2 536.
[33] Chen L.NextGenerationofElectrospunTextilesforChemicalandBiologicalProtectionandAirFiltration[R]. Massachusetts Inst of Tech Cambridge, 2009.

