3-取代苯基吡咯吡嗪酮的合成*
吴丽颖,马 鹤
(1.河北联合大学 药学院,河北 唐山 063000;2.沈阳药科大学 制药工程学院,辽宁 沈阳 110016)
·快递论文·
3-取代苯基吡咯吡嗪酮的合成*
吴丽颖1,马 鹤2
(1.河北联合大学 药学院,河北 唐山 063000;2.沈阳药科大学 制药工程学院,辽宁 沈阳 110016)
以2-甲基-3-对氨基苯基吡咯并[1,2-a]吡嗪-1(2H)-酮为母体,分别经酰基化(或磺酰基化,烷基化)反应合成了一系列新型的吡咯并吡嗪酮类化合物,其结构经1H NMR,IR和MS表征。
非甾体抗炎药;吡咯并[1,2-a]吡嗪酮;合成
非甾体抗炎药(NSAIDs)是一类用于治疗各种急、慢性炎症的药物。研究表明,从苦木科植物中分离出的α-亚甲基环戊酮,α-亚甲基环己酮,α,β-不饱和环酮结构的天然化合物具有显著的抗癌、抗炎活性[1]。近年来,有关环加氧酶与肿瘤的关系以及NSAIDs 对肿瘤防治作用的研究日益成为热点[2-4]。
本课题组[9]在前期研究中发现,吡咯并吡嗪酮类衍生物具有抗炎和/或镇痛活性[5-8]。在设计并合成的8个3-取代苯基吡咯并吡嗪酮类化合物中,2-甲基-3-[4-(4-甲氧基)磺酰胺基苯基]吡咯并[1,2-a]吡嗪-1(2H)-酮对人肝癌细胞系HepG-2的抑制率甚至超过了阳性对照药5-氟尿嘧啶。
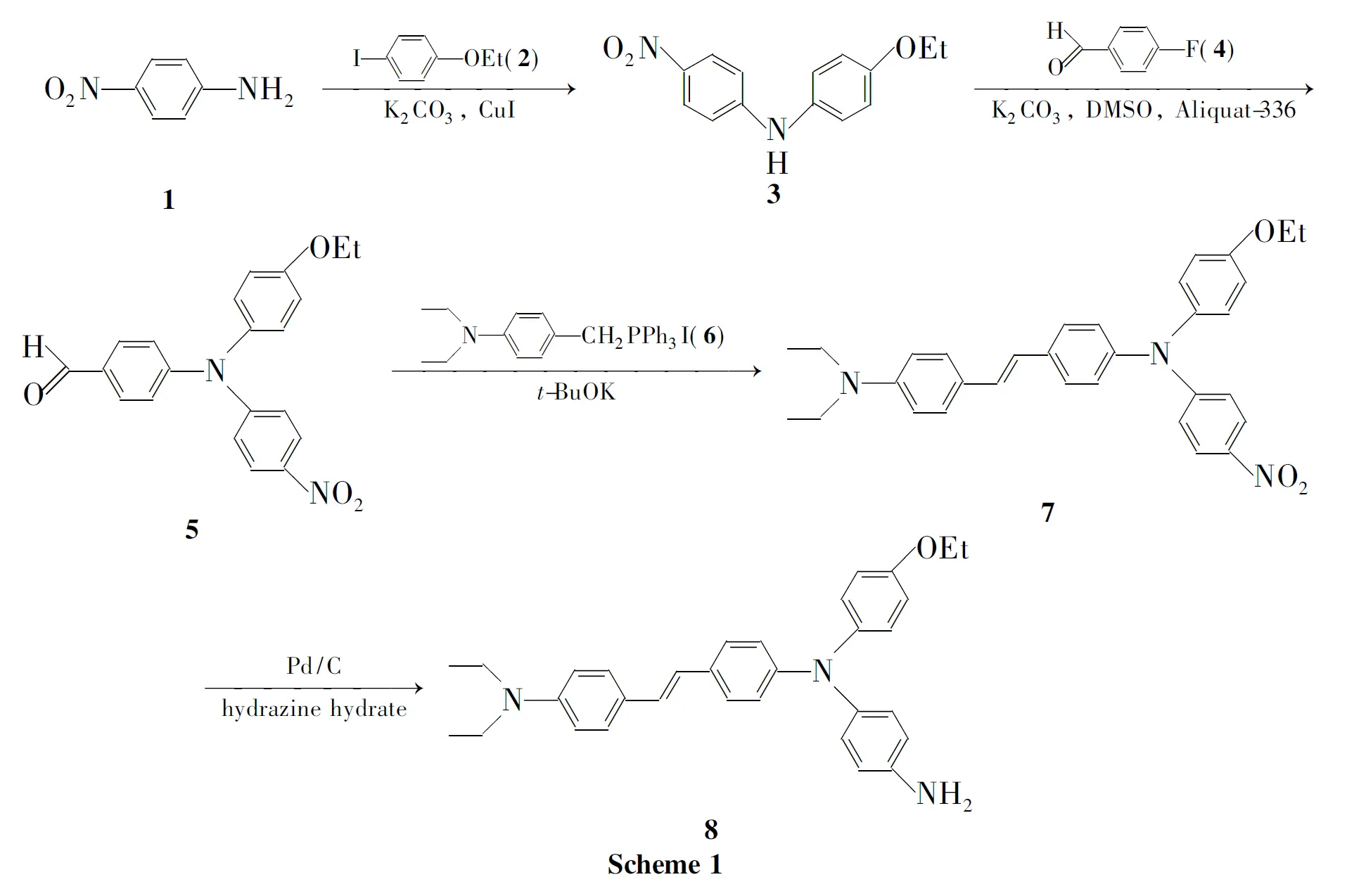
为了继续寻找新型的3-取代苯基吡咯并吡嗪酮衍生物,本文在前期研究[9]的基础上,以2-甲基-3-对氨基苯基吡咯并[1,2-a]吡嗪-1(2H)-酮(1)为母体,与酰氯(2a~2i)经酰基化反应合成了酰化产物3a~3i;1与苯磺酰氯经磺酰化反应合成了磺酰化产物2-甲基-3-[4-(苯磺酰基)氨基苯基]吡咯并[1,2-a]吡嗪-1(2H)-酮(4);1与对硝基氯化苄经烷基化反应合成了烷基化产物2-甲基-3-[4-(4-硝基苄基)氨基苯基]吡咯并[1,2-a]吡嗪-1(2H)-酮(5)(Scheme 1),3a~3i,4和5为新化合物,其结构经1H NMR,IR和MS表征。
1 实验部分
1.1 仪器与试剂
Bruker ARX-300型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Shimadzu GCMS-QP5050A型气质联用仪;Agilent 1100型液质联用仪。
1按文献[9]方法合成;2a~2i按酰氯的常规方法制备;其余所用试剂均为分析纯。
1.23a~3i的合成(以3a为例)
在反应瓶中依次加入THF 35mL,11.0g(4mmol)和三乙胺0.6g(6mmol),搅拌下于室温反应0.5h;缓慢滴加间硝基苯甲酰氯(2a)1.1g(6mmol)的THF(15mL)溶液,滴毕,于室温反应2h。倾入80mL冰水中,充分搅拌,抽滤,滤饼用95%乙醇和THF混合溶剂重结晶得3a。
用类似方法合成3b~3i(重结晶溶剂:3e和3f用无水乙醇;3g用THF)。
用苯磺酰氯代替2a,用类似的方法合成4(重结晶溶剂为95%乙醇)。
3a:黄色固体,收率61.5%,m.p.282℃~284℃;1H NMRδ:3.18(s,3H,NCH3),6.57(br.t,1H,7-H),6.91(d,J=3.30Hz,1H,8-H),7.39~7.43(m,2H,4,6-H),7.53~7.56(m,2H,2′,6′-H),7.84~7.94(m,3H,3′,5′,5″-H),8.41~8.48(m,2H,4″,6″-H),8.81(s,1H,2″-H),10.77(s,1H,NH)。
3b:淡黄色固体,收率76.2%,m.p.256℃~258℃;1H NMRδ:3.16(s,3H,NCH3),6.56(br.t,1H,7-H),6.90(d,J=3.83Hz,1H,8-H),7.36~7.40(m,4H,4,6,2′,6′-H),7.49(d,J=8.27Hz,2H,3′,5′-H),7.88(d,J=8.32Hz,2H,2′,6′-H),8.03~8.06(m,2H,3″,5″-H),10.44(s,1H,NH);IRν:1597.37cm-1;MSm/z: 361[M+]。
3c:白色固体,收率60.4%,m.p.234℃~236℃;1H NMRδ:3.17(s,3H,NCH3),3.75(s,3H,4″-OCH3),3.89(s,6H,3″,5″-OCH3),6.56(br.t,1H,7-H),6.90(d,J=3.80Hz,1H,8-H),7.28(s,2H,2″,6″-H),7.37(s,1H,4-H),7.41(m,1H,6-H),7.50(d,J=8.49Hz,2H,3′,5′-H),7.86(d,J=8.20Hz,2H,2′,6′-H),10.46(s,1H,NH);IRν:1618.24cm-1。
3d:淡黄色固体,收率63.6%,m.p.258℃~260℃;1H NMRδ:3.16(s,3H,NCH3),6.56(br.t,1H,7-H),6.90(d,J=3.60Hz,1H,8-H),7.36~7.40(m,4H,4,6,4″,6″-H),7.48(d,J=8.40Hz,2H,3′,5′-H),7.88(d,J=8.46Hz,2H,2′,6′-H),8.03~8.05(m,2H,2″,5″-H),10.48(s,1H,NH);IRν:1597.64cm-1。
3e:红色固体,收率62.1%,m.p.320℃~322℃;1H NMRδ:3.19(s,3H,NCH3),6.58(br.t,1H,7-H),6.92(m,1H,8-H),7.41~7.43(m,2H,4,6-H),7.57(d,2H,J=8.40Hz,3′,5′-H),7.92(d,J=8.10Hz,2H,2′,6′-H),9.03(s,1H,4″-H),9.20(m,2H,2″,6″-H),11.04(s,1H,NH)。
3f:淡黄色固体,收率66.2%,m.p.308℃~310℃;1H NMRδ:3.16(s,3H,NCH3),6.56(br.t,1H,7-H),6.90(d,1H,J=3.30Hz,8-H),7.37(s,1H,4-H),7.42(br.t,1H,6-H),7.50(d,J=8.40Hz,2H,3′,5′-H),7.75(d,2H,J=8.40Hz,2′,6′-H),7.85~8.29(m,2H,5″,6″-H),8.30(s,1H,3″-H),10.91(s,1H,NH)。
3g:淡黄色固体,收率34.8%,m.p.156℃~158℃;1H NMRδ:2.19(s,3H,OCOCH3),3.17(s,3H,NCH3),6.56(br.t,1H,7-H),6.90(d,J=3.57Hz,1H,8-H),7.26(d,J=8.04Hz,1H,3″-H),7.36~7.44(m,3H,4,6,5″-H),7.48(d,J=8.49Hz,2H,3′,5′-H),7.57~7.72(m,2H,4″,6″-H),7.82(d,J=8.43Hz,2H,2′,6′-H),10.55(s,1H,NH)。
3h:白色固体,收率32.4%,m.p.244℃~246℃;1H NMRδ:3.16(s,3H,NCH3),6.56(br.t,1H,7-H),6.90(d,J=3.60Hz,1H,8-H),7.37~7.40(m,2H,4,6-H),7.49(d,J=8.43Hz,2H,3′,5′-H),7.55~7.69(m,2H,4″,6″-H),7.88(d,J=8.43Hz,2H,2′,6′-H),7.93~8.02(m,2H,2″,5″-H),10.53(s,1H,NH)。
3i:淡黄色固体,收率31.1%,m.p.254℃~256℃;1H NMRδ:3.17(s,3H,NCH3),6.56(br.t,1H,7-H),6.91(d,1H,J=3.30Hz,8-H),7.38~7.43(m,2H,4,6-H),7.48(m,1H,5″-H),7.50(d,J=8.70Hz,2H,3′,5′-H),7.61~7.85(m,3H,2″,4″,6″-H),7.90(d,J=8.40Hz,2H,2′,6′-H),10.50(s,1H,NH)。
4:淡黄色固体,收率45.0%,m.p.275℃~277℃;1H NMRδ:3.06(s,3H,NCH3),6.53(br.t,1H,7-H),6.88(s,1H,8-H),7.18~7.21(m,2H,3′,5′-H),7.29~7.39(m,4H,4,6,2′,6′-H),7.58~7.84(m,5H,2″,3″,4″,5″,6″-H),10.61(s,1H,NH)。
(3)5的合成
在反应瓶中依次加入丙酮35mL和10.6g,搅拌使其溶解;加入碳酸钾0.61g,缓慢滴加4-硝基氯化苄0.52g的丙酮(15mL)溶液,滴毕,于室温反应2h;回流反应2h。冷却至室温,倾入冷水中,抽滤,滤饼经硅胶柱层析[梯度洗脱剂:V(乙酸乙酯)∶V(石油醚)=1∶3→1∶4]纯化得黄色固体5,收率27.7%,m.p.246℃~248℃;1H NMRδ:3.10(s,3H,NCH3),4.46(d,J=5.43Hz,2H,CH2),6.52(s,1H,NH),6.60(d,J=8.07Hz,2H,3′,5′-H),6.83(m,2H,7,8-H),7.14(d,J=8.16Hz,2H,2′,6′-H),7.22(s,1H,4-H),7.33(s,1H,6-H),7.62(d,J=8.19Hz,2H,2″,6″-H),8.20(d,J=8.28Hz,2H,3″,5″-H)。
2 结论
合成了11个新型的吡咯吡嗪酮衍生物,其中包括9个N-取代苯甲酰化产物,1个N-苯磺酰化产物(4)和1个N-烷基化产物(5)。5的收率偏低,与文献[9]结果相近,分析原因可能是在进行亲核取代反应时,氯代烃的活性低于酰氯。
[1] Morimoto A,Watanable T.Pyrrole lactam derivatives with antiprotozoa antitrichomonas blood sugar decreasing and gastric juice apoleptic activity[P].JP 7427877,1974.
[2] Sarah Kraus,Nadir Arber.Do aspirin and other NSAIDs protect against colorectal cancer?[J].Nat Rev Gastroenterol Hepatol,2011,8:125-126.
[3] Debora Compare,Olga Nardone,Gerardo Nardone.Non-steroidal anti-inflammatory drugs in the carcinogenesis of the gastrointestinal tract[J].Pharmaceuticals,2010,3:2495-2516.
[4] Sarah L Horn,Ian S Fentiman.The Role of Non-steroidal anti-inflammatory drugs in the chemoprevention of breast cancer[J].Pharmaceuticals,2010,3:1550-1560.
[5] 庞冀燕,孙光,傅德才,等.二氢吡咯并吡嗪酮衍生物的合成和抗炎镇痛作用[J].中国药物化学杂志,2002,12(2):82-85.
[6] 傅德才.吡咯吡嗪酮和吡咯噁嗪酮衍生物的合成及抗炎镇痛作用研究[D].沈阳:沈阳药科大学,2002.
[7] 王绯.吡嗪酮类化合物的合成和抗炎镇痛构效关系研究[D].沈阳:沈阳药科大学,2004.
[8] 吴丽颖,马鹤,王玉玲,等.吡咯并吡嗪酮类化合物的合成及抗炎镇痛活性研究[J].河北化工,2007,30(9):21-23.
[9] 马鹤,张智勇,等.2-甲基-3-取代苯基吡咯并吡嗪酮类化合物的合成及抗癌活性研究[J].中国药物化学杂志,2010,20(3):171-175.
Synthesisof3-SubstitutedPhenylPyrrolepyrazinones
WU Li-ying1, MA He2
(1.School of Pharmacy,Hebei United University,Tangshan 063000,China;2.School of Pharmaceutical Engineering,Shenyang Pharmaxeutical University,Shenyang 110016,China)
A series of novel pyrrolepyrazinone compounds were synthesized by acylation(or sulfonyl,or alkylation)of 2-methyl-3-amino phenyl pyrrole [1,2-a] pyrazine-1(2H)-ketone.The structures were characterized by1H NMR,IR and MS.
NSAIDs;pyrrolepyrazinone;synthesis
2013-05-15;
2014-05-26
唐山市科学技术研究与发展计划(11150205A-16)
吴丽颖(1980-),女,满族,河北唐山人,讲师,主要从事新药设计合成与筛选的研究。Tel.0315-3725706,E-mail: mr320@126.com
O626;O621.3
A
1005-1511(2014)05-0654-03

