新型姜黄素类似物的微波合成及其抗氧化活性*
张 超,陈明弟
(广州医科大学 药学院,广东 广州 510182)
·研究论文·
新型姜黄素类似物的微波合成及其抗氧化活性*
张 超,陈明弟
(广州医科大学 药学院,广东 广州 510182)
采用微波法,取代苯甲醛分别与环戊酮和环己酮经克莱森-斯密特缩合反应制得中间体2,6-双苯亚甲基环己酮(2a~2e)和2,5-双苯亚甲基环戊酮(5a);2a~2e或5a分别与硫脲或尿素经Biginelli反应合成了8个新型的姜黄素类似物(3a~3e,4a,4c和6a),其结构经1H NMR,13C NMR,IR和MS表征。利用DPPH法比较3~6与姜黄素的抗氧化能力。实验结果表明:3~6的抗氧化能力均比姜黄素母核结构高;3比4和6的自由基清除能力强;随用药量增大,抗氧化能力呈现先增强后下降的趋势,并在0.09mg·mL-1~0.12mg·mL-1自由基清除率达最大。
姜黄素类似物;微波辐射;合成;抗氧化活性
姜黄素(Ⅰ,Chart 1)及其类似物是一种具有抗氧化、抗炎、抗菌和抗肿瘤等药理活性的化合物[1-2]。研究表明,Ⅰ对帕金森和阿尔兹海默病等[3-4]中枢神经系统疾病具有良好的神经保护作用[5],具有改善AD患者的记忆功能和认知能力。由于Ⅰ的理化性质特点,使其难于通过血脑屏障,生物利用度低,限制了其临床应用[6]。因此,对姜黄素类似物的合成研究具有重要的应用价值。
本文在前期研究[7]的基础上,以Ⅰ为先导化合物,采用微波法,以取代苯甲醛(1a~1e)为原料,分别与环己酮(Ⅱ)和环戊酮(Ⅴ)经克莱森-斯密特缩合反应制得中间体2,6-双苯亚甲基环己酮(2a~2e)和2,5-双苯亚甲基环戊酮(5a);2a~2e或5a分别与硫脲(Ⅲ)或尿素(Ⅳ)经Biginelli反应合成了8个新型的姜黄素类似物(3a~3e,4a,4c和6a,Scheme 1),其结构经1H NMR,13C NMR,IR和MS表征。并利用1,1-二苯基-2-三硝基苯肼(DPPH)法研究了3~6与 Ⅰ 的抗氧化能力[8]。


1 实验部分
1.1 仪器与试剂
X-4型数字显示显微熔点仪;VIS-7200A型紫外可见分光光度计(UV-Vis);Avance Ⅲ型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 700型傅立叶变换红外光谱仪(KBr压片);Agilent 6120型液-质联用仪;MAS-Ⅱ型微波反应器;DF-101S型集热式恒温加热反应器。
2a~2e和5a按文献[7]方法合成,其表征数据[10]与Scheme 1预期结构吻合;其余所用试剂均为色谱纯或分析纯。
1.2 合成
(1)3a~3e,4a,4c和6a的合成(以3a为例)
在反应瓶中依次加入2a452.6mg(1mmol)和无水乙醇10mL,搅拌使其溶解;加入Ⅲ 114.2mg(1.5mmol)和适量乙醇钠溶液,转至微波反应器中,于85℃微波辐射(400W)10min。用二氯甲烷(3×10mL)萃取,合并萃取液,用无水NaSO4干燥,浓缩后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=50∶1]纯化得3a。
用类似方法合成3b~3e。用Ⅳ代替Ⅲ,用类似方法合成4a和4c。用5a代替2,用类似方法合成6a。
3a:米白色固体,收率83%,m.p.186℃;1H NMRδ: 7.60(s,1H,NH),7.25(s,1H,NH),6.94~6.79(m,6H,ArH),6.76(s,1H,CH=C),5.33(s,1H,NCH),4.08~3.67(m,12H,OCH3),2.71~2.44(m,2H,CH2),2.04(s,2H,CH2),1.73(s,2H,CH2);IRν: 3436(NH),3198(Ar-H),2993,2855(CH3),2926,2832(CH2),1496(C=S),1569,1556(C=C),1464(Ar,C=C)cm-1;MSm/z: 453.3{[M+H]+}。
3b:淡黄色固体,收率82%,m.p.172℃;1H NMRδ: 9.25(s,1H,NH),8.89(s,1H,NH),7.29~7.09(m,8H,ArH),7.05(s,1H,C=CH),5.11(s,1H,NCH),2.26(s,6H,CH3),2.01(d,J=17.1Hz,2H,CH2),1.65(dd,J=16.9Hz,6.1Hz,2H,CH2),1.50(s,2H,CH2);13C NMRδ: 173.52,140.88,136.33,135.41,130.47,129.67,129.11,127.98,127.69,127.05,126.60,125.20,122.10,113.82,55.78,26.60,25.81,21.97,19.70,18.82,18.49;IRν: 3446(NH),3196(Ar-H),2859(CH3),2922,2825(CH2),1498(C=S),1558(C=C),1197(Ar,C=C)cm-1;MSm/z: 361.4{[M+H]+}。
3c:淡黄色固体,收率86%,m.p.174℃;1H NMRδ: 9.20(s,1H,NH),9.00(s,1H,NH),7.17~7.04(m,8H,ArH),6.09(s,1H,CH=C),4.75(s,1H,NCH),2.31(d,J=2.5Hz,6H,CH3),2.06(s,2H,CH2),1.93~1.76(m,2H,CH2),1.63~1.43(m,2H,CH2);13C NMRδ: 173.92,142.57,137.70,137.11,136.90,129.75,128.50,127.97,127.27,126.22,123.90,122.82,114.21,79.13,58.90,26.42,26.06,21.94,21.04;IRν: 3177(NH),3103(Ar-H),2999,2861(CH3),2930,2827(CH2),1499(C=S),1577(C=C),1600,1382(Ar,C=C)cm-1;MSm/z: 361.3{[M+H]+}。
3d:米黄色颗粒固体,收率84%,m.p.182℃;1H NMRδ: 9.23(s,1H,NH),9.02(s,1H,NH),7.34~7.25(m,8H,ArH),7.00(s,1H,C=CH),4.77(s,1H,NCH),3.76(s,6H,OCH3),2.11(d,J=17.5Hz,2H,CH2),1.90(d,J=17.2Hz,2H,CH2),1.57(s,2H,CH2);13C NMRδ: 174.07,159.42,158.98,144.06,138.33,129.81,129.09,127.42,122.73,121.44,118.79,114.48,112.92,112.66,112.36,58.67,54.99,26.44,26.08,21.94;IRν: 3404(NH),3024(Ar-H),2954(CH3),2928,2835(CH2),1488(C=S),1602,1571(C=C),1457,1438(Ar,C=C)cm-1;MSm/z: 393.3{[M+H]+}。
3e:淡黄色固体,收率71%,m.p.198℃;1H NMRδ: 9.50(s,1H,NH),9.01(s,1H,NH),7.48(dd,J=93.7Hz,29.2Hz,7H,ArH,C=CH),5.31(s,1H,NCH),1.77(s,2H,CH2),1.54(s,2H,CH2),1.23(s,2H,CH2);IRν: 3373(NH),3178(Ar-H),2965(CH2),1469(C=S),1608,1559(C=C),1406(Ar,C=C)cm-1;MSm/z: 471.6{[M+H]+}。
4a:白色固体,收率87.5%,m.p.221℃;1H NMRδ: 9.35(s,1H,NH),7.84(s,1H,NH),7.15~6.90(m,6H,ArH),6.80(s,1H,CH=C),5.68(s,1H,NCH),3.73(d,J=19.4Hz,12H,OCH3),3.33(s,4H,CH2CCH2),2.28(s,2H,CCH2C);IRν: 3364(NH),3164(Ar-H),2977(CH3),2834(CH2),1633(C=O),1647(C=C),1610,1498(Ar,C=C)cm-1;MSm/z: 437.2{[M+H]+}。
4c:白色固体,收率76%,m.p.246℃;1H NMRδ: 8.03(s,1H,NH),7.25(s,1H,NH),7.15~7.02(m,8H,ArH),6.85(s,1H,CH=C),4.72(s,1H,NCH),2.30(d,J=3.4Hz,6H,CH3),2.03(d,J=17.3Hz,2H,CH2),1.82~1.72(m,2H,CH2),1.59~1.47(m,2H,CH2);IRν: 3234(NH),3092(Ar-H),2925(CH2),2862(CH3),1686(C=O),1604(C=C),1484(Ar,C=C)cm-1;MSm/z: 345.2{[M+H]+}。
6a:淡黄色固体,收率81%,m.p.138℃;1H NMRδ: 8.12(s,1H,NH),7.05~6.88(m,6H,ArH),6.79(s,1H,NH),3.78~3.66(m,12H,OCH3),3.03(s,2H,CH2),2.85(d,J=7.0Hz,2H,CH2);IRν: 3439(NH),3011(Ar-H),2850(CH3),2921,2828(CH2),1669(C=O),1622(C=C),1498,1463(Ar,C=C)cm-1;MSm/z: 423.6{[M+H]+}。
1.3 抗氧化活性测试
以无水乙醇为溶剂,Ⅰ为阳性对照,配制c为2mg·mL-1的待测药液。取c为0.04mg·mL-1的DPPH无水乙醇1.0mL,分别加入(0,30,60,90,120,150,180,210,240,270和300)μL待测药液,加无水乙醇溶液至总体积为2.0mL。混匀后室温放置,分别在3h,14h和24h用UV-Vis测定其在517nm处的吸光度(Ai)。同法测定DPPH与1mL无水乙醇混合后的吸光度(A0),以及待测药液(0,30,60,90,120,150,180,210,240,270和300)μL与无水乙醇混合后的吸光度(Aj),计算自由基清除率[(CL)/%=1-(Ai-Aj)/A0×100%]。
2 结果与讨论
2.1 微波合成法与传统合成法比较
研究表明[9],在传统合成反应中,化合物活性较低,第一步反应时间超过24h,副产物多,中间体2a~2e和5a收率仅20%。第二步反应数天仍不能反应完全,而且随反应时间延长,新的副产物不断生成,增加分离纯化的难度,收率约30%~35%。本文采用的微波辐射法合成,反应时间只需6min~9.6min,第一步反应收率达65%以上;第二步反应中尿素比硫脲所需时间稍长,收率较高。综合对实验方法的研究,得出合成新型姜黄素类似物的最适条件为:于80℃~85℃微波照射(400W)6min~9.6min。
2.2 抗氧化能力比较
DPPH作为一种稳定的有机自由基,物质对DPPH的清除率常用于评价该物质的抗氧化能力。3,4和6及Ⅰ在不同时间的自由基清除率见表1。由表1可见,3的自由基清除能力比4和6强。表明在姜黄素母核结构羰基位置增加含氮、含硫基团,可使其共轭效应更强,与两侧苯环具有更好的共平面性,有效地提高了化合物的抗氧化能力。
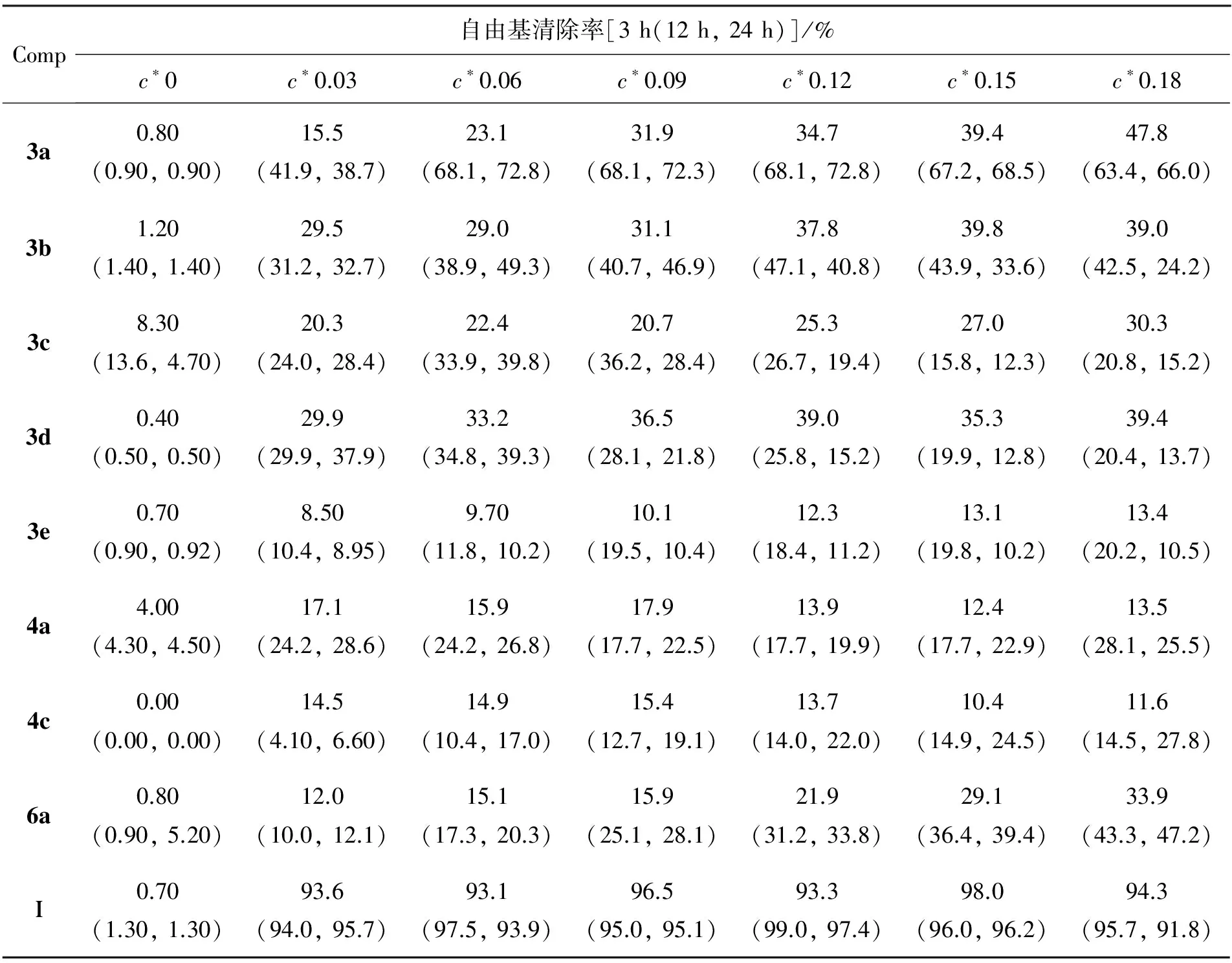
表1 化合物在不同时间的自由基清除率(n=3)Table1 The antioxidant capacities of the compounds at different time (n=3)
c*mg·mL-1
从表1还可以看出,随用药量的增大,化合物的抗氧化能力呈现先增强后下降的趋势,并在用药量为0.09mg·mL-1~0.12mg·mL-1时自由基清除率达最大;随着抗氧化时间的延长,药物对自由基清除率不断提高。
3 结论
采用微波法合成了8个新型的姜黄素类似物(3a~3e,4a,4c和6a)。与传统合成方法相比,该方法缩短了反应时间,提高了反应收率。
抗氧化活性研究结果表明,3的自由基清除能力比4和6强;随用药量的增大,抗氧化能力先增强后下降,并在用量为0.09mg·mL-1~0.12mg·mL-1时自由基清除率达最大。
[1] Bharat B Aqqarwal,Kuzhuvelil B Harikumar.Potential therapeutic effect of curucmin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int J Biochem Cell Biol,2009,41(1):40-59.
[2] Annelyse D,Romain B,Sylvie D,etal.Chemopreventive and therapeutic effects of curcumin[J].Cancer Letters,2005,223(2):181- 190.
[3] Tsuyoshi H,Kenjiro O and Masahito Y.Review:Curcumin and Alzheimer′s Disease[J].CNS Neuroscience &Therapeutics,2010,16(5):285-297.
[4] Hatcher H,Planalp R,Cho J,etal.Curcumin:From ancient medicine to current clinical trials[J].Cell Mol Life Sci,2008,65:1631-1652.
[5] Anna Paravhikova,Kim N Green,Curt Hendrix,etal.Formulation of a medical food cocktail for Alzheimer′s disease:Beneficial effects on cognitive and neuropathology in a mouse model of the disease[J].PLoS One,2010,5(11):e14015.
[6] Aynun N Begum,Mychica R Jones,Giselle P Lim,etal.Curcumin structure-function,bioavailability,and efficacy in models of neuroinflammation and Alzheimer′s Disease[J].J Pharmacol Exp Ther,2008,326(1):196-208.
[7] 孔幸珊,陈明弟,喻丽红,等.新型含氮含硫姜黄素类似物的微波合成及抗氧化活性研究[J].化学研究与应用,2013,25(4):507-512.
[8] Jovanovic S V,Boone C W,Steenken S,etal.How curcumin works preferentially with water soluble antioxidants[J].J Am Chem Soc,2001,123(13):3064-3071.
[9] Wang Y J,Pan M H,Cheng A L,etal.Stability of curcumin inbuffer solutions and characterization of its degradation products[J].J Pharm Biomed Anal,1997,15(12):1867-1876.
[10]2a:黄色晶体,收率90%,m.p.146℃;1H NMRδ: 7.93(s,2H,CH=C),7.02~6.68(m,6H,ArH),3.80(d,J=9.2Hz,12H,OCH3),2.83(d,J=5.2Hz,4H,CH2CCH2),1.84~1.64(m,2H,CCH2C);IRν: 3063(Ar-H),2999,2987(CH3),2946,2832(CH2),1662,1602(C=O),1582(C=C),1493,1464(Ar,C=C)cm-1;MSm/z: 395.2{[M+H]+}.2b:黄色方晶,收率92%,m.p.143℃;1H NMRδ: 7.90(s,2H,CH=C),7.26~7.19(m,8H,ArH),2.79~2.71(m,4H,CH2CCH2),2.34(s,6H,CH3),1.75~1.67(m,2H,CCH2C);IRν: 3022(Ar-H),2983,2858(CH3),2933,2838(CH2),1666,1613,1601(C=C),1582,1480(Ar,C=C)cm-1;MSm/z: 303.2{[M+H]+}.2c:黄色片状固体,收率91.5%,m.p.90℃;1H NMRδ: 7.77(s,2H,CH=C),7.33~7.16(m,8H,ArH),2.96~2.89(m,4H,CH2CCH2),2.39(s,6H,CH3),1.78(dt,J=12.4Hz,6.3Hz,2H,CCH2C);IRν: 3004(Ar-H),2937,1863(CH3),2916,2836(CH2),1662(C=C),1600(C=O),1579,1482(Ar,C=C)cm-1;MSm/z: 303.3{[M+H]+}.2d:黄色固体,收率91.5%,m.p.146℃;1H NMRδ: 7.77(s,2H,C=CH),7.08~6.87(m,8H,ArH),3.84(dd,J=6.0Hz,1.4Hz,6H,OCH3),2.97~2.89(m,4H,CH2CCH2),1.85~1.76(m,2H,CCH2C);IRν: 3072(ArH),2864(CH3),2937,2834(CH2),1662,1602(C=O),1576(C=C),1488,1455(Ar,C=C)cm-1;MSm/z: 335.3{[M+H]+}.2e:黄色固体,收率53%,m.p.128℃;1H NMRδ: 7.78(s,2H,C=CH),7.49~7.28(m,6H,ArH),2.90(d,J=7.7Hz,6H,CH2CH2CH2);IRν: 3057(Ar-H),2924,2837(CH2),1606(C=O),1667,1576(C=C),1559,1489(Ar,C=C)cm-1;MSm/z: 412.1{[M+H]+}.5a:橘黄色针状固体,收率91%,m.p.125℃;1H NMRδ: 7.96(s,2H,CH=C),6.86(d,J=9.0Hz,6H,ArH),3.82(d,J=14.3Hz,12H,OCH3),3.03(s,4H,CH2CH2);IRν: 3002(Ar-H),2909(CH3),2935,2834(CH2),1617(C=O),1687,1597(C=C),1580,1491(Ar,C=C)cm-1;MSm/z: 381.2{[M+H]+}.
MicrowaveSynthesisandAntioxidantActivitiesofNovelCurcuminAnalogues
ZHANG Chao,CHEN Ming-di
(School of Pharmacy,Guangzhou Medical University,Guangzhou 510182,China)
The intermediate analogues,2,6-diphenyl methylene cyclohexyl ketone(2a~2e)or 2,5-diphenyl methylene cyclopentl ketone(5a),were synthesized by Claisen-Schmidt condensation reaction of aromatic aldehyde with cyclohexanone or cyclopentanone.Eight novel curcumin analogues(3a~3e,4a,4cand6a)were synthesized by Biginelli reaction of2a~2eor5awith urea or thiourea under microwave irradiation.The structures were characterized by1H NMR,13C NMR,IR and MS.The antioxidant activities of3~6were investigated by DPpHmethod.The results showed that the antioxidant abilities of3~6were higher than curcumin mother structure,and3was higher than4and6.The antioxidant abilities increase at first and then decrease with increasing of the dosage,and reach the maximal value at 0.09mg·mL-1~0.12mg·mL-1.
curcumin analogues;microwave irradiation;synthesis;antioxidant activity
2014-05-07
广东省高等学校学科建设专项项目(2013KJCX0151)
张超(1964-),男,汉族,广东兴宁人,副教授,主要从事药物化学和天然药物化学的研究。Tel.020-81340672,E-mail: chao-zh@163.com
O626.4
A
1005-1511(2014)05-0582-05

