新型8-位取代腺苷衍生物的合成*
张逸伟,吴泽秋,林东恩,廖 能
(华南理工大学 化学与化工学院,广东 广州 510640)
·快递论文·
新型8-位取代腺苷衍生物的合成*
张逸伟,吴泽秋,林东恩,廖 能
(华南理工大学 化学与化工学院,广东 广州 510640)
以腺苷为原料,经溴代反应制得8-溴-腺苷(2);2与单取代芳酰基哌嗪经取代反应合成了5个新型的8-位取代腺苷衍生物,其结构经1H NMR和ESI-MS表征。
腺苷;哌嗪;合成
核苷类似物是一类重要的抗肿瘤抗病毒药物,对核苷修饰改性是近年的研究热点之一[1-3]。腺苷(1)作为核苷的成员之一,具有极好的生物活性,在心血管疾病的诊断与治疗方面发挥着重要的作用[4]。1的类似物也具有良好的生物活性,如:氯法拉滨、克拉利滨、S-腺苷甲硫氨酸和阿糖腺苷等[5-7],均具有较好的抗肿瘤活性。此外,8-氯-腺苷和8-氨基-腺苷这样的8-位取代腺苷衍生物也被证明具有极高的抗肿瘤活性[8-9]。
芳酰基哌嗪具有良好的生物活性,是抗高血压药物α-受体阻滞剂发挥药理作用的成分[10],也是抗肿瘤药物的重要结构[11-12]。本文利用结构拼合原理,以1为原料,经溴代反应制得8-溴-腺苷(2);2与单取代芳酰基哌嗪经取代反应合成了5个新型的8-位取代腺苷衍生物(5a~5e,Scheme 1),其结构经1H NMR和ESI-MS表征。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未校正);Bruker AVANCE Digital 400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker maxic Impact-Agilent 1290型质谱仪。
所用试剂均为分析纯或化学纯。
1.2 合成
(1)2的合成
在单口烧瓶中依次加入15.0g(18.7mmol),溴4.5g(28.0mmol)和乙酸-乙酸钠缓冲溶液(0.5mol·L-1,pH 4.0)250mL,搅拌下于室温反应24h。加入适量亚硫酸钠除去过量的溴,用10%氢氧化钠溶液调至pH 8;过滤,滤饼依次用水和异丙醇洗涤,于50℃干燥得黄色固体25.38g,产率83.1%,m.p.210℃~212℃;1H NMR(DMSO-d6)δ:8.13(s,1H,2-H),7.58(s,2H,NH2),5.84(d,J=6.8Hz,1H,1′-H),5.50(dd,J=8.6Hz,3.9Hz,1H,5′-OH),5.47(d,J=6.3Hz,1H,3′-OH),5.24(d,J=4.5Hz,1H,2′-OH),5.10(dd,J=11.9Hz,6.4Hz,1H,2′-H),4.20(td,J=4.8,2.4Hz,1H,3′-H),3.98(m,1H,4′-H),3.69(m,1H,5′-H),3.53(m,1H,5′-H);ESI-MSm/z:346.0{[M+H]+}。
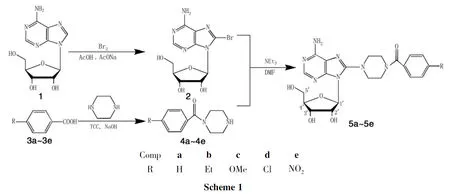
(2)4a~4e的合成(以4a为例)
在单口烧瓶中依次加入氢氧化钠0.80g(20mmol),苯甲酸3a4.64g(20mmol)及混合溶剂[V(乙腈)∶V(水)=3∶2]70mL,搅拌使其溶解;加入三聚氯氰(TCC)1.12g(6.67mmol),于室温反应15min得溶液A。
于0.5h内向A中滴加哌嗪2.58g(30mmol)的乙腈(20mL)溶液,滴毕,反应0.5h。过滤,滤液于50℃旋蒸除去大部分乙腈,剩余溶液用2mol·L-1盐酸调至pH 2,用二氯甲烷(2×20mL)萃取,水层用10%氢氧化钠溶液调至pH 10。用二氯甲烷(4×20mL)萃取,合并有机层,依次用10%碳酸钠溶液(2×10mL)和水(10mL)洗涤,无水硫酸钠干燥,减压除溶得黄色液体4a,收率59.5%;1H NMRδ:7.42(m,5H,ArH),3.77(s,2H,CH2),3.44(s,2H,CH2),2.93(s,2H,CH2),2.85(s,2H,CH2);ESI-MS m/z:191.1{[M+H]+}。
以3b~3e替代3a,用类似的方法合成4b~4e。
4b:黄色液体,收率62.7%;1H NMRδ:7.33(m,4H,ArH),4.01(br s,4H,CH2),3.27(br s,4H,CH2),2.71(q,J=8.0Hz,2H,CH2CH3),1.27(t,3H,J=8.0Hz,CH3);ESI-MSm/z:219.2{[M+H]+}。
4c:黄色液体,收率65.2%;1H NMRδ:7.39(d,J=8.0Hz,2H,ArH),6.92(d,J=8.0Hz,2H,ArH),3.84(s,3H,OCH3),3.63(br s,4H,CH2),2.88(br s,4H,CH2);ESI-MSm/z:221.1{[M+H]+}。
4d:黄色液体,收率58.3%;1H NMRδ:7.47(m,4H,ArH),3.63(br s,4H,CH2),3.10(br s,4H,CH2);ESI-MSm/z: 225.1﹛[M+H]+﹜。
4e:黄色固体,收率44.6%,m.p.152℃~154℃;1H NMRδ:8.28(d,J=8.0Hz,2H,ArH),7.58(d,J=8.0Hz,2H,ArH),3.78(br s,2H,CH2),3.34(br s,2H,CH2),2.97(br s,2H,CH2),2.82(br s,2H,CH2);ESI-MSm/z:236.1{[M+H]+}。
(3)5a~5e的合成(以5a为例)
在单口烧瓶中依次加入4a1.9g(10mmol),22.29g(6.67mmol),三乙胺0.68g(6.67mmol)和DMF 15mL;搅拌下于110℃(回流)反应10h。冷却至室温,加水60mL,静置1h;过滤,滤饼依次用水和异丙醇洗涤,用乙醇重结晶得5a。
用类似的方法合成5b~5e。
5a:白色固体,收率81.8%,m.p.181℃~182℃;1H NMRδ:8.04(s,1H,2-H),7.47(m,5H,PhH),7.09(s,2H,NH2),5.79(dd,J=9.2Hz,J=3.2Hz,1H,1′-H),5.73(d,J=7.3Hz,1H,5′-OH),5.44(d,J=6.9Hz,1H,3′-OH),5.21(d,J=4.4Hz,1H,2′-OH),5.05(d,J=5.5Hz,1H,2′-H),4.18(m,1H,3′-H),3.96(m,1H,4′-H),3.66(m,1H,5′-H),3.53(m,1H,5′-H),3.35(br s,4H,CH2),3.21(br s,4H,CH2);ESI-MSm/z:456.0{[M+H]+}。
5b: 白色固体,收率84.0%,m.p.189℃~190℃;1H NMRδ:8.00(s,1H,2-H),7.33(m,4H,ArH),7.09(s,2H,NH2),5.79(dd,J=9.3Hz,J=3.1Hz,1H,1′-H),5.72(d,J=7.3Hz,1H,5′-OH),5.43(d,J=6.9Hz,1H,3′-OH),5.21(d,J=4.5Hz,1H,2′-OH),5.05(dd,J=12.4Hz,J=6.9Hz,1H,2′-H),4.18(m,1H,3′-H),3.96(m,1H,4′-H),3.67(m,1H,5′-H),3.53(m,1H,5′-H),3.36(br s,4H,CH2),3.20(br s,4H,CH2),2.65(q,J=7.5Hz,2H,CH2CH3),1.21(t,J=7.6Hz,3H,CH3);ESI-MSm/z:484.1{[M+H]+}。
5c: 白色固体,收率83.2%,m.p.195℃~196℃;1H NMRδ:8.00(s,1H,2-H),7.40(m,2H,ArH),7.09(s,2H,NH2),7.01(m,2H,ArH),5.78(dd,J=9.2Hz,J=3.2Hz,1H,1′-H),5.73(d,J=7.3Hz,1H,5′-OH),5.43(d,J=6.8Hz,1H,3′-OH),5.21(d,J=4.5Hz,1H,2′-OH),5.05(dd,J=12.4Hz,J=6.9Hz,1H,2′-H),4.18(m,1H,3′-H),3.96(m,1H,4′-H),3.81(s,3H,OCH3),3.67(m,3H,5′-H),3.52(m,1H,5′-H),3.34(br s,4H,CH2),3.20(br s,4H,CH2);ESI-MSm/z:486.1{[M+H]+}。
5d:白色固体,收率90.7%,m.p.180℃~181℃;1H NMRδ:8.03(s,1H,2-H),7.55(m,5H,ArH),7.19(s,2H,NH2),5.78(dd,J=9.2Hz,3.2Hz,1H,1′-H),5.72(d,J=7.2Hz,1H,5′-OH),5.42(d,J=6.7Hz,1H,3′-OH),5.20(d,J=4.0Hz,1H,2′-OH),5.06(dd,J=12.3Hz,J=6.4Hz,1H,2′-H),4.18(m,1H,3′-H),3.96(m,1H,4′-H),3.67(m,1H,5′-H),3.52(m,2H,5′-H),3.38(br s,4H,CH2),3.22(br s,4H,CH2);ESI-MSm/z:490.2{[M+H]+}。
5e:黄色固体,收率87.3%,m.p.212℃~213℃;1H NMRδ:8.31(d,J=8.8Hz,2H,ArH),8.03(s,1H,2-H),7.74(d,J=8.8Hz,2H,ArH),7.08(s,2H,NH2),5.77(dd,J=9.3Hz,J=3.3Hz,1H,1′-H),5.71(d,J=7.3Hz,1H,5′-OH),5.42(d,J=6.8Hz,1H,3′-OH),5.20(d,J=4.5Hz,1H,2′-OH),5.05(dd,J=12.4Hz,J=7.0Hz,1H,2′-H),4.18(m,1H,3′-H),3.95(m,1H,4′-H),3.66(m,1H,5′-H),3.52(m,1H,5′-H),3.40(br s,4H,CH2),3.16(br s,4H,CH2);ESI-MSm/z:501.1{[M+H]+}。
2 结果与讨论
在4的合成中,分别考察了溶剂(乙腈、丙酮、四氢呋喃和二氧六环)对4收率的影响。实验结果表明,以乙腈作为溶剂时,4的收率最高。
合成2时,缓冲体系对收率影响很大,缓冲体系的pH大于7时,2收率几乎为0;最终选择pH 4.0的乙酸-乙酸钠为缓冲体系。
5的合成需要在碱催化下进行,如果不加入三乙胺,反应将无法进行完全。本文也曾尝试使用甲醇或乙醇代替DMF作溶剂,但结果表明,常压下反应程度均较低;仅在封管中进行时,才能反应完全,且收率与DMF为溶剂时相近。温度对5收率的影响也比较大,温度过低,反应不完全,温度过高,副反应增加。
3 结论
本文创造性地将具有良好生物活性的腺苷与单取代芳酰基哌嗪拼合在一起,合成了5个新型的8-位取代腺苷衍生物。该方法具有合成路线简便,操作简单,后处理方便,收率较高等优点,可为新型核苷类药物的合成提供参考。
[1] Robak T.New nucleoside analogs for patients with hematological malignancies[J].Expert Opinion on Investigational Drugs,2011,20(3):343-359
[2] 张贵琴,王志敏,郑爱萍.核苷类抗乙型肝炎病毒药物研究进展[J].国际药学研究杂志,2013,40(1):8-13
[3] 张逸伟,刘子奇,林东恩.新型5′-脱氧核苷衍生物的合成[J].合成化学,2012,20(3):349-351
[4] 朱文玲.腺苷在心血管病诊治中的应用前景[J].中华心血管病杂志,2004,32(10):948-951
[5] Tran H,Yang D.Clofarabine in the treatment of newly diagnosed acute myeloid leukemia in older adults[J].The Annals of Pharmacotherapy,2012,46(1):89-96
[6] Schreiner T L,Miravalle A.Current and emerging therapies for the treatment of multiple sclerosis: Focus on cladribine[J].Journal of central nervous system disease,2012,4:1-14
[7] 万红贵,郭一丹,蔡恒,等.S-腺苷甲硫氨酸研究进展及市场应用分析[J].现代生物医学进展,2008,8(10):1951-1955
[8] 刘畅,李文娟,陈瑜,等.8-氯腺苷诱导的组蛋白H3K79双甲基化促进NBS1和p21的基因转录激活[J].中国生物化学与分子生物学报,2009,25(11):1035-1040
[9] Polotskaia K,Hoffman S,Krett N L,etal.8-amino-adenosine activates p53-independent cell death of metastatic breast cancers[J].Molecular Cancer Therapeutics,2012,11(11):2495-2504
[10] 廖新成,屈凌波,王文州,等.芳氧基-芳酰基哌嗪取代乙胺丙醇类α,β受体双阻滞剂的合成[J].中国药物化学杂志,2003,13(03):25-28
[11] Ketan M.Synthesis and screening of 2-[2-(4-substituted piperazine-1-yl)-5-phenylthiazol-4-yl]-3-aryl quinazolinone derivatives as anti cancer agents[J].Journal of drug discovery and therapeutics,2013,1(7):84-89
[12] 赵圣印,邵志宇,谢志雄.3-哌嗪基-吲哚马来酰亚胺化合物及其制备和应用[P].CN102924437,2013.
SynthesisofNovel8-SubstitutedAdenosineDerivatives
ZHANG Yi-wei,WU Ze-qiu,LIN Dong-en,LIAO Neng
(School of Chemistry and Chemical Engineering,South China University of Technology,Guangzhou 510640,China)
Five novel 8-substituted adenosine derivatives were synthesized by the substitution reaction ofN-aroyl-piperazine with 8-bromoadenosine prepared by bromination reaction from adenosine.The structures were characterized by1H NMR and ESI-MS.
adenosine;piperazine;synthesis
2013-08-30;
2014-07-25
张逸伟(1965-),男,汉族,广东普宁人,副教授,主要从事精细化学品的合成研究。E-mail: chyiwei@scut.edu.cn
O629.7
A
1005-1511(2014)06-0789-04

