双氯芬酸钠滴眼液有关物质检测方法研究
★ 胡奕军 胡奕勤
(1.抚州市第三医院 江西 抚州 344000;2.抚州市餐饮服务监督所 江西 抚州 344000)
双氯芬酸钠滴眼液临床用于治疗葡萄膜炎、角膜炎、巩膜炎,抑制角膜新生血管的形成,治疗眼内手术后、激光滤帘成形术后或各种眼部损伤的炎症反应,抑制白内障手术中缩瞳反应;用于准分子激光角膜切削术后止痛及消炎;治疗春季结膜炎、季节过敏性结膜炎等过敏性眼病,预防和治疗白内障及人工晶体术后炎症及黄斑囊样水肿,以及青光眼滤过术后促进滤过泡形成等。双氯芬酸钠滴眼液作为一种经典非甾体抗炎制剂,其抗炎作用与地塞米松相同,无激素类副作用,并且还能有效缓解疼痛,在国内该品种一直按新药转正标准[1]控制产品质量。但该质量标准未对有关物质进行直接控制。为了进一步控制该产品的质量,我们建立了双氯芬酸钠滴眼液有关物质的检测方法。在该色谱系统中双氯芬酸钠滴眼液的有关物质二氯苯基吲哚酮、双氯芬醇、双氯芬醛和其他杂质均能较好分离,通过在溶剂峰后扣除抑菌剂色谱峰,并控制完成检测的时间,即能有效控制产品质量。
1 仪器与试药
1.1 仪器 Agilent1100高效液相色谱仪(安捷伦科技有限公司),AEG-45SM半微量电子分析天平(SHIMADZU)。
1.2 试药 双氯芬酸钠对照品:经105℃干燥3h,批号:100334-200302;双氯芬酸钠滴眼液:自制样品,批号:110301,110302,110303;试剂:磷酸、醋酸为分析纯;甲醇为色谱纯,水为注射用水。
2 试验方法与结果
2.1 色谱条件 用十八烷基硅烷键合硅胶为填充剂,以0.03mol/L磷酸溶液-0.2%醋酸(V/V)甲醇溶液(33∶67)为流动相,流速为1mL/min;检测波长为222nm,柱温为室温,理论塔板数按双氯芬酸钠计不低于3000。
2.2 溶液的制备 各单独辅料溶液的制备:按双氯芬酸钠滴眼液处方中各个辅料用量分别配制各单独辅料溶液。
完整空白辅料溶液的制备:按双氯芬酸钠滴眼液处方中完整辅料用量配制完整空白辅料溶液。
原料溶液的制备:取双氯芬酸钠原料适量,加水稀释成每1mL中约含双氯芬酸钠1mg的溶液作为原料溶液。
2.3 测定法 精密量取样品3mL,置25mL量瓶中,用流动相稀释至刻度,摇匀,作为供试品溶液;精密量取供试品溶液1mL,置100mL量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液A;精密称取苯扎氯铵适量,加水制成0.01%的溶液,精密量取3mL,置25mL量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液B。取对照溶液A 20μL注入液相色谱仪,调节检测灵敏度,使主成分峰的峰高约为满量程的10%;另取对照溶液B、供试品溶液20μL分别注入液相色谱仪,记录色谱图至主峰保留时间的2倍,供试品溶液色谱图中如在溶剂峰后出现杂质峰,应扣除苯扎氯铵峰。(注:供试品溶液应在2h内完成测定)
2.4 方法学研究
2.4.1 检测波长的选择 用样品在220~800nm的范围内进行紫外扫描,可知其在220~336nm均有吸收。为了优化有关物质的检测波长,参照双氯芬酸钠滴眼液新药转正标准[1]中的含量测定波长、溶液颜色检测波长和有关文献的色谱条件,分别在222nm、254nm、276nm、420nm对辅料溶液和样品溶液的供试品溶液进样检测,结果样品在276nm和420nm均未检出有关物质;样品在222nm、254nm均检出有关物质,分别按面积归一化法计算其有关物质含量依次为0.927%、0.806%,即在222nm检出的有关物质的含量明显大于254nm检出的有关物质的含量,且有关物质检出的个数也更多。参照庆大霉素双氯芬酸钠滴眼液质量标准[2]选择222nm为有关物质检测波长。
2.4.2 溶剂峰和辅料峰确认实验
2.4.2.1 实验方法 (1)分别精密量取3mL各单独辅料溶液、完整空白辅料溶液、滴眼剂样品(批号:110303),分别置25mL量瓶中。(2)分别加流动相于上述25mL量瓶中,稀释至刻度,摇匀,作为待测液。(3)分别取流动相、各单独辅料溶液、完整空白辅料溶液、滴眼剂样品的待测液20μL注入液相色谱仪,记录色谱图至主成分峰保留时间的两倍。

图1 流动相HPLC图

图2 氯化钠溶液HPLC图

图3 硼酸溶液HPLC图

图4 硼砂溶液HPLC图

图5 聚山梨酯80溶液HPLC图

图6 依地酸二钠溶液HPLC图

图7 苯扎氯按溶液HPLC图

图8 空白辅料溶液HPLC图

图9 滴眼剂样品(立即进样)

图10 滴眼剂样品(1h后进样)

图11 滴眼剂样品(2h后进样)
2.4.2.2 溶剂峰和辅料峰的确认分析 (1)溶剂峰的确认分析。流动相色谱图中出现两个色谱峰,保留时间分别为2.2min、5.32min;氯化钠溶液色谱图、硼酸溶液色谱图、硼砂溶液色谱图、聚山梨酯80溶液色谱图、依地酸二钠溶液色谱图、苯扎氯铵溶液色谱图、完整空白辅料溶液色谱图、滴眼剂样品色谱图中均在2.2min、5.3min出现色谱峰,保留时间一致。因此可以确认,在滴眼剂样品有关物质检查的色谱图中2.2min、5.3min处的色谱峰为溶剂峰,见图1~图12。(2)辅料峰的确认分析,见表1。
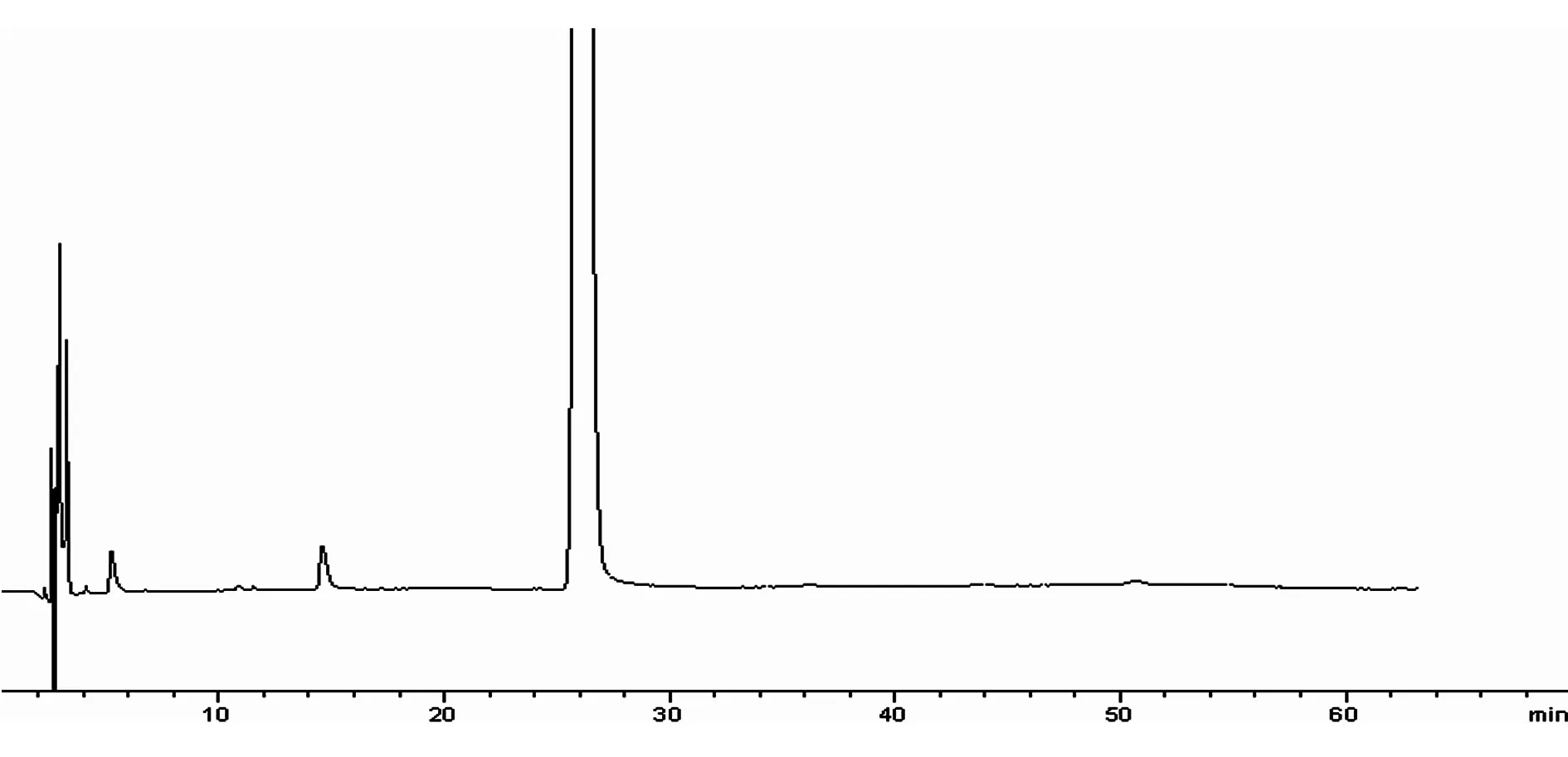
图12 滴眼剂样品(3h后进样)
表1 各辅料峰的保留时间结果(min)

供试品溶剂峰保留时间辅料峰保留时间(相对保留时间)氯化钠溶液5.32.2、2.6、2.9、3.2、4.1硼酸溶液5.22.9、3.4、4.1硼砂溶液5.32.2、2.9、4.1聚山梨酯80溶液5.32.9、3.5、4.1依地酸二钠溶液5.32.6、2.8、2.9、3.4、4.1苯扎氯铵溶液5.32.2、2.9、3.4、4.1、15.0完整空白辅料溶液5.32.2、2.6、2.8、2.9、3.2、3.4、4.1、15.0滴眼剂样品(立即进样)5.32.2、2.6、2.8、2.9、3.2、3.4、4.1、14.9(0.57)滴眼剂样品(1h后进样)5.32.2、2.6、2.8、2.9、3.2、3.4、4.1、14.7(0.57)滴眼剂样品(2h后进样)5.32.2、2.6、2.8、2.9、3.2、3.4、4.1、14.7(0.56)滴眼剂样品(3h后进样)5.32.2、2.6、2.8、2.9、3.2、3.4、4.1、14.6(0.56)
综上所述,除苯扎氯铵外其他辅料的色谱峰都在5.3min之前出峰,为了便于扣除辅料峰,可以用溶剂峰(流动相色谱图中最后一个色谱峰)来扣除苯扎氯铵之外的辅料峰;另外滴眼剂样品色谱图中苯扎氯铵的保留时间均出现在溶剂峰和主峰之间,故需要用苯扎氯铵溶液作为对照的方法来扣除苯扎氯铵峰。
2.4.3 专属性考察
2.4.3.1 实验方法 (1)分别精密量取3mL原料溶液、空白辅料溶液、滴眼剂样品各2份分别置25mL量瓶中,其中一份进行破坏试验,另一份不进行破坏以作参照。(2)分别加流动相于上述25mL量瓶中,稀释至刻度,摇匀,作为待测液。(3)分别取空白辅料溶液、原料溶液、滴眼剂样品溶液的待测液20μL注入液相色谱仪,记录色谱图至主成分峰保留时间的两倍。
2.4.3.2 降解产物色谱峰 光降解破坏条件:置紫外灯下4000LX照射24h;热降解破坏条件:沸水浴加热24h;氧化降解破坏条件:加入10%双氧水2mL,放置24h;酸降解破坏条件:加入1mol/L盐酸溶液1mL,混匀后放置24h,加入1mol/L氢氧化钠溶液1mL中和;碱降解破坏条件:加入1mol/L氢氧化钠1mL,混匀后放置24h,加入1mol/L盐酸溶液1mL中和。经试验证明:原料和样品各经剧烈条件破坏试验产生的杂质之间、杂质与双氯芬酸钠色谱峰均能有效分离,且保留时间均在主峰保留时间的2倍之内,色谱系统专属性较好。
2.4.4 检测限测定 取双氯芬酸钠对照品适量,精密称定,加流动相溶解制成每1mL中含双氯芬酸钠0.0998mg的溶液,再分别稀释成100倍、1000倍、10000倍溶液,取20μL注入液相色谱仪,测得最小检知量0.1996ng(S/N>3,检测溶度:9.98ng/mL)。样品检测的进样溶度为120 000ng/mL,即样品检测的进样量是最小检知量的12 000倍,符合有关规定。
2.4.5 待测样液的稳定性 将上述滴眼剂样品(批号:110303)的待测液分别在配制后立即进样、1h后进样、2h后进样、3h后进样检测有关物质,结果见表2。

表2 待测样液的稳定性结果(min)
综上所述,待测样液在2h内测定,色谱图出现两个杂质峰;待测样液在2h后测定,色谱图出现三个杂质峰,即在相对保留时间1.9倍处多出现一杂质峰,提示待测样液在2h内稳定,因此待测样液应在2h内完成测定。这可能与流动相的PH值有关,因为双氯芬酸钠在酸性条件下不太稳定。

表3 三批样品有关物质测定结果
2.5 样品的有关物质测定 根据上述确定的方法,对三批样品进行有关物质测定,结果见表3。
3 讨论
3.1 应将流动相色谱图中最后一个色谱峰确认为溶剂峰 由于流动相中有机相比例较高,在进流动相确认溶剂峰时要做到进的流动相与色谱系统中的流动相完全一致,否则由于流动相中有机相的挥发会导致流动相中水相比例相对增高,从而导致流动相色谱图中出现两个色谱峰,保留时间分别为2.976min、5.326min。同时由于氯化钠溶液、硼酸溶液、硼砂溶液、聚山梨酯80溶液、依地酸二钠溶液、苯扎氯铵溶液、完整空白辅料溶液、滴眼剂样品的待测液中的溶剂与流动相相比并不是完全一致,水相比例相对增高,因此其均在2.9min和5.3min出现色谱峰。考虑各地水质差异和有关辅料(除苯扎氯铵外)的色谱峰都在5.3min之前出峰,为了便于扣除辅料峰,应将流动相色谱图中最后一个色谱峰确认为溶剂峰。
3.2 与有关标准中有关物质检测方法的比较 有关文献[2]中只是简单的控制二氯苯基吲哚酮、双氯芬醇、双氯芬醛这3个已知杂质的量,既没有考虑到抑菌剂可能对有关物质检查的干扰,也没有对可能产生的其他有关物质进行控制,同时对待测样液的稳定性的考察有明显的不足,即该方法不能有效地控制产品的有关物质。本有关物质检测方法,通过增加抑菌剂对照的办法解决了抑菌剂对有关物质检查的干扰;按照国内外有关物质研究指导原则的要求,通过控制其他杂质不得超过0.1%,有效地提高了该滴眼液的安全性;通过控制完成检测的时间,避免了对产品有关物质的误检出和误判。
总之,采用本高效液相色谱法,通过检测波长、溶剂峰和辅料峰确认、专属性、检测限、待测样液的稳定性等研究,证明本方法切实可行,可用于双氯芬酸钠滴眼液有关物质的检测。
[1]国家药典委员会编.新药转正标准.第30册:134,标准号:WS1-(X-059)-2002Z.
[2]国家食品药品监督管理局.庆大霉素双氯芬酸钠滴眼液注册标准,标准号:YBH03812007.

