初始pH值对废水反硝化脱氮的影响
赵 樑,倪伟敏,贾秀英,周 霞
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
硝态氮废水如果不经处理就排放到水体中,会给水环境带来一系列的危害:水体富营养化,水生生物大量死亡,破坏水域生态系统的平衡;硝态氮在人体肠道中可以被还原成亚硝酸盐,亚硝酸盐对人和生物体有致癌作用[1].生物反硝化技术能把硝态氮通过异养反硝化菌转化为氮气排放去除,业已用来去除硝态氮废水.现有研究多把反硝化技术和硝化技术、厌氧氨氧化技术以及脱硫除磷技术耦合起来研究[2-4],单独研究反硝化技术的很少.影响反硝化过程的因素很多,如微生物组成[5]、碳源种类[6-11]、碳源数量[5,12]、pH[13-14]、温度[15-16]和C/N[12,15,17]等,pH对反硝化速率的影响尤为重要.大多数报道[14,18]研究pH对反硝化过程的影响时,pH范围一般设定在6~9.本研究把pH的范围设定为4~10,深入研究不同pH值对反硝化过程的影响程度及抑制机理,以期为废水生物反硝化脱氮提供合适的反应条件和合理的工艺参数.
1 材料与方法
1.1 实验装置与运行
本实验采用的实验装置(图1)为有机玻璃制造,直径100 mm,高400 mm,有效容积3.8 L,并且外围有水浴恒温套,保证反应所需温度.以葡萄糖为碳源,实验污泥先经过一段时间的反硝化驯化以达到一定的反硝化能力.实验开始之前把驯化好的污泥用清水洗去大部分可溶性碳源和杂质,分离出沉降性能较好的反硝化污泥,污泥上清液水质特征见表1.

表1 反硝化污泥上清液特征

1、2、3—污泥取样口;4—搅拌桨;5—进泥口;6—水浴套进水口;7—水浴套出水口;8—排泥口.

1.2 模拟废水
实验模拟废水包括了氮源、磷源及少量的微量元素,所用药品等级为分析纯.反应过程中添加一定量的NaNO3溶液(10 g/L)使反应器内的硝态氮质量浓度为55.5 mg/L(偏差小于2 mg/L),同时添加少量KH2PO4、CaCl2、MgSO4以及Mn、Zn、I和B等微量元素.
1.3 分析项目与方法

1.4 反硝化速率计算公式
根据文献[22],废水中硝态氮反硝化过程可用式(1)表示:
(1)

(2)
反硝化过程中硝态氮的比反硝化速率:
(3)
亚硝态氮的比反硝化速率(有硝态氮时):
(4)
亚硝态氮的比反硝化速率(无硝态氮时):
(5)
式中CX为微生物质量浓度,即MLVSS,g/L.

CN-CN0=-KdenCXt.
(6)

2 结果与讨论
2.1 不同初始pH值下N的变化规律
在反硝化过程中,反应器中的TN包含硝态氮、亚硝态氮、氨氮和有机氮等,在本实验反应过程中氨氮的质量浓度小于0.5 mg/L,可以忽略不计.由图2a可知:反应8 h后,pH=8时TN残余量仅为3.51 mg/L,其他pH条件下TN残余量都大于10 mg/L,且酸性条件下的TN残余量大于碱性条件,pH=4时残余最多,为48.71 mg/L.反应经过8 h后,初始pH=4、5、6、7、8、9和10时反硝化过程中的TN去除率分别为37.39%、70.09%、80.48%、85.22%、95.54%、86.48%和80.74%,随着pH的增加,呈现出先增大后减小的趋势,TN最大去除率出现在pH=8时.由此看出,TN的去除率受到pH的影响,表现为酸性或碱性越强抑制程度越大.

图2 不同初始pH下反硝化过程中N的变化规律
反硝化过程中硝态氮的降解主要包括两步:①在硝态氮还原酶作用下还原为亚硝态氮;②亚硝态氮在亚硝态氮还原酶作用下还原为一氧化氮或氮气.不同pH条件对硝态氮还原酶、亚硝态氮还原酶和微生物细胞活性的抑制程度不同,因而对硝态氮的去除率和亚硝态氮的积累率影响也不同.一般来说,活性污泥反硝化系统的最佳pH在7.5左右,pH=6.5,9时硝态氮的去除率将为最佳去除率的70%左右,超过该范围时硝态氮的去除率将急剧下降[24].本实验条件下反硝化最佳pH在8,pH=6,9时硝态氮的去除率为最佳去除率90%左右(图2b).硝态氮与TN的去除率变化一致,都随pH先增大后减小(图2c).本实验中可溶性有机氮降解不明显,pH≥6时亚硝态氮积累明显(图2d),造成了TN与硝态氮的去除差异.

图3 不同初始pH下亚硝态氮最大积累率
不同pH值下反硝化过程中亚硝态氮的积累程度不同,是由于反应中亚硝酸盐还原酶和硝酸盐还原酶在不同pH下活性不同.由图2d可见,pH>6时亚硝态氮积累量大于5 mg/L,积累效应明显,并且随着pH的增加积累量增加至21.15 mg/L;亚硝态氮最大积累量出现的时间随pH的增大而延长.反硝化过程亚硝态氮的最大积累率与pH之间呈良好的指数关系(图3).酸性条件下亚硝态氮的积累率变化不明显,小于5%,碱性条件下亚硝态氮的积累率变化较大,由8%增加到22%.
Glass等[25]对高浓度硝酸盐废水反硝化过程的研究结果表明,反硝化过程在不同pH范围内按照不同的机理进行:当pH<7时,硝态氮反硝化完全;pH在7.5~9.0时,亚硝态氮积累明显.傅金祥等[26]研究常温下pH对反硝化过程的影响时发现,反应前2 h内pH=8.5时亚硝态氮积累率是pH=7.1时的1.2倍.Glass等[25]研究了pH对高浓度硝态氮反硝化过程的影响,结果表明pH=9时的亚硝态氮最大积累量是pH=7.5时的4.3倍.可见pH大于一定值后会出现亚硝态氮的积累.究其原因,pH升高时,亚硝态氮随着硝态氮的降解而积累效应增强,随后又不断地被降解,至残余量很低,说明碱性条件的影响只能延缓亚硝态氮的降解速度而不能得到稳定的亚硝态氮[27].本实验结果表现为酸性条件对亚硝态氮还原酶的抑制作用明显,碱性条件对亚硝态氮还原酶抑制作用不明显.
2.2 不同初始pH值下△TOC和△TOC/△TN的变化规律
从图4a可以看出,随pH的增加,TOC消耗量先增大后减小,且变化幅度逐渐减小,最大消耗量出现在pH=8时,为279.44 mg/L.据研究[25],酸性条件对碳源降解过程中乙酰辅酶A和丙酸脱氢酶活性的抑制作用大于碱性条件,造成反硝化过程中供电子不足,因此,酸性条件下TOC的消耗量小于碱性条件,本实验中最适pH值为8.由图4b可知,经过8 h反应后,pH=4、5、6、7、8、9、10时反硝化过程中△TOC/△TN分别为7.19、4.26、3.95、3.86、3.71、3.97和4.37.一般而言,△TOC/△TN越小,碳源用于污泥生长所占的比重就越大,污泥活性也越高[11].pH=8时,△TOC/△TN最小,说明此时污泥活性最大,最有利于反硝化的进行.

图4 不同初始pH值下△TOC和△TOC/△TN的变化规律
2.3 不同初始pH值下反硝化动力学研究
利用反硝化脱氮零级模型对反硝化动力学进行研究,根据式(6),以CN-CN0为纵坐标、时间t为横坐标,不同pH下CN-CN0与t的线性关系见图5.由于本实验条件下,整个反硝化过程中硝态氮降解一直持续到反应结束,因此由式(2)~(5)可计算得到硝态氮和亚硝态氮的转化速率以及比反硝化速率(表2).

表2 不同初始pH值下的比反硝化速率
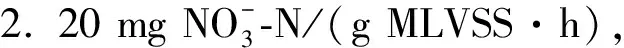

图5 不同初始pH下CN-CN0随t的变化规律

图6 不同初始 pH下比反硝化速率变化规律
徐亚同[28]研究了反硝化污泥在驯化和未驯化时不同pH值对反硝化速率的影响,发现无论反硝化污泥是否经过驯化,pH值从6.0升高到9.5时,反硝化速率先增加后减小,最大反硝化速率出现在pH=7.5,本实验结果反映的规律与其相似.其原因是过酸过碱条件均对反硝化过程有影响.酸性条件抑制原因,根据姜体胜等[29]的研究,当pH值低于6时,反硝化受到强烈抑制,在pH为4.7时,污泥已经恶化,微生物酶的活性降低,导致细胞结构破坏,出现解絮现象,影响反硝化过程的进行.而碱性条件下抑制原因,根据张志等[30]的研究,当pH高于9时,反硝化过程中产生碱度,破坏了厌氧微环境反硝化过程的酸碱平衡,使平衡向着不利于反硝化产碱的方向偏移,抑制反硝化速率.本实验对pH影响的研究结果表明,最适宜的反硝化pH为7~8.

2.4 pH值对反硝化过程抑制机理的分析
对于废水厌氧反硝化过程,pH值是一个非常重要的环境条件,其影响主要表现在两个方面:①影响微生物细胞内的电解质平衡,改变细胞内环境的渗透压,直接影响微生物的活性甚至决定其能否存活;②影响溶液中基质或抑制物的浓度,从而间接影响生物体的活性[31].

Drysdale等[34]对反硝化菌群做了进一步的研究,根据缺氧条件下微生物对硝态氮和亚硝态氮的还原能力不同,将生物活性污泥系统中异养微生物分成了5类:①真正的反硝化菌,能还原硝态氮和亚硝态氮;②不完全反硝化菌,只能将硝态氮还原到亚硝态氮阶段;③不完全亚硝态氮还原菌,可还原硝态氮和亚硝态氮,但硝态氮浓度会抑制该类细菌;④亚硝态氮专性还原菌,只能还原亚硝态氮;⑤非反硝化菌,不能还原硝态氮和亚硝态氮.因此在反硝化过程中微生物优势菌的比例及反硝化能力的不同会使得硝态氮和亚硝态氮的还原速率之间存在差异,进而引起不同程度的亚硝态氮积累.从本实验的研究结果看,比反硝化速率在pH=8时达到最大,亚硝态氮的积累程度随着pH升高而增大.因此在本实验反硝化系统中,酸性条件下亚硝态氮专性还原菌的活性较强,分解亚硝态氮的能力也较强,亚硝态氮积累不多,同时反硝化速率也很低;碱性条件下不完全反硝化菌的活性较强,亚硝态氮积累较多.pH值对硝态氮还原酶和亚硝态氮还原酶都有抑制作用,但酸性pH对亚硝酸还原酶抑制作用更大,碱性pH对硝态氮还原酶抑制作用更大,所以随着pH值的增加硝态氮反硝化速率与亚硝态氮反硝化速率的差值越来越大.
3 结 论
1)pH=8时,硝态氮的去除率达到99.43%, pH=4,10时硝态氮的去除率仅为pH=8时的35%和 85%,酸性条件下反硝化过程的抑制程度比碱性条件大.pH越低,对亚硝态氮还原酶的抑制作用越强,亚硝态氮的积累率也越高,但pH只能延缓亚硝态氮的降解速度而不能使亚硝态氮稳定积累,反应结束后亚硝态氮基本能去除.TN的变化规律和硝态氮相似,碱性条件下的去除率高于酸性条件下的去除率.
2)pH=8时,TOC的消耗量最大,为279.44 mg/L;△TOC/△TN值最小,为3.71,此时反硝化效率最大,最有利于反硝化的进行.

4)pH值对反硝化过程的抑制主要是通过改变反应微环境中酸碱平衡,进而改变反硝化菌细胞内电解质平衡并影响硝态氮还原酶、亚硝态氮还原酶和碳源降解过程中的各种酶的活性,从而影响反硝化菌的活性和碳源的利用效率.pH过酸或过碱对反硝化过程都有抑制作用,但抑制途径不同,主要体现在酸性条件对亚硝态氮还原酶的抑制作用较大,碱性条件对硝态氮还原酶的抑制作用较大,最佳的pH值在7~8.
[1] Forman D .Nitrate exposure and human cancer[M]//Bogardi I,Kuzelka R D. Nitrate contomination. Berlin: Springer,1991:281-288.
[2] 王朝朝,李军.自养硝化与异养反硝化污泥膜污染特性的对比[J].中南大学学报:自然科学版,2013,44(6):2629-2636.
[3] 林华淮,廖德祥,耿安朝.厌氧氨氧化与反硝化协同脱氮研究进展[J].广州化工,2013,41(11):3-4.
[4] 袁莹,周伟丽,王晖,等.不同电子供体的硫自养反硝化脱氮实验研究[J].环境科学,2013,34(5):1835-1844.
[5] Lee D Y,Ramos A, Macomber L,etal. Taxis response of various denitrifying bacteria to nitrate and nitrite[J].Applied and Environmental Microbiology,2002,68(5):2140-2147.
[6] 沈志红,张增强,王豫琪,等.生物反硝化去除地下水中硝酸盐的混合碳源研究[J].环境科学学报,2011,31(6):1263-1269.
[7] 阎宁,金雪标,张俊清.甲醇与葡萄糖为碳源在反硝化过程中的比较[J].上海师范大学学报:自然科学版,2002,31(3):41-44.
[8] 高景峰,彭永臻,王淑莹,等.不同碳源及投量对SBR法反硝化速率的影响[J].给水排水,2001,27(5):55-58.
[9] 谭佑铭,罗启芳.不同碳源对固定化反硝化菌脱氮的影响[J].卫生研究,2003,32(2):95-97.
[10] 赵庆彬,毕学军,臧海龙,等.不同碳源对活性污泥反硝化能力的影响研究[J].环境工程,2013,31(5):127-131.
[11] 殷芳芳,王淑莹,昂雪野,等.碳源类型对低温条件下生物反硝化的影响[J].环境科学,2009,30(1):108-113.
[12] 侯红娟,王洪洋,周琪.进水COD浓度及C/N值对脱氮效果的影响[J].中国给水排水,2005,21(12):19-23.
[13] Thomsen J K, Geest T, Cox R P. Mass spectrometric studies of the effect of pH on the accumulation of intermediates in denitrification byParacoccusdenitrificans[J]. Applied and Environmental Microbiology,1994,60(2):536-541.

[15] 郑兰香,鞠兴华.温度和C/N比对生物膜反硝化速率的影响[J].工业安全与环保,2006,32(10):13-15.
[16] 马娟,彭永臻,王丽,等.温度对反硝化过程的影响以及pH值变化规律[J].中国环境科学,2008,28(11):1004-1008.
[17] 杨殿海,章非娟.碳源和碳氮比对焦化废水反硝化工艺的影响[J].同济大学学报:自然科学版,1995,23(4):413-416.
[18] 周海红,王建龙,赵璇.pH对以PBS为反硝化碳源和生物膜载体去除饮用水源水中硝酸盐的影响[J].环境科学,2006,27(2):290-293.
[19] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[20] 张业明,彭宝香,陈志量,等.TOC分析仪在化学有机污染物中的监测与应用[J].装备环境工程,2007,4(1):52-55.
[21] 杨蕾,侯英,王保兴,等.梯度淋洗/离子色谱法对烟草及烟草制品中7种无机阴离子的快速测定[J].分析测试学报,2010,29(2):165-170.
[22] 袁怡,黄勇,邓慧萍,等.C/N比对反硝化过程中亚硝酸盐积累的影响分析[J].环境科学,2013,34(4):1416-1420.
[23] 叶建锋.废水生物脱氮处理新技术[M].北京:化学工业出版社,2006:18-32.
[24] 沈耀良,王宝贞.废水生物处理新技术:理论与应用[M].北京:中国环境科学出版社,1999:215-217.
[25] Glass C, Silverstein J. Denitrification kinetics of high nitrate concentration water: pH effect on inhibition and nitrite accumulation[J]. Water Research, 1998, 32(3): 831-839.
[26] 傅金祥,韩晋英,齐建华,等.常温下pH对短程硝化反硝化的影响[J].沈阳建筑大学学报:自然科学版,2010,26(2):316-320.
[27] 曹相生,付昆明,钱栋,等.甲醇为碳源时C/N对反硝化过程中亚硝酸盐积累的影响[J].化工学报,2010,61(11):2938-2943.
[28] 徐亚同. pH、温度对反硝化的影响[J].中国环境科学,1994,14(4):308-313.
[29] 姜体胜,杨琦,尚海涛,等.温度和pH值对活性污泥法脱氮除磷的影响[J].环境工程学报,2007,1(9):10-14.
[30] 张志,任洪强,张蓉蓉,等.pH值对好氧颗粒污泥同步硝化反硝化过程的影响[J].中国环境科学,2005,25(6):650-654.
[31] 杨洋,左剑恶,沈平,等.温度、pH值和有机物对厌氧氨氧化污泥活性的影响[J].环境科学,2006,27(4):691-695.
[32] Focht D D, Verstraete W. Biochemical ecology of nitrification and denitrification[M]//Alexander M. Advances in microbial ecology. New York:Plenum Press,1977:135-214.
[33] 曾庆武.反硝化细菌的分离筛选及应用研究[D].武汉:华中农业大学,2008.
[34] Drysdale G D, Kasan H C, Bux F. Assessment of denitrification by the ordinary heterotrophic organisms in an NDBEPR activated sludge system[J]. Water science and technology,2001,43(1):147-154.

