大麦类病斑突变体bspl1的遗传及生理生化分析
孙 扬,陆文怡,张 艳,王广洋,孙佳丽,薛大伟,张晓勤
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
大麦(HordeumvulgareL.)是世界上最主要和古老的栽培作物之一,具有生育期短、早熟、抗逆性强以及适应性广等优点,是全球种植面积仅次于玉米、小麦和水稻的谷类作物[1],也是遗传学模式植物之一.植物类病斑突变体(lesion mimic mutant,LMM)是指植物在没有明显损伤、逆境胁迫或者外界病原物侵染的条件下,能够在叶片、叶鞘或者整株上自发形成坏死斑的一类突变体[2].研究发现有些类病斑突变体的发生与正常生理功能或细胞发育有关,有些却与植物抗病抗逆的防卫反应紧密相关[3].这些类病斑坏死突变体的表型与植物在防卫过程中的过敏反应很相似,不少LMM在类病斑坏死形成之前或之后还表现出对病原物局部或系统抗性的增强,并且表现出与细胞程序性死亡 (programmed cell death,PCD) 有关[4],由此推测类病斑坏死突变体和过敏反应可能具有一些共同的形成机制.
大麦突变体研究为大麦分子遗传学研究、基因功能分析和种质资源创新提供有价值的材料[5].与水稻相比,大麦类病斑突变体目前研究较少.类病斑突变体中的局部组织坏死是一种在没有病原菌侵染条件下自发形成的程序性细胞死亡,这种遗传上的缺陷往往会导致植株对病虫的抗性增强和防卫基因的组成型表达,研究植物类病斑突变体坏死斑的形成机制对理解植物细胞程序性死亡的信号传导途径和抗病机理具有重要意义,同时对选育抗病性状的材料来改良农作物品种有积极的推动作用.在前期工作中,本课题组从大麦浙农大3号(ZJU3)的EMS突变体库中鉴定到一个典型的类病斑坏死突变体[5],命名为bspl1(barley spotted leaf 1),该突变体从苗期开始叶片上会自发出现红棕色的类病斑,至分蘖期后类病斑不再变大且不导致叶片枯死,不影响植株抽穗、结实.本研究对bspl1进行了生理和遗传的初步分析,以期为今后该突变体基因的克隆及病斑形成的分子机制研究奠定基础.
1 材料与方法
1.1 实验材料
EMS诱变产生的类病斑突变体bspl1以及野生型大麦ZJU3.
1.2 抗氧化酶测定方法
分别取种植3、5、7周的bspl1和对照组ZJU3各3株,选取同一时期的叶片,混合后称取0.5 g鲜样加8 mL 0.05 mol/L PBS(pH7.8)于冰浴中研磨,4 ℃下1 000 r/min离心20 min,取上清液用于超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性测定,所有测定重复3次.
SOD活性测定采用氯化硝基四氮唑蓝(NBT)光还原法;POD活性测定采用愈创木酚氧化法;CAT活性测定采用紫外吸收法.
1.3 类病斑性状的遗传分析

2 结 果
2.1 大麦类病斑突变体遗传分析
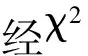
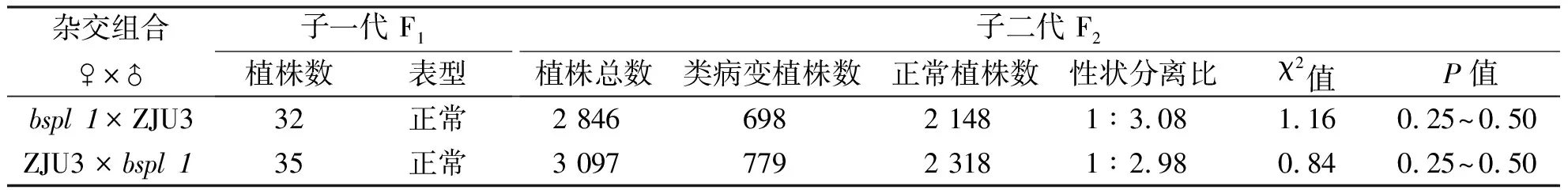
表1 突变体bspl1与野生型ZJU3有性杂交试验结果
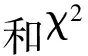

表2 突变体bspl1与Morex有性杂交试验结果
2.2 类病斑突变体生理分析
2.2.1 超氧化物歧化酶活性
SOD是细胞内自由基清除系统中一个关键性酶,在保护细胞器免遭活性氧(ROS)损害中起至关重要的作用,是衡量植物衰老的良好指标.测定超氧化物歧化酶活性的结果如图1a所示,突变体bspl1的SOD活性在播种后5~7周较ZJU3明显增高,由11.8 U/g(鲜质量,以下同)升至18.5 U/g.而ZJU3的SOD活性则始终维持在10 U/g左右.
2.2.2 过氧化物酶活性
过氧化物酶广泛存在于植物体中,是活性较高的一种酶,与呼吸作用、光合作用及生长素的氧化等都有关系.在植物生长发育过程中它的活性不断发生变化,一般在老化组织中活性较高,幼嫩组织中活性较弱.实验发现早衰减产的水稻根系中过氧化物酶的活性增加[6],所以过氧化物酶可作为组织老化的一种生理指标.由图1b可知,bspl1的POD活性随着时间的推移逐步增大,在7周后达到22.2 U/g,而ZJU3的POD活性几乎保持不变.这表明由于突变体中活性氧含量提高,过氧化物酶被激活而活性提高,加快了活性氧清除机制.

图1 bspl1与ZJU3的SOD、POD及CAT活性
2.2.3 过氧化氢酶活性
过氧化氢酶是植物重要的保护酶之一,主要存在于乙醇酸循环体、过氧化物酶体及其它细胞器中,专一作用于H2O2,是植物体内清除H2O2的主要酶类.过氧化氢酶活性测定结果(图1c)表明,与野生型相比,突变体在3周以后过氧化氢酶的活性有了较大的提高,从3.6 U/g提高至6.2 U/g,表明由于突变体中活性氧含量提高,过氧化氢酶被激活而活性提高,加快了活性氧清除机制.
3 讨 论
大麦类病斑突变体bspl1是经EMS诱变处理而产生的叶片散布红棕色的类病斑突变体.其性状经多代自交繁殖,已能稳定遗传.从bspl1与ZJU3以及bspl1与Morex的正反交结果看出F1代均表现为正常植株,F2代则出现类病变植株,且类病变突变体植株数与正常植株数的比例为1∶3.F2代的性状分离比说明稳定后的突变体植株的类病斑遗传是符合孟德尔分离定律的,故可确定该类病变突变受一对隐性核基因控制.
很多复杂的原因可导致植物形成类病斑,既可能是基因突变引起的,也可能与外界环境如光照、温度、湿度和养分等相关.随着越来越多LMM基因被发现、克隆与功能分析,植物类病斑突变体坏死斑表型形成机制的研究也越来越深入,目前已知的类病斑形成机制有以下几种:1)抗病基因的改变或过量表达.抗病基因的突变或者信号传导途径的改变引起细胞过敏反应,从而导致大量的细胞程序性死亡,产生类病斑.例如番茄过量表达Pto基因[7]、玉米RPL位点[8]的突变导致类病斑的产生.2)植物的正常代谢途径发生紊乱.研究发现叶琳代谢途径中一系列催化酶基因发生突变可能引起植物产生类病斑[9].3)PCD失控导致植物类病斑坏死的发生.拟南芥Isd1突变体中,LSD1编码的一个锌指蛋白,对植物防卫反应和PCD起负调控作用;Kim等[10]发现水稻中的OsACD R1基因能编码Raf-like有丝分裂原活化蛋白激酶激酶(MAPKKK),该激酶过量表达可诱导水稻叶片出现类病斑.4)环境因素(如光照、温度与湿度等)的改变导致部分植株类病斑的形成.王建军等[11]对6个类病斑表型的突变体材料进行遮光实验,发现光源、温度均影响类病斑的形成.5)水杨酸、茉莉酸和乙烯等激素以及其他信号转导因子也和植物类病斑坏死的形成有关系.研究发现拟南芥类病斑突变体Isd6和Isd7中的水杨酸在类病斑的形成中起了关键作用[12].6)与ROS、自由基有关.许多类病斑突变体都显示在病斑周围有ROS的积累.玉米类病斑突变体les22类病斑的形成是由于ROS造成的[13].
Dangl等[14]在1996年已证实了类病斑不是由病原菌导致的,而是植物程序性细胞死亡的产物.因此,类病斑突变体开始受到了广泛的关注,并成为研究植物抗病性机制及程序性细胞死亡途径的重要实验材料.在类病斑出现时,许多突变体都伴有与病原菌侵染相关物质的组成性表达,包括酚类物质的积累、胼胝体的沉积、植保素水平的上升以及活性氧中间代谢物(reactiveoxygenin termediate,ROI)的产生等,这些物质具有抵抗或抑制病原菌的作用,尤其是ROI能直接杀死病原菌并启动过敏反应[15].在水稻类病变中也普遍存在着在类病斑的周围出现H2O2或O2-的过量积累[16-17].ROI的积累可能是其生物合成途径中的某些关键酶(如NADPH氧化酶)的活性失调所引起.本实验结果显示,突变体植株bspl1的 SOD、POD、CAT 活性都明显高于野生型植株,可见突变体植株中活性氧的积累明显.这些结果表明,bspl1的类病斑的发生与细胞程序性死亡有关.
[1] 卢良恕.中国大麦学[M].北京:中国农业出版社,1996.
[2] Johal G S, Hulbert S H, Griggs S P. Disease lesion mimics of maize: a model for cell death in plants[J]. BioEssays,1995,17(8):685-692.
[3] He Z H. Signal network of plant disease resistance[J]. Acta Phytophysiologica Sinica,2001,27(4):281-290.
[4] Kang S G, Matin M N, Bae H,etal. Proteome analysis and characterization of phenotypes of lesion mimic mutant spotted leaf 6 in rice[J]. Proteomics,2007,7(14):2447-2458.
[5] 张晓勤,薛大伟,周伟辉,等.用甲基磺酸乙酯(EMS)诱变的大麦浙农大3号突变体的筛选和鉴定[J].浙江大学学报:农业与生命科学版,2011,37(2):169-174.
[6] 孙惠敏,潘刚,潘晓华,等.水稻早衰突变体lst的生理分析与基因定位[J].核农学报,2014,28(3):404-411.
[7] Li J X, Shan L B, Zhou J M,etal. Overexpression of Pto induces a salicylate-independent cell death but inhibits necrotic lesions caused by salicylate-deficiency in tomato plants[J]. Molecular Plant-microbe Interactions,2002,15(7):654-661.
[8] Rostoks N, Zale M, Soule J,etal. A barley gene family homologous to the maize rust resistance geneRp1-D[J]. Theoretical and Applied Genetics,2002,104(8):1298-1306.
[9] Hirashima M, Tanaka R, Tanaka A. Light-independent cell death induced by accumulation of pheophorbidea in arabidopsis thaliana[J]. Plant and Cell Physiology,2009,50(4):719-729.
[10] Kim J A, Cho K, Singh R,etal. RiceOsACDR1 (oryza sativa accelerated cell death and resistance 1) is a potential positive regulator of fungal disease resistance[J]. Molecules and Cells,2009,28(5):431-439.
[11] 王建军,张礼霞,王林友,等.水稻类病变(Lesion Resembling Disease)突变体对光照和温度的诱导反应[J].中国农业科学,2010,43(10):2039-2044.
[12] Weymann K, Hunt M, Uknes S,etal. Suppression and restoration of lesion formation in arabidopsislsdmutants[J]. The Plant Cell,1995,7(12):2013-2022.
[13] Hu G, Yalpani N, Briggs S P,etal. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize[J]. The Plant Cell,1998,10(7):1095-1105.
[14] Dangl J L, Dietrich R A, Richberg M H. Death don’t have no mercy: cell death programs in plant-microbe interactions[J]. The Plant Cell,1996,8(10):1793-1807.
[15] Lorrain S, Vailleau F, Balague C,etal. Lesion mimic mutants: keys for deciphering cell death and defense pathways in plants[J]. Trends in Plant Science,2003,8(6):263-271.
[16] Takahashi A, Kawasaki T, Henmi K,etal. Lesion mimic mutants of rice with alterations in early signaling events of defense[J]. The Plant Journal,1999,17(5):535-545.
[17] 王建军,朱旭东,王林友,等.水稻类病变突变体lrd40的抗病性与细胞学分析[J].中国水稻科学,2005,19(2):111-116.

