浸种时间和浸种剂对草地早熟禾种子发芽的影响
王红俊,陈志飞,张 莹,杨云贵,杜书増,郭 婷
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
浸种时间和浸种剂对草地早熟禾种子发芽的影响
王红俊,陈志飞,张 莹,杨云贵,杜书増,郭 婷
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
为了筛选草地早熟禾(Poapratensis)种子最佳的浸种处理,选用10种浸种剂[H2O、20.0% PEG-6000、2.0% NaCl、2.0% CaCl2、2.0% Ca(NO3)2、2.0% KNO3、2.0% KH2PO4、0.5 mmol·L-1SA、0.3% H2O2、0.01% KMnO4]和3个浸种时间(浸种1、2、3 d)共30种浸种处理组合,对各浸种剂、浸种时间及二者的交互作用对种子的发芽和幼苗生长的影响进行评定。结果表明,2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)处理可以显著提高种子的萌发活力(P<0.05),且对幼苗的影响小,尤其以2.0%Ca(NO3)2(浸种2 d)和2.0% KNO3(浸种2 d)的浸种效果最好,可以作为草地早熟禾种子浸种处理优先选用;2.0%NaCl(浸种1 d)、2.0%CaCl2(浸种1、2、3 d)、2.0% KH2PO4(浸种2 d)和0.5 mmol·L-1SA(浸种1、2、3 d)处理虽然可以提高种子的发芽率,但延长了种子的平均发芽时间且幼苗的生长也受到抑制,用于浸种时要慎重;水(浸种1、2、3 d)、20% PEG-6000(浸种1、2、3 d)、2.0% NaCl(浸种1、3 d)、2.0% KH2PO4(浸种1、3 d)、0.3% H2O2(浸种1、2、3 d)和0.01% KMnO4(浸种1、2、3 d)处理的浸种效果不明显,不适宜选用。
草地早熟禾;浸种时间;浸种剂;种子发芽
种子在贮藏过程中生活力会随着贮藏时间的延长而降低以至于失去萌发能力,这是因为在贮藏过程中由于种子自身和外界等因素会逐渐使种子衰老而导致品质劣变,造成种子的萌发能力和萌发速率降低以及幼苗的生长不一致[1-2]。1973年Heydecker等首次提出利用种子浸种引发手段来解决种子萌发缓慢等问题[2-4]。种子浸种引发是通过控制种子吸水的速度和吸水回干的时间来对种子进行播前的预处理,利用浸种处理一方面可以提高种子的发芽率和发芽速率,使出苗整齐;另一方面还能提高种子在萌发过程中对冷害、干旱和盐害等的抵抗能力,促进种子在逆境条件下萌发[5-11]。目前,种子浸种引发已经成为某些蔬菜、花卉种子的常用播前处理技术[4]。
草地早熟禾(Poapratensis)属于禾本科早熟禾属,坪用性状优良,适应能力较强,是当前应用最广泛的冷季型草坪草之一[12-13]。草地早熟禾种子由于一些原因萌发速度较慢且萌发期易受不利因素的影响,在实际生产中可以在播种前对种子进行浸种处理,来提高种子发芽速率和种子萌发过程中的抗逆性,但如果浸种时间和浸种剂选择不合理就会造成处理效果不理想[2],而关于草地早熟禾种子的浸种引发的研究和报道不多。本试验选用10种常用的浸种剂和3种浸种时间共30个浸种处理对草地早熟禾种子进行浸种处理,通过比较各浸种剂和浸种时间对种子发芽和幼苗生长的影响,探寻草地早熟禾种子最佳浸种剂和浸种时间的组合,以期为生产中草地早熟禾种子的浸种处理有所指导。
1 材料与方法
1.1试验材料
试验选用的草地早熟禾为草坪型,品种为优异(Merit),种子由单农种业集团北京代表处于2012年7月提供,种子在常温下避光储存。本试验于2013年7月在西北农林科技大学动物科技学院草业科学实验室进行。
1.2试验方法
试验选用10种常用种子引发的浸种剂和3种浸种时间[3,5-10,14-24],浸种剂分别为H2O、20%PEG-6000、2.0%NaCl、2.0%CaCl2、2.0%Ca(NO3)2、2.0%KNO3、2.0%KH2PO4、0.5 mmol·L-1SA (水杨酸溶液)、0.3%H2O2、0.01%KMnO4;浸种时间均分别为1、2、3 d。试验采用二因素完全随机设计,试验共30个处理及对照组CK。
称取2.0 g草地早熟禾种子置于50 mL的锥形瓶内,分别添加6 mL的各种浸种剂[6],按照对应的浸种时间进行浸种,浸种过程中锥形瓶放在培养箱内[光照0,温度(20±2)℃,相对湿度80%],每6 h摇晃一次锥形瓶[25]。浸种结束后用纱布将种子滤出,并置于自来水下冲洗20 min,再用蒸馏水冲洗5遍,最后将种子转移到铺有双层滤纸的培养皿中,将培养皿(无盖)放置在试验台上回干24 h[26]。
在培养皿内铺双层定性滤纸后进行高压灭菌,再用移液管往培养皿中移3 mL无菌水,每培养皿摆放种子100粒,每浸种组合均重复3次。培养皿放在培养箱中培养,培养箱的条件设定为:光照14 h,光照强度为8 000 lx,温度(25±2)℃,相对湿度70%;黑暗10 h,光照强度0,温度(20±2)℃,相对湿度80%[27]。每天对培养皿经行称重补充散失的水分。
1.3试验测定指标
在种子完成回干后,每处理种子均称取0.1 g置于试管中,加15 mL蒸馏水浸泡24 h,浸泡期间每4 h摇晃一次,各处理均重复3次。在浸泡结束后测定种子浸泡液的电导率(U1),同时测定空白蒸馏水的电导率(U2)。计算各浸种处理种子的电导率(μS·cm-1·0.1 g-1),如公式(1)[28]:
电导率=U1-U2
(1)
从种植后第2天开始每天记录各培养皿内种子的发芽情况,直到第15天试验结束;在第15天从各培养皿中取生长适中的幼苗15株测定芽长和根长;测定完芽长和根长后将培养皿内所有发芽的种子都取出测定幼苗鲜重并记录对应的幼苗数量。计算各处理的发芽势(%)、发芽率(%)、平均发芽天数(d)、发芽指数、活力指数、芽抑制率(%)、根抑制率(%)、幼苗鲜重(mg·株-1),如公式(2)~(9)[3-9,27-31]:
发芽势=n7/M×100%
(2)
发芽率=n15/M×100%
(3)
平均发芽天数=∑Gt×Dt/∑Gt
(4)
发芽指数GI=∑Gt/Dt
(5)
活力指数VI=∑GI×芽长
(6)
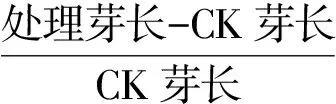
(7)

(8)
幼苗鲜重=ms/m
(9)
式中,n7,n15分别为各处理发芽前7 d和15 d对应的发芽种子总数,M为种子总数(100粒);Gt为第t天的发芽种子数,Dt对应的种子发芽天数;ms为总苗重,m为总幼苗鲜重对应的苗数。
1.4试验数据统计与分析
用Excel 2003对试验数据进行整理,采用SPSS18.0进行分析;采用Duncan法比对各处理间的差异,试验数据表示为平均值±标准误。
2 结果与分析
2.1浸种时间对草地早熟禾种子萌发和幼苗生长的影响
浸种处理可以有效降低种子的电导率,浸种1、2、3 d的电导率均显著低于CK(P<0.05),但不同浸种时间对种子电导率影响不显著(P>0.05),延长浸种时间对种子电导率变化影响不大(表1)。浸种可以显著提高种子的发芽势、发芽率和发芽指数,浸种2 d种子发芽势高达22.13%,较CK(14.33%)提高了54.43%,但浸种1、3 d的发芽势与CK间差异不显著;浸种后种子的发芽率和发芽指数显著的高于CK,浸种2 d的发芽率和发芽指数最大,分别为74.27%和8.58,较CK分别提高了17.89%和30.40%,但浸种时间长短对种子发芽率和发芽指数的影响不显著,浸种1、2、3 d之间的差异不显著。浸种处理对种子的活力指数和平均发芽时间较CK没有明显的改善。
浸种处理后种子幼苗的芽长和根长都不同程度地低于CK,说明浸种处理对幼苗生长产生了抑制。浸种3 d对幼苗芽长的抑制最大,为CK的75.72%;浸种1d对幼苗根长的抑制最大,为CK的90.91%;浸种2d对芽长和根长的抑制最小(表2)。比对各浸种时间处理下幼苗芽、根抑制率可知,浸种处理对幼苗芽的抑制明显大于根。浸种处理可以显著提高幼苗的鲜重(P<0.05),浸种2 d幼苗鲜重最大,为2.38 mg·株-1,较CK(1.88 mg·株-1)增加了26.60%,浸种1、3 d幼苗鲜重均为2.24 mg·株-1,较CK均增加了19.15%。
2.2浸种剂对草地早熟禾种子萌发和幼苗生长的影响

表1 不同浸种时间对草地早熟禾种子萌发的影响Table 1 Influence of seed-soaking on seed germination performance of Poa pratensis
注:同列不同小写字母表示各处理之间在0.05水平上差异显著,下同。
Note: Different lower letters in the same column mean significant difference among different treatments at 0.05 levels.The same below.

表2 不同浸种时间对草地早熟禾幼苗生长的影响Table 2 Influence of seed presoaking on seedling growth performance of Poa pratensis
各浸种剂处理后种子电导率显著低于CK(P<0.05)。不同浸种剂之间的差异较大,2.0%NaCl和2.0%CaCl2的电导率最高,分别为35.22和36.21 μS·cm-1·0.1 g-1,2.0% KNO3和2.0%Ca(NO3)2次之,其余处理的电导率都低于20.00 μS·cm-1·0.1 g-1(表3)。各浸种剂对种子发芽势的影响,仅有2.0%Ca(NO3)2和2.0% KNO3的发芽势显著高于CK,而其他处理的发芽势较CK差异不显著(P>0.05);各浸种剂处理除20%PEG-6000外都能一定程度上提高种子的发芽率;H2O、2.0%CaCl2、2.0%Ca(NO3)2、2.0%KNO3和0.5 mmol·L-1SA处理的发芽指数都显著高于CK,且2.0%Ca(NO3)2和2.0%KNO3的发芽指数都大于11,分别较CK提高了74.32%和76.29%;20%PEG-6000、2.0%NaCl、0.3%H2O2和0.01%KMnO4处理的活力指数显著小于CK,其他处理中仅有2.0%Ca(NO3)2和2.0%KNO3的活力指数显著大于CK;种子的平均发芽天数可以反映种子的发芽速率,平均发芽天数越小表明种子的发芽速率越高,各处理都对种子的平均发芽天数的影响差异较大,仅有2.0%Ca(NO3)2和2.0%KNO3的平均发芽天数小于CK,其余浸种剂(除H2O和0.5 mmol·L-1SA外)平均发芽天数均显著大于CK,所以仅有2.0%Ca(NO3)2和2.0%KNO3可以提高种子的发芽速率。
各浸种剂中仅有2.0%KNO3的芽长与CK间差异不显著(P>0.05),其他浸种剂的芽长显著低于CK(P<0.05);H2O、2.0%Ca(NO3)2、2.0%KNO3和0.5 mmol·L-1SA处理的根长与CK差异不显著,其他浸种剂的根长均显著低于CK。各浸种剂对幼苗根的抑制程度较芽小。各浸种剂处理后种子幼苗鲜重都高于CK,其中2.0%Ca(NO3)2、2.0%KNO3和0.5 mmol·L-1SA处理幼苗鲜重增加较多(表4)。
2.3浸种时间和浸种剂交互作用对草地早熟禾种子萌发和幼苗生长的影响
各浸种处理都显著降低种子的电导率,同一浸种剂(除0.3% H2O2外)浸种2、3 d的电导率均小于浸种1 d的,相同浸种时间不同浸种剂间种子的电导率差异较大,这可能与浸种剂的性质有密切的关系(表5)。
浸种剂和浸种时间的交互作用对早熟禾种子萌发的影响较大。2.0% CaCl2(浸种1 d)、2.0% Ca(NO3)2(浸种1、2、3 d)、2.0% KNO3(浸种1、2、3 d)和2.0% KH2PO4(浸种2 d)处理的发芽势显著高于CK(P<0.05),尤其以2.0%Ca(NO3)2(浸种2d)和2.0% KNO3(浸种2 d)的发芽势最高,分别达到47.00%和48.67%,分别较CK(14.33%)高出32.67和34.34个百分点。各浸种处理中仅20%PEG-6000(浸种1 d)处理的发芽率显著低于CK(63.00%),其他浸种处理对种子的萌发没有显著的抑制作用(P>0.05),其中2.0% NaCl(浸种1 d)、2.0% CaCl2(浸种1 d)、2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)处理的种子发芽率都高于80.00%,特别是2.0% Ca(NO3)2(浸种3 d)和2.0% KNO3(浸种2 d)处理的发芽率均达到91.67%,较CK(63.00%)高出28.67个百分点。浸种处理对种子的发芽指数的影响与发芽率相类似。浸种处理对种子的活力指数和平均发芽时间的影响基本相似,仅有2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)处理的种子活力指数显著高于CK,平均发芽时间显著低于CK,而其他处理对于改善种子活力指数和发芽时间效果不明显。

表3 浸种剂对草地早熟禾种子萌发的影响Table 3 Influence of seed presoaking agents on seed germination performance of Poa pratensis

表4 浸种剂对草地早熟禾种子幼苗生长的影响Table 4 Influence of seed presoaking agents on seedling growth performance of Poa pratensis
浸种处理对种子幼苗生长的影响较大,尤其是对幼苗芽长的影响。各浸种处理中仅有2.0% KNO3(浸种1、2、3 d)的芽长较CK差异不显著(P>0.05),其他处理的芽长都显著低于CK(P<0.05)。因此,除2.0% KNO3外其他浸种处理都一定程度上对幼苗芽的生长产生了显著的抑制作用;而相同浸种处理对种子幼苗根的影响较芽小,仅有个别浸种处理对幼苗根的生长产生显著的抑制。浸种处理对幼苗鲜重的影响基本一致,仅有20%PEG-6000(浸种1 d)和0.3% H2O2(浸种1 d)的幼苗鲜重低于CK,其他浸种处理的幼苗鲜重都高于CK,尤其是2.0% Ca(NO3)2(浸种2 d)、2.0% KNO3(浸种1、2 d)和0.5 mmol·L-1SA(浸种2 d)处理的幼苗鲜重均高于2.60 mg·株-1,较CK(1.88 mg·株-1)增加了38.30%。
3 讨论
成熟种子会在贮存过程中不可避免地发生劣变,种子生活力、萌发率、萌发速度及幼苗生长都会受到影响,贮存时间越长影响就越严重。植物从播种到幼苗形态建成是影响植物能否完成生活史的起点,该过程中种子会遇到很多对萌发和形成健壮、均一幼苗不利因素的影响,而这些影响与植物栽培过程中所需要的种子萌发完全、快速和幼苗生长均一等要求对立[2]。宋松泉等[1]指出,种子在萌发过程中水分的吸收大致可以划分为3个阶段,通过浸种等种子引发处理使种子缓慢地吸水而延长种子处于吸胀的第二阶段的时间,有利于原生质膜的恢复和细胞内物质的转化,进而促进种子的萌发。种子浸种引发即通过控制种子的水合状态,使得水分充足以让萌发前代谢事件发生,但又不使得胚根突破种皮[2]。而经过浸种吸湿-回干处理的种子具有较高的活力水平,在一定程度上可以增强种子在萌发过程中的抗逆能力,种子萌发较快且生长整齐[2]。
种子发生劣变会使得细胞膜结构和功能的完整性受到破坏,如膜透性增加等。在干种子开始吸水时细胞内含物会发生渗漏,向周围水溶液中渗出电解质,而通过测定种子浸泡液的电导率,便可以反映种子的活力水平,即宋松泉等[1]提出的“电导率与种子活力呈负相关”,而蓝茎冰草(Agropyronsp.)种子电导率与种子活力和生活力呈正相关,与种子的老化程度呈负相关[28]。但王彦荣等[32]通过对多种禾本科种子的劣变研究发现,禾本科种子的活力与种子的电导率无显著的相关性。本研究表明,草地早熟禾种子经过浸种处理后电导率显著降低,同一浸种剂随着浸种时间的增加电导率随之降低,但不同浸种剂间差异较大。H2O、0.5 mmol·L-1SA和0.3% H2O2浸种处理的电导率最低,但种子发芽率和发芽速率并不是最好的,2.0% NaCl和2.0% CaCl2处理的电导率较高,而发芽率也不是最好的,且其发芽速率最慢,所以说早熟禾种子的电导率并不能直接反映种子的发芽率和萌发速率。
自来水引发并不能直接提高紫花苜蓿(Medicagosativa)发芽率,但可以通过控制给水等因素进行水引发加快种子萌发,而且自来水引发的效果因种子种类的不同存在差异,在控制给水等条件下水引发的效果并不弱于PEG引发[9]。适宜的浸种温度和浸种时间对早熟禾种子萌发至关重要,一定的变温浸种处理对早熟禾幼苗生长的影响较大[33]。本研究中,水浸种处理后种子的发芽率显著高于CK,浸种效果也优于20%PEG-6000,与上述结论相似。PEG作为植物种子浸种引发剂被广泛使用,关于PEG溶液浸种可以提高种子生活力的研究报道较多,但PEG并非适用于所有种子,采用PEG引发并不能提高辣椒(Capsicumannuum)种子的发芽率[10]。本研究中20%PEG-6000的浸种效果不理想,浸种后种子的发芽情况没有得到改善反而降低,仅浸种3 d处理的发芽率达到CK的水平,但平均发芽天数显著高于CK;总体上讲,20%PEG-6000浸种并未收到预期的效果且表现最差,这可能跟溶液的浓度过大有关,虽能起到渗透调节的作用但影响了种子的呼吸作用,对种子萌发表现出不利。
利用一定浓度NaCl和PEG在适宜温度下对西瓜(Citrulluslanatus)种子进行浸种引发处理,能够提高种子发芽率及缩短种子发芽时间[16]。用0.25%~1.00%的KCl和KNO3对大白菜(Brassicarapapekinensis)种子进行浸种处理后,多数处理有利于种子发芽和出苗,能够提高种子发芽势、发芽率、活力指数及缩短平均发芽天数[3]。用水杨酸和硝酸钙对自然老化的西瓜种子进行浸种处理后,各处理都能显著提高西瓜种子活力[34]。利用PEG浸种只能起到渗透调节的作用,而NaCl在起到渗透调节作用的同时离子还进入细胞内产生一定的作用[7]。这一表述可以用来解释本研究中2.0% NaCl、2.0% CaCl2、2.0% Ca(NO3)2、2.0% KNO3和2.0% KH2PO4浸种后种子的发芽率显著地高于CK和20% PEG-6000的原因。这可能是由于部分无机盐溶液浸种处理后,相关离子进入种子内部,改善了细胞内的微环境,有关离子参与了细胞内的相关生理生化过程,从而有利于种子的萌发。
适宜浓度的水杨酸浸种可以提高高羊茅(Festucaarundinacea)种子的发芽势和发芽率[14],也能够提高花椰菜(Brassicaoleracea)种子的含水量、相关酶的活性和可溶性糖含量从而能促进种子萌发[8],还可以改善低温条件下辣椒种子的萌发率和幼苗生长情况[33]。本研究中,0.5 mmol·L-1SA处理后的种子发芽率和发芽指数得到显著提高,但不能提高种子的发芽速率。高锰酸钾和双氧水被广泛的用于花卉、蔬菜、农作物种子浸种处理,适宜浓度的高锰酸钾溶液浸种可以软化种皮而加快种子出芽,双氧水浸种可以轻度腐蚀种皮,有利于种皮通气和透水,使氧气与水分能顺利透过种皮到达种胚,可以打破种子休眠,促进种子萌发[15]。而种子浸种处理的机制可能是种子在浸种液中,通过溶液可以改变种皮的透性和利用溶液的渗透势来调节种子吸水的过程,种子在浸种过程中完成了某些物质与能量的代谢,而提高种子活力和萌发期对逆境胁迫的抵抗能力。此外,高锰酸钾溶液浸种可以提高陈种子的发芽率和成苗率,这可能是高锰酸钾溶液提高了水中的氧浓度而有利于种子的呼吸,同时钾离子和锰离子进入种子后可以活化细胞内的酶系统,近而促进种子萌发[18]。本研究中0.3% H2O2和0.01% KMnO4处理后种子的发芽情况并没有明显的改善,并且平均发芽天数显著高于CK,没有对种子萌发起到促进作用,这可能因为试验选择的H2O2、KMnO4浓度和浸种时间不适合草地早熟禾种子。
不同的浸种时间对水稻(Oryzasativa)种子的发芽势影响不明显,但对其发芽率有显著影响,浸种时间过短或过长都不利于水稻种子发芽[17]。本研究中不同的浸种剂和浸种时间对草地早熟禾种子萌发和幼苗生长的影响变化较大,各处理中仅有2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)处理的发芽势、发芽率、发芽指数、活力指数都显著高于CK,平均发芽时间显著低于CK,表明2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)可以有效地促进草地早熟禾种子萌发。2.0% NaCl(浸种1 d)、2.0% CaCl2(浸种1、2、3 d)、2.0% KH2PO4(浸种2 d)和0.5 mmol·L-1SA(浸种1、2、3 d)处理的发芽率和发芽指数也显著高于CK,但种子的平均发芽天数大于CK,这8种处理虽能提高种子的发芽率但延缓了种子萌发速率。H2O(浸种1、2、3 d)、20% PEG-6000(浸种3 d)、2.0% NaCl(浸种2、3 d)、2.0% KH2PO4(浸种1、3 d)、0.3% H2O2(浸种1、2、3 d)和0.01% KMnO4(浸种1、2、3 d)的发芽率较CK差异不大,但种子活力指数显著低于CK,种子的平均发芽时间都大于10 d,种子的萌发速率显著降低。20% PEG-6000(浸种1、2 d)处理对种子萌发产生了抑制,该处理种子所有的萌发指标都显著差于CK。因此,在进行种子浸种时要根据种子的种类充分考虑浸种剂和浸种时间,真正地实现利用浸种处理提高种子的萌发活力的目的。正如孙圆圆等[6]指出,种子引发处理虽能提高水分胁迫下种子活力,但种子激发自身对外界萌发环境的协调能力有限,选择有效的引发剂、引发方式和引发时间对种子的引发效果极其重要。
浸种处理有利于种子萌发,还可以影响幼苗生长,这可能是因为在浸种过程中浸种溶液中的无机盐离子或小分子物质进入种子内部,参与细胞内部的物质转换与合成,部分小分子物质或离子还属于植物生长调节剂或营养物质,进而影响幼苗的生长及参与幼苗生长过程中养分的分配。一定浓度的水杨酸浸种有利于高羊茅种子胚芽和胚根生长,还有促根壮苗的作用,这是因为适度的水杨酸能够诱导硝酸还原酶的活性,还能调节种子幼苗的内源生长素/细胞分裂素的水平,使脱落酸维持在低水平,从而有利于根系的生长发育[14]。水、KNO3、KNO3+KH2PO3混合溶液3种浸种剂处理都能促进甜玉米(Zeamays)种子芽鞘和幼苗的生长,有利于种子活力的提高,KNO3+KH2PO3混合溶液处理后效果最好,且低浓度的浸种液可以提高种子活力且有利于种子幼苗生长[35]。一定浓度水杨酸处理有利于促进豌豆(Pisumsativum)种子呼吸,能够促进萌动种子呼吸释放能量,近而提供给幼苗生长[36]。本研究中,各浸种处理对幼苗的影响,仅有2.0% KNO3处理后种子幼苗芽长和根长较CK差异不显著外,其余处理的芽长和根长均受到不利的影响,且芽受到的影响较根大得多,但各处理幼苗鲜重显著高于CK。各处理的幼苗鲜重得到提高,幼苗生长受到抑制且芽的抑制大于根,这可以推测为浸种处理在一定程度上抑制了胚芽和胚根的过快生长,在种子萌发后物质供应总体上趋向于胚根的生长,而幼苗胚根的生长有利于养分和水分的吸收供应,提高幼苗的抗逆性,有利于培养壮苗。
4 结论
通过分析各浸种处理对草地早熟禾种子的电导率、种子萌发和幼苗生长的影响可知:浸种处理可以有效降低种子的电导率,不同浸种处理对种子萌发活力的提高差异较大,各浸种处理均能提高种子幼苗鲜重,但对幼苗的芽和根的生长产生了抑制且对芽的抑制比根大。
通过综合各浸种处理对种子发芽势、发芽率、发芽指数、活力指数、平均发芽天数、芽长、根长和幼苗鲜重的影响,对各浸种处理的浸种效果进行了系统对比和分析得出:2.0% Ca(NO3)2(浸种1、2、3 d)和2.0% KNO3(浸种1、2、3 d)处理可以提高种子萌发,且对幼苗生长的不良影响相对较小,尤其以2.0% Ca(NO3)2(浸种2 d)和2.0% KNO3(浸种2 d)的浸种效果最好,可以作为草地早熟禾种子浸种处理优先选用;2.0% NaCl(浸种1 d)、2.0% CaCl2(浸种1、2、3 d)、2.0% KH2PO4(浸种2 d)和0.5 mmol·L-1SA(浸种1、2、3 d)处理可以提高种子萌发,但会影响种子的萌发速率,且会对幼苗的生长产生抑制,因此在将这些浸种处理用于草地早熟禾浸种时要慎重;H2O(浸种1、2、3 d)、20% PEG-6000(浸种1、2、3 d)、2.0% NaCl(浸种1、3 d)、2.0% KH2PO4(浸种1、3 d)、0.3% H2O2(浸种1、2、3 d)和0.01% KMnO4(浸种1、2、3 d)处理对种子的萌发起到促进作用,且会抑制幼苗生长,因此这些浸种处理不适宜用于草地早熟禾种子的浸种处理。
[1]宋松泉,程红焱,姜孝成.种子生物学[M].北京:科学出版社,2008.
[2]郑光华.种子生理学[M].北京:科学出版社,2004.
[3]王志欣,万中原,栾兆水,张凤,刘美,孙庆泉.大白菜种子钾盐引发效果分析[J].山东农业科学,2013,45(8):47-50.
[4]余友玲,邹明华,叶秀芬,赵德辉,朱军,张文明.钼酸铵溶液引发对大豆种子活力的影响[J].种子,2012,31(3):13-16.
[5]杨小环,王玉国,杨文秀,王宏富.种子引发对水分胁迫下大豆幼苗生理特性的影响[J].中国生态农业学报,2009,17(11):1191-1195.
[6]孙圆圆,孙永健,王明田,李旭毅,郭翔,胡蓉,马均.种子引发对水分胁迫下水稻发芽及幼苗生理性状的影响[J].作物学报,2010,36(11):1931-1940.
[7]马金虎,王宏富,王玉国,李新基,韦献果.种子引发对高粱幼苗耐盐性的生理效应[J].中国农业科学,2009,42(10):3713-3719.
[8]王玉萍,董雯,张鑫,杨茜,张峰.水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响[J].草业学报,2012,21(1):213-219.
[9]刘慧霞,王彦荣.水引发对紫花苜蓿种子萌发及其生理活动的影响[J].草业学报,2008,17(4):78-84.
[10]白占兵,李雪峰,倪向江,张竹青,王端华.种子引发剂对辣椒种子发芽的影响[J].湖南农业科学,2009(1):6-7.
[11]黄淑贤.种子提高植物耐盐性的研究进展[J].河北农业科学,2010,14(7):54-55,67.
[12]韩德梁,余玲,王彦荣.2种野生草地早熟禾坪用性能评价[J].草业科学,2005,22(2):92-95.
[13]边秀举,张训忠.草坪学基础[M].北京:中国建材工业出版社,2005.
[14]赵春旭,刘芳芳,赵韦,刘欣,柴琦,刘照辉.水杨酸浸种对高羊茅在干旱胁迫下萌发的影响[J].草业科学,2011,28(11):1945-1949.
[15]马辉,廖国雄.5种药剂的不同质量浓度处理对小麦陈种子发芽及田间成苗的影响[J].西北农业学报,2012,21(12):43-47.
[16]Patanè C,Cavallaro V,Cosentino S L.Germination and radicle growth in unprimed and primed seeds of sweet sorghum as affected by reduced water potential in NaCl at different temperatures[J].Industrial Crops and Products,2009,30:1-8.
[17]钱春荣,王俊河,冯延江,王麒,于洋,宫秀杰.不同浸种时间对水稻种子发芽势和发芽率的影响[J].中国农学通报,2008,24(9):183-185.
[18]郭群利,胡晋,洪中川.高锰酸钾浸种对杂交水稻种子发芽率、成秧率的影响[J].种子,2007,26(6):87-88.
[19]Wang Q Z,Chen G,Yersaiyiti H,Liu Y,Cui J,Wu C H,Zhang Y W.Modeling analysis on germination and seedling growth using ultrasound seed pretreatment in switchgrass[J].PLoS ONE,2012,7(10):1-10.
[20]Noorbakhshian S J,Nabipour M,Meskarbashee M.Optimization of hydro- and osmo-priming in different seed size of sainfoin (Onobrychisvisiifoliascop)[J].Australian Journal of Basic and Applied Sciences,2011,5(11):1236-1244.
[21]Nejad H A.The effects of seed priming techniques in improving germination and early seedling growth ofAeluropusmacrostachys[J].International Journal of Advanced Biological and Biomedical Research,2013,1(2):86-95.
[22]Renault S,Affifi M.Improving NaCl resistance of red-osier dogwood:Role of CaCl2and CaSO4[J].Plant and Soil,2009,315:123-133.
[23]罗旭辉,詹杰,陈瑞金,陈永怀,黄榕辉,应朝阳.浸种处理对圆叶决明种子萌发的影响[J].草业科学,2011,28(8):1451-1455.
[24]蔺吉祥,李晓宇,张兆军,王俊峰,李卓琳,穆春生.温度与盐碱胁迫交互作用对羊草种子萌发与幼苗生长的影响[J].草地学报,2011,19(6):1003-1009.
[25]陈露.水引发对草地早熟禾(Poapratensis)萌发和出苗的影响[D].兰州:兰州大学,2006:16-17.
[26]梁帅克.无机盐溶液引发对草坪草种子活力及幼苗抗逆性的影响[D].合肥:安徽农业大学,2010:7.
[27]王红俊,郭婷,杨云贵.磷酸根浓度对多年生黑麦草种子萌发和幼苗生长的影响[J].中国农学通报,2013,29(22):203-207.
[28]刘玉荣,韩建国,孙彦,任卫波,王小山.蓝茎冰草种子劣变过程中生理生化变化[J].种子,2007,26(7):10-13.
[29]岳桦,李雪.PEG胁迫对柳叶水干草种子萌发及幼苗的影响[J].草业科学,2013,30(4):571-576.
[30]卢艳敏.不同盐胁迫对高羊茅种子萌发的影响[J].草业科学,2012,29(7):1088-1093.
[31]徐能祥,顾洪如,程云辉,张霞,丁成龙.不同多花黑麦草品种萌发期耐盐性评价[J].草业科学,2011,28(10):1820-1824.
[32]王彦荣,余玲,刘友良.数种牧草种子劣变的生活力与膜透性的关系[J].草业学报,2002,11(3):85-91.
[33]Kormaz,Ahmet.Inclusion of acetyl salicylic acid and methyl jasmonate into the priming solution improves low temperature germination and emergence of sweet pepper[J].Hort.Science,2005,40:197-200.
[34]邢燕,王吉庆,菅广宇,邵秀丽.不同引发剂处理对西瓜种子萌发及生理特性的影响[J].中国农学通报,2009,25(11):133-136.
[35]王芳,赛吾热尼沙.阿布都热西提,芦苇华,白光红,李翠芳,于跃华.引发对甜玉米种子发芽和幼苗生长的影响[J].新疆农业大学学报,2009,32(2):37-40.
[36]王晓多,陆远柱,杨九英.水杨酸浸种对豌豆种子萌发及幼苗生长的影响[J].种子,2007,26(8):42-44.
(责任编辑 武艳培)
InfluenceofsoakingtimesandagentsontheseedsgerminationofPoapratensis
WANG Hong-jun, CHEN Zhi-fei, ZHANG Ying, YANG Yun-gui, DU Shu-zeng, GUO Ting
(College of Animal Sciences and Technology, Northwest A&F University, Yangling 712100, China)
In order to find out the most effective seed soaking methods for bluegrass (Poapratensis), the present research assessed the effects of 30 seed presoaking treatments included 10 seed presoaking agents [H2O, 20% PEG-6000, 2.0% NaCl, 2.0% CaCl2, 2.0% Ca(NO3)2, 2.0% KNO3, 2.0% KH2PO4, 2.0% KH2PO4, 0.5 mmol·L-1salicylic acid (SA), 0.3% H2O2, 0.01% KMnO4] which combined with three soaking time (1 ,2 ,3 d) on seed germination and seedling growth.The 6 treatments of 2.0% Ca(NO3)2and 2.0%KNO3soaking 1, 2 and 3 d significantly improved (P<0.05) seeds germination without significant damage to seedling growth, especially for the two treatments of 2.0%Ca(NO3)2soaking 2 d and 2.0% KNO3soaking 2 d which were recommended for bluegrass seed soaking treatments.The eight treatments of 2.0% NaCl soaking 1 d, 2.0% CaCl2soaking 1, 2 and 3 d, 2.0% KH2PO4soaking 2 d and 0.5 mmol·L-1SA soaking 1, 2 and 3 d improved seed germination rate whereas they had negative effects on seed mean germination period and seedling growth.The treatments of H2O soaking 1, 2 and 3 d, 20% PEG-6000 soaking 1, 2 and 3 d, 2.0% NaCl soaking 2 and 3 d, 2.0% KH2PO4soaking 1 and 3 d, 0.3% H2O2soaking 1, 2 and 3 d, 0.01% KMnO4soaking 1, 2 and 3 d had negative effects on seedling growth which were not recommended for bluegrass seed priming methods.
Poapratensis; seed soaking times; seed soaking agents; seed germination
YANG Yun-gui E-mail:yungui999@163.com
2014-01-15 接受日期:2014-05-20
国家牧草产业技术体系“优质牧草产品标准化生产关键技术”(CARS-35-01A);国家燕麦产业技术体系“燕麦加工利用”(CARS-08-D1)
王红俊(1987-),男,陕西山阳人,在读硕士生,主要从事草坪建植和草坪逆境生理研究。E-mail:wanghongjun516@163.com
杨云贵(1964-),男,甘肃平凉人,副教授,博士,主要从事草坪建植与牧草营养研究。E-mail:yungui999@163.com
S543+.904.1;Q945.34
:A
:1001-0629(2014)11-2095-10
10.11829j.issn.1001-0629.2014-0020

