K+对盐胁迫下罗布麻生长及离子吸收分配的效应
夏曾润,王沛东,贾 文,未 丽,米 莉,王锁民
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室,甘肃 兰州 730020)
K+对盐胁迫下罗布麻生长及离子吸收分配的效应
夏曾润,王沛东,贾 文,未 丽,米 莉,王锁民
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室,甘肃 兰州 730020)
通过温室盆栽试验,研究了低钾(0.01 mmol·L-1)和正常钾(2.5 mmol·L-1)水平对NaCl胁迫下罗布麻(Apocynumvenetum)生长和离子吸收分配的影响。结果表明,随着介质中NaCl浓度的增加,罗布麻的根、茎、叶的生物量和株高呈下降趋势;但相同浓度NaCl处理下,低钾和正常钾之间无显著差异(P>0.05)。罗布麻各器官中Na+含量随介质NaCl浓度的增加显著上升(P<0.05),叶中上升幅度明显大于根和茎;叶和茎中K+随介质NaCl浓度的增加显著下降,但仍维持较高水平,根中K+浓度能保持稳定;低钾和正常钾水平下,与无盐胁迫(对照)相比,50 mmol·L-1NaCl处理植株叶中K+浓度无显著变化。在对照条件下,罗布麻体内积累大量K+,其叶中K+浓度是Na+的15倍多。可见,增强K+的选择性吸收和运输,保持叶部较高的K+含量和K+/Na+比是罗布麻适应盐逆境的重要生理机制。
罗布麻;K+水平;盐胁迫;离子吸收和分配;K+/Na+比
K是维持植物正常生理代谢活动所必需的大量营养元素,它参与并影响着植物的生长发育过程,而且在抵抗非生物胁迫的过程中也发挥着重要作用[1-2]。当前,自然因素及不合理的人类活动导致土壤钾匮乏、盐碱化和次生盐碱化日益突出,直接威胁到农牧业的可持续发展。在低钾及盐渍环境中,植物能够有效地吸收K+,以保持其体内的离子稳态平衡,这对于保持细胞膨压和维持正常的生命活动具有重要意义[3-4]。
罗布麻(Apocynumvenetum)系夹竹桃科(Apocynaceae)多年生宿根草本植物或半灌木,全株含白色粘稠乳汁[5-6],主要生长在盐碱荒地、沙漠边缘、戈壁荒滩及海滨盐碱低湿地带,广泛分布于我国西北、东北、华北和黄河流域,其中以新疆荒漠地区为最佳产地[5-8]。罗布麻是我国西北荒漠地区一种产业化前景良好的兼具生态、经济和药用价值的新兴多用途植物资源,其生态幅度较广,抗逆性强[6,9],在盐碱荒漠化土壤治理和改良方面具有重要的应用价值。近年来,罗布麻的开发利用价值越来越受到人们的重视,众多研究者重点从罗布麻的生长特性[10-11]、地理分布[12]、纤维纺织[13]、生态效益[14]、化学成分[15]及药理作用[16-17]等方面开展了研究工作,但对其耐盐机理尤其是缺钾环境下的抗盐生理机制研究甚少。本研究通过盆栽试验,对比分析低K+和正常K+水平下盐胁迫对罗布麻生长状况、离子吸收及分配特征的影响,初步探讨K+在其耐盐性中的作用,以期为充分开发利用野生罗布麻资源及改良盐碱地提供理论依据。
1 材料与方法
1.1材料培养
试验在兰州大学草地农业科技学院榆中校区智能温室进行。选择同一生态型的罗布麻(小花红麻)为试验材料。罗布麻种子采自新疆维吾尔自治区阿勒泰市阿拉哈克乡(47°44′ N,87°30′ E)。试验用土为黄土∶草炭土=10∶1的混合栽培基质,其水溶性Na+和K+分别为27.71和2.49 μmol·g-1,交换性及可利用非交换性Na+和K+分别为41.36和13.21 μmol·g-1,全氮0.74 mg·g-1,全磷0.95 mg·g-1,有机质1.62%,pH 7.32。
2013年6月,剪下长为3~5 cm的多年生罗布麻根段扦插入草炭土中进行培养。培育1个月后,选取长势基本一致(高约10 cm)的罗布麻幼苗移栽至装有1 kg上述混合栽培基质的塑料花盆(口径14.5 cm,底径10.0 cm,深10.5 cm)中,每盆约15株,在温室条件下培养。温室的相对湿度为(60±5)%,昼夜温度(25±2)℃/(19±2)℃,光照16 h·d-1,光照强度约为800 μmol·m-2·s-1。待幼苗成活生长10 d后间苗,每盆保留长势一致的幼苗8~10株。期间,用调整过的1/2 Hoagland 营养液[2 mmol·L-1KNO3,0.5 mmol·L-1KH2PO4,0.5 mmol·L-1MgSO4·7H2O,0.25 mmol·L-1Ca(NO3)2·4H2O,1.25 mmol·L-1CaCl2·2H2O,60 μmol·L-1Fe-citrate,50 μmol·L-1H3BO3,10 μmol·L-1MnCl2·4H2O,1.6 μmol·L-1ZnSO4·7H2O,0.6 μmol·L-1CuSO4,0.05 μmol·L-1Na2MoO4·2H2O]浇灌两次。
1.2试验处理
将间苗生长1周后的罗布麻幼苗分成两组,即低钾(0.01 mmol·L-1K+)组和正常钾(2.5 mmol·L-1K+)组,每组设3个NaCl梯度处理,共6个处理,每个处理设5个重复,共30盆。低钾组:1)对照(CK1)。用含低钾的1/2 Hoagland营养液(原营养液中KNO3和KH2PO4分别用等浓度HNO3和H3PO4代替,0.01 mmol·L-1K+由KCl补充,调pH=5.7)处理;2)轻度盐胁迫。用含50 mmol·L-1NaCl及低钾的1/2 Hoagland营养液处理;3)重度盐胁迫。用含200 mmol·L-1NaCl及低钾的1/2 Hoagland营养液处理。正常钾组:1)对照(CK2)。用含正常钾的1/2 Hoagland营养液(原营养液中KNO3和KH2PO4分别用等浓度HNO3和H3PO4代替,2.5 mmol·L-1K+由KCl补充,调pH=5.7)处理;2)轻度盐胁迫。用含50 mmol·L-1NaCl及正常钾的1/2 Hoagland营养液处理;3)重度盐胁迫。用含200 mmol·L-1NaCl及正常钾的1/2 Hoagland营养液处理。每3 d浇灌处理液一次,每次浇灌量为300 mL。
各处理梯度采取完全随机区组摆放,处理5周后(共浇灌11次),当低钾重度盐胁迫幼苗叶出现轻微发黄时,开始取样及测定相关指标。
1.3测定指标及方法
1.3.1株高和生物量 采用常规方法,胁迫处理5周后每盆挑选5株长势相当的幼苗测定株高、鲜重和干重。根冠比(g·g-1)=根干重/地上部干重。
1.3.2植物器官中Na+、K+离子含量 参照Wang等[18]的方法。将烘干至恒重的植物样捣碎,称0.1 g,放入20 mL试管中,加100 mmol·L-1的冰乙酸10 mL后,密封试管,置于90 ℃沸水中水浴2 h,冷却,过滤,稀释适当倍数后,在火焰光度计(2655-00)上测定离子含量。
1.3.3土壤中Na+、K+含量 分别称取0.5 g和2.0 g过0.5 mm筛的风干土样于20 mL试管中,各加入2 mol·L-1的HNO3溶液10 mL和去离子水10 mL,震荡30 min,过滤,稀释适当倍数后,在火焰光度计(2655-00)上测定离子含量,测定值分别为交换性和有效的非交换性Na+、K+及水溶性Na+、K+。土壤有效性Na+=水溶性Na++交换性和有效的非交换性Na+,土壤有效性K+=水溶性K++交换性和有效的非交换性K+[19]。
1.4数据处理
所得数据用Excel 2010录入,并制图。采用SPSS 16.0统计软件进行单因素方差分析,用Duncan法进行多重比较。数据以平均值±标准误表示。
2 结果与分析
2.1不同处理对罗布麻植株生长的影响
NaCl胁迫抑制了罗布麻的生长,200 mmol·L-1NaCl的抑制作用最为显著(表2)。正常钾水平下,200 mmol·L-1NaCl处理的罗布麻植株生物量均显著低于无NaCl胁迫(P<0.05),根、茎、叶鲜重分别下降了32%、46%、58%,干重分别下降了30%、43%、70%,而50 mmol·L-1NaCl对其生物量无显著影响(P>0.05)。低钾水平下,200 mmol·L-1NaCl处理植株的根、茎、叶生物量与对照相比显著下降,鲜重分别下降了26%、59%、61%,干重分别下降了30%、58%、75%;50 mmol·L-1NaCl处理植株的叶鲜重、干重分别显著下降了21%、20%(表1)。值得注意的是,在相同浓度NaCl胁迫下,不同K+水平对罗布麻生物量影响并不明显,低钾和正常钾处理植株各器官生物量之间无显著差异(表1)。 随NaCl胁迫浓度的增大,罗布麻的根冠比均呈明显上升的趋势(表1)。低钾和正常钾水平下,200 mmol·L-1NaCl处理罗布麻的根冠比均显著高于对照,分别为对照的2.3和1.7倍,低钾水平下其根冠比显著高于正常钾水平40%;相比对照,50 mmol·L-1NaCl处理植株的根冠比无显著变化(表1)。与茎的生物量变化相一致,罗布麻的株高受到200 mmol·L-1NaCl胁迫的严重抑制,而50 mmol·L-1NaCl处理相比对照无显著抑制效应(图1)。低钾和正常钾水平下,200 mmol·L-1NaCl处理罗布麻的株高分别比对照显著下降了30%和25%,但同一浓度NaCl胁迫处理时,其株高在低钾和正常钾处理之间无显著差异(图1)。
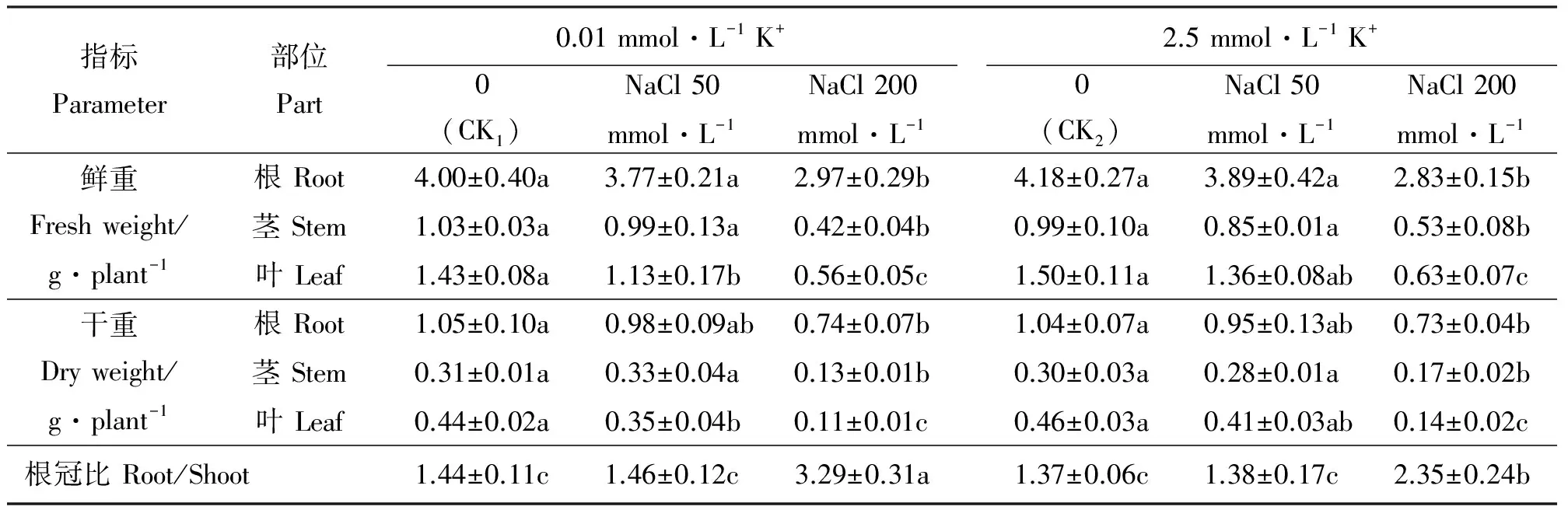
表1 不同K+水平下罗布麻鲜重、干重及根冠比响应NaCl胁迫的变化Table 1 Changes of fresh, dry weight and root/shoot of A.venetum response to NaCl stress under different K+ level
注:同行不同小写字母表示差异显著(P<0.05)。
Note:Different lower case letters within the same row indicate significant difference at 0.05 level.

图1 不同K+水平下罗布麻株高响应NaCl胁迫的变化Fig.1 Changes of plant height of A.venetum response to NaCl stress under different K+ level
注:不同的小写字母表示差异显著(P<0.05)。下同。
Note: Different lower case letter mean significant difference at 0.05 level.The same below.
2.2不同处理对罗布麻各器官中Na+、K+浓度的影响
罗布麻体内Na+含量随外界NaCl胁迫浓度的增大不断升高,且叶中上升幅度明显高于根和茎(图2)。在低钾和正常钾水平下,50mmol·L-1NaCl处理植株根、茎、叶中的Na+含量均显著高于对照(除叶中正常钾水平的Na+含量)(P<0.05),分别为对照的1.9、3.4、8.9倍和1.5、3.3、7.3倍,在两个K+处理水平之间差异并不显著(P>0.05);200 mmol·L-1NaCl胁迫下,低钾处理植株根和叶中Na+含量分别比正常钾处理植株显著高34%和35%。
罗布麻植株地上部叶和茎中的K+含量随外界NaCl胁迫浓度的增大有所下降,但根中K+浓度变化较小、维持了较高且相对稳定的K+浓度(图2)。低钾和正常钾水平下,与对照相比,50 mmol·L-1NaCl处理植株叶中K+浓度无显著变化,茎中K+浓度分别显著下降了17%和23%;200 mmol·L-1NaCl处理植株叶、茎中K+浓度分别比对照显著下降了28%、32%和34%、32%(P<0.05)。
2.3不同处理对罗布麻各器官中K+/Na+的影响
在正常钾水平下,未添加NaCl的对照组罗布麻植株体内维持了很高的K+/Na+(图3),其叶、茎和根中的值分别为17.2、7.3和2.0;即使在低钾条件下,其植株地上部叶和茎中的K+/Na+仍分别高达15.5和6.1。NaCl的添加显著降低了罗布麻体内各部位的K+/Na+。叶中K+/Na+降幅最大,低钾和正常钾水平下,与对照相比,50 mmol·L-1NaCl处理植株叶中K+/Na+均显著降低了88%,其值分别为1.8和2.0;植株茎、根中K+/Na+相比对照分别显著下降了69%、79%和47%、36%,K+/Na+值也均大于1;无论是50 mmol·L-1NaCl还是200 mmol·L-1NaCl胁迫处理,当外界NaCl胁迫浓度相同时,罗布麻体内各组织中的K+/Na+在低钾和正常钾水平间差异不显著。
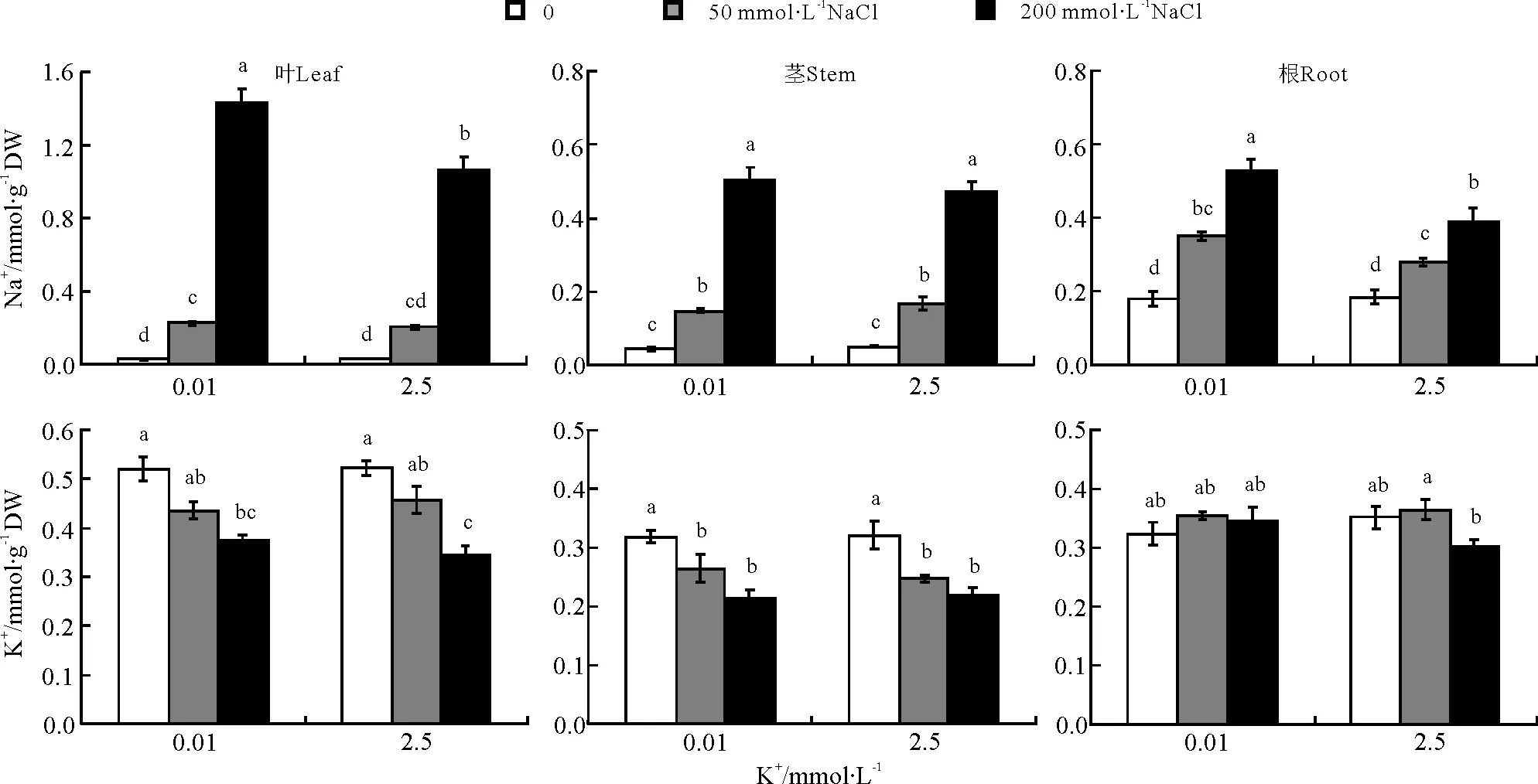
图2 不同K+水平下罗布麻体内Na+、K+浓度响应NaCl胁迫的变化Fig.2 Changes of Na+ concentration and K+ concentration of A.venetum response to NaCl stress under different K+ level
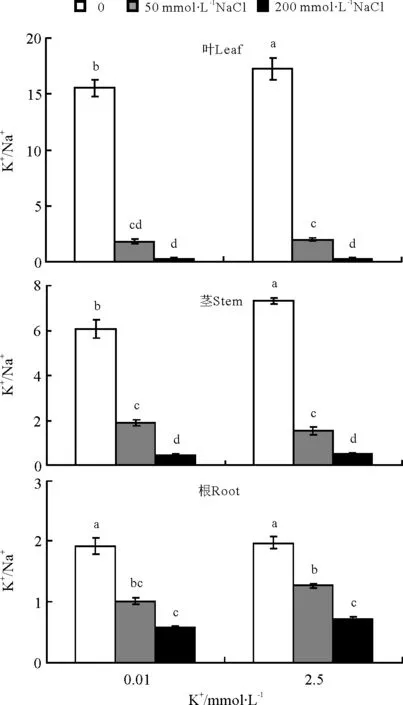
图3 不同K+水平下罗布麻叶、茎、根中K+/Na+比响应NaCl胁迫的变化Fig.3 Changes of K+/Na+ ratio in leaf,stem androot of A.venetum response to NaCl stress under different K+ levels
2.4供试土壤有效性Na+、K+浓度变化
试验处理前土壤有效性Na+、K+浓度分别为69.07、15.70 μmol·g-1干土,Na+/K+为4.39;试验处理后,经测算分析,土壤中有效性Na+浓度大幅上升,有效性K+浓度变化较小,从而0(对照)、50、200 mmol·L-1NaCl处理5周后低钾和正常钾处理土壤的Na+/K+分别为4.3、15.8、50.0和2.8、10.1、32.0。
3 讨论与结论
盐胁迫是影响植物生长的重要非生物因子,通过离子本身的毒害效应及盐离子导致的渗透胁迫和营养胁迫对植物造成伤害[20-21]。生物量是植物对盐胁迫响应的综合反映,也是植物耐盐性的直接指标[22]。本研究结果显示,200 mmol·L-1NaCl胁迫处理下,罗布麻生长受到严重抑制,株高和植株各营养器官生物量均显著下降(图1,表1)。地上部叶和茎的生物量减少幅度大于根系,表明叶、茎对盐胁迫的响应比根系更加敏感,这可能是罗布麻耐盐碱的一种生长适应策略,通过减少能量向茎叶的流动,以维持根系的生长,显著提高了根冠比(表1)。低钾和盐分的双重胁迫加速了这一能流过程,使之更好地维持根系的高生长量,以保证根系对养分(包括盐分)和水分的吸收,同时抑制地上部的生长,减少蒸腾和水分散失,促进根系干物质积累,从而形成低钾水平下植株根冠比始终高于正常钾水平的格局。50 mmol·L-1NaCl处理显著降低了低钾水平下罗布麻叶鲜重,而对正常钾水平下植株的生长无显著影响(表1),说明适宜的K+水平在一定程度上能够增强盐胁迫下罗布麻的生长适应能力,同时也表明维持土壤环境中适宜的Na+/K+有助于植物的生长。宋姗姗等[23]在研究与罗布麻同科植物长春花(Catharanthusroseus)时也发现,3‰ NaCl胁迫下,施入一定量的KCl,将Na+/K+调整为20∶1时可以显著缓解盐胁迫对长春花的危害。
离子稳态是植物抗盐的重要生理机制。盐胁迫下,细胞内正常生理状态下的离子平衡往往受到破坏,渗透势的改变影响植物对水分和养分的吸收,从而影响生长。许多研究表明[24-26],随着外界NaCl浓度的不断增大,植株地上部Na+含量逐渐升高、K+含量逐渐降低,本试验结果与之相一致。宁建凤等[27]利用网室盆栽试验研究不同浓度NaCl(100~400 mmol·L-1)胁迫对罗布麻生理特性的影响,结果也表明,在盐胁迫下,罗布麻根部和地上部Na+含量明显增加,K+含量随着介质中盐浓度的增加而降低。植物在接触高盐环境后数小时到数天内渗透胁迫在影响植物生长中占主导地位,经过长时间的盐胁迫,营养胁迫则占主导地位[20]。K+是植物生长发育的重要营养元素,也是高等植物体内质量分数最多的阳离子,具有调控离子平衡、渗透调节、蛋白质合成、细胞膨压、光合作用等生理功能[28]。本试验中,NaCl胁迫处理5周后,罗布麻各器官中Na+含量随介质NaCl浓度的增加显著上升,特别是叶中上升幅度很大;但其叶和茎中K+含量仍维持较高水平,且根中K+浓度能保持稳定(图2),表明罗布麻对K+具有较强的选择性吸收和运输能力。
K+/Na+是衡量植物耐盐性的重要指标,适盐性植物一个主要特征是细胞质内K+/Na+维持在合适范围之内[29]。盐胁迫下,植物体内K+/Na+显著下降[28,30]。抗盐植物能够维持较高的K+/Na+以确保体内足够的K+浓度。本研究表明,罗布麻体内尤其是叶中积累了大量的K+,在盐胁迫下,根中能够始终贮存稳定含量的K+,地上部K+浓度虽有所下降但仍维持了较高的水平(图2),从而使其体内保持了相对高的K+/Na+,表现出对Na+、K+强的运输调控能力。50 mmol·L-1NaCl胁迫下,低钾和正常钾处理土壤中Na+分别为K+的15.8和10.1倍,然而,罗布麻叶中K+/Na+分别高达1.8和2.0(图3),均高于同等盐浓度下的豌豆(Pisumsativum)[31]、高粱(Sorghumbicolor)[32]等农作物耐盐品种的K+/Na+,也高于苇状羊茅(Festucaarundinacea)[33]、四翅滨藜(Atriplexcanescens)[34]等耐盐碱荒漠植物的K+/Na+。由此可见,通过增强有益离子K+的选择性吸收和运输,从而保持叶部较高的K+含量和K+/Na+是罗布麻适应盐逆境的决定因子之一。
此外,罗布麻作为传统中药,其降压作用已被广泛证明[16-17,35],至今在新疆地区仍流传着“高血压不可怕,三年一斤罗布麻”的民族医药古训。药理研究指出[36-38],减少饮食中Na+的摄入、补充K+,尤其是降低Na+/K+是高血压和心血管疾病发病预防和治疗的一项重要非药物性控制措施。宋建平等[39]对罗布麻叶中的无机元素进行了系统测定和分析,结果表明,在检测的23个无机元素中,罗布麻叶中K元素平均含量最高。本研究表明,即使在根际土壤K+水平很低(Na+/K+为4.3)的环境下,罗布麻也能够高效地吸收K+并运送至地上部叶中,维持高达15.5的K+/Na+(图3),这为罗布泊地区民众心血管疾病的低发生率与其长期饮用罗布麻茶这一传统生活习惯密切相关提供了有力证据支持。罗布麻具有广泛而特异的药用保健功效,人们对其开展了大量的药理研究,然而,关于罗布麻叶降血压的确切机理目前仍不清楚,有待进一步深入研究。
[1]廖红,严小龙.高级植物营养学[M].北京:科学出版社,2003.
[2]Zörb C,Senbayram M,Peiter E.Potassium in agriculture-status and perspectives[J].Journal of Plant Physiology,2014,171(9):656-669.
[3]Zhu J K,Liu J,Xiong L.Genetic analysis of salt tolerance inArabidopsis:Evidence for a critical role of potassium nutrition[J].Plant Cell,1998,10(7):1181-1191.
[4]周峰,李平华,王宝山.K+稳态与植物耐盐性的关系[J].植物生理学通讯,2003,39(1):67-70.
[5]Xie W Y,Zhang X Y,Wang T,Hu J J.Botany,traditional uses,phytochemistry and pharmacology ofApocynumvenetumL.(Luobuma):A review[J].Journal of Ethnopharmacology,2012,141(1):1-8.
[6]李国旗,陈彦云.罗布麻生理生态学研究[M].北京:科学出版社,2012.
[7]张绍武.我国罗布麻分布区的地理区划[J].西北植物学报,2002,22(7):1-5.
[8]谢彬.新疆罗布麻的生物生态学特性研究[D].乌鲁木齐:新疆大学,2009.
[9]铁桂春,刘红献.野生罗布麻特性及利用价值[J].草业科学,2006,23(6):46-47.
[10]于德花,徐化凌,常尚连.NaCl胁迫对罗布麻种子萌发及幼苗生长的影响[J].湖北农业科学,2008,47(7):772-775.
[11]胡瑞林,钱学射.罗布麻在陕西关中引种适应性的研究[J].西北植物学报,2002,22(7):57-67.
[12]刘起棠,肖正春,张卫明,陆长梅,张广伦.罗布红麻和罗布白麻生态地理特性探讨[J].中国野生植物资源,2009,28(2):13-16.
[13]Wang L L,Han G T,Zhang Y M.Comparative study of composition,structure and properties ofApocynumvenetumfibers under different pretreatments[J].Carbohydrate Polymers,2007,69(2):391-397.
[14]平晓燕,林长存,白宇,刘起棠,卢欣石.新疆阿勒泰平原荒漠罗布麻种植区的生态效益评价[J].草业学报,2014,23(2):49-58.
[15]程秀丽,张素琼,李青山.罗布麻叶中黄酮类化合物研究[J].中药材,2007,30(9):1086-1088.
[16]Kim D W,Yokozawa T,Hattori M,Kadota S,Namba T.Effects of aqueous extracts ofApocynumvenetumleaves on spontaneously hypertensive,renal hypertensive and NaCl-fed-hypertensive rats[J].Journal of Ethnopharmacology,2000,72(1):53-59.
[17]付剑江,王曦聆,吕红,刘蓉,尹小英,郑洋滨,罗永明.罗布麻叶提取物的抗高血压作用及其机制研究[J].中国实验方剂学杂志,2013,19(7):159-164.
[18]Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyteSuaedamaritima[J].Plant Physiology,2007,145(2):559-571.
[19]段娇娇,康建军,于健龙,杨自辉,王锁民.钠复合肥培育白刺强旱生植株的研究[J].草业科学,2011,28(6):1019-1024.
[20]Munns R.Comparative physiology of salt and water stress[J].Plant,Cell and Environment,2002,25(2):239-250.
[21]杨小菊,赵昕,殷恒霞,赵鹏善,李新荣.盐胁迫对二穗短柄草幼苗生长及不同器官中盐离子稳态的影响[J].西北植物学报,2013,33(2):371-377.
[22]Levitt J.Responses of Plants to Environmental Stresses.Volume Ⅱ[M].New York:Academic Press,1980.
[23]宋姗姗,刘玲,隆小华,刘兆普.氯化钾对长春花盛花期盐胁迫效应和生物碱含量的影响[J].西北植物学报,2010,30(7):1415-1419.
[24]Tavakkoli E,Rengasamy P,McDonald G K.The response of barley to salinity stress differs between hydroponic and soil systems[J].Functional Plant Biology,2010,37(7):621-633.
[25]李先婷,曹靖,魏晓娟,董利苹,代立兰.NaCl 渐进胁迫对啤酒大麦幼苗生长、离子分配和光合特性的影响[J].草业学报,2013,22(6):108-116.
[26]郑青松,刘兆普,刘友良,刘玲.等渗的盐分和水分胁迫对芦荟幼苗生长和离子分布的效应[J].植物生态学报,2004,28(6):823-827.
[27]宁建凤,郑青松,邹献中,孙丽丽,姚瑶,陈勇,巫金龙,魏岚.罗布麻对不同浓度盐胁迫的生理响应[J].植物学报,2010,45(6):689-697.
[28]景艳霞,袁庆华.NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响[J].草业学报,2011,20(2):134-139.
[29]Maathuis F J M,Amtmann A.K+nutrition and Na+toxicity:The basis of cellular K+/Na+ratios[J].Annals of Botany,1999,84(2):123-133.
[30]Lissner J,Schierup H H,Comín F A,Astorga V.Effect of climate on the salt tolerance of twoPhragmitesaustralispopulations:I.Growth,inorganic solutes,nitrogen relations and osmoregulation[J].Aquatic Botany,1999,64(3):317-333.
[31]Shahid M A,Balal R M,Pervez M A,Abbas T,Ashfaq M,Ghazanfar U,Afzal M,Rashid A,Garcia-Sanchez F,Mattson N S.Differential response of pea (PisumsativumL.) genotypes to salt stress in relation to the growth,physiological attributes antioxidant activity and organic solutes[J].Australian Journal of Crop Science,2012,6(5):828-838.
[32]Bavei V,Shiran B,Arzani A.Evaluation of salinity tolerance in sorghum (SorghumbicolorL.) using ion accumulation,proline and peroxidase criteria[J].Plant Growth Regulation,2011,64(3):275-285.
[33]李品芳,白文波,杨志成.NaCl 胁迫对苇状羊茅离子吸收与运输及其生长的影响[J].中国农业科学,2005,38(7):1458-1465.
[34]王新英,史军辉,刘茂秀,陈启民.四翅滨藜主要渗透调节物质对NaCl胁迫累积的响应[J].干旱区研究,2012,29(4):621-627.
[35]虞颖映,邵健忠,王海明.罗布麻茶对心血管系统的生物学效应研究[J].同济大学学报(医学版),2006,27(4):40-42.
[36]Kesteloot H,Joossens J V.Relationship of dietary sodium,potassium,calcium,and magnesium with blood pressure.Belgian Interuniversity Research on Nutrition and Health[J].Hypertension,1988,12(6):594-599.
[37]牟建军,刘治全,杨军,梁一木,朱丹军,王永兴,高宝林,张晓玲,季华春,徐祥麟.补充钾和钙对血压偏高青年动脉血压及钠代谢影响的长期观察[J].中华预防医学杂志,2003,37(2):90-92.
[38]Iwamoto T,Kita S.Hypertension,Na+/Ca2+exchanger,and Na+,K+-ATPase[J].Kidney International,2006,69(12):2148-2154.
[39]宋建平,张月婵,刘训红.罗布麻叶中无机元素的分析[J].时珍国医国药,2009,20(8):1909-1912.
(责任编辑 张瑾)
EffectofK+onthegrowth,ionabsorptionanddistributionofApocynumvenetumundersaltstress
XIA Zeng-run, WANG Pei-dong, JIA Wen, WEI Li, MI Li, WANG Suo-min
(College of Pastoral Agriculture Science and Technology, Lanzhou University;State Key Laboratory of Grassland Ago-ecosystems, Lanzhou 730020, China)
The effects of two K+levels(0.01 and 2.5 mmol·L-1)on the growth,ion absorption and distribution ofApocynumvenetumunder NaCl stress were investigated by the pot experiment.The results indicated that the biomass and plant height ofA.venetumdecreased with the increase of external NaCl concentration, however, there was no significant difference between 0.01 and 2.5 mmol·L-1K+under the same salt treatment(P>0.05).Na+contents in all tissues ofA.venetumincreased significantly (P<0.05) with the increase of external NaCl concentration and the increase rate in leaf was greater than that in root and stem.In contrast to Na+,K+contents decreased significantly but still maintained at a high level in leaf and stem and maintained stable in root with the increase of external NaCl concentration.Furthermore, compared with the control, K+contents in leaf did not significantly change whenA.venetumwas exposed to 50 mmol·L-1NaCl.Moreover,A.venetumaccumulated high contents of K+in the absence of salt stress, especially in leaf where K+contents were 15 times higher than that of Na+.In conclusion, enhancing the capacity of selective absorption and transport for K+, and hence maintaining high K+contents and K+/Na+ratio in leaf are the key adaptive mechanisms of salt-tolerance inA.venetum.
Apocynumvenetum; K+levels; salt stress; ion absorption and distribution; K+/Na+ratio
WANG Suo-min E-mail:smwang@lzu.edu.cn
2014-09-04 接受日期:2014-10-15
教育部博士点基金优先发展领域项目(20130211130001);兰州大学中央高校基本科研业务费专项资金(lzujbky-2013-203)
夏曾润(1990-),男,陕西岚皋人,在读硕士生,研究方向为植物逆境生理与分子生物学。E-mail:xiazr13@lzu.edu.cn
王锁民(1965-),男,甘肃宁县人,教授,博导,博士,研究方向为植物逆境生理与荒漠化治理。E-mail:smwang@lzu.edu.cn
S563.7;Q945.78
:A
:1001-0629(2014)11-2088-07
10.11829j.issn.1001-0629.2014-0402

