单独皮层电刺激对脑卒中大鼠MAP-2表达水平的影响研究
王嘉慧,李 涛,李承晏,高文蔚
(武汉大学人民医院 1.放射科;2.神经内科,湖北 武汉430060)
神经调控是一个新兴的快速发展的多学科交叉领域,涵盖医学、物理学和生物工程学,利用植入性和非植入性技术,依靠电或化学手段调节神经系统功能治疗疾病、改善患者生活质量。皮层电刺激是通过神经调控、促进卒中后神经功能康复的一种新的治疗脑卒中方法[1-3]。微管相关蛋白-2(MAP-2)是一种微管蛋白调节因子,主要存在于神经元的树突、胞体和树突棘中,MAP-2的丢失是神经功能障碍的诱因。为了探究皮层电刺激治疗脑卒中的原理,本实验运用皮层电刺激治疗缺血性脑卒中模型大鼠,观察电刺激对大鼠梗死灶周围及对侧皮层微管相关蛋白-2表达水平的影响。
1 材料与方法
1.1 实验材料与仪器
Biospec4.7/30超导磁共振成像仪(中国科学院武汉物理与数学研究所,波谱与原子分子物理国家重点实验室);珊顿石蜡切片机(英国);小鼠抗大鼠MAP-2 IgG (武汉博士德生物工程有限工程);山羊血清(武汉博士德生物工程有限工程);羊抗小鼠FITC荧光二抗(美国Jakson公司)。
1.2 方法
1.2.1 动物选择和分组 健康成年SPF级雄性SD大鼠共105只,体重250 g左右。采用线栓法制作大脑中动脉阻塞模型后,选择Bederson评分为1-4分的大鼠进行MRI,筛选24只皮层梗死大鼠,随机分为电刺激组(cortical electrical stimulation,CES)13只和非刺激组(no stimulation,NS)11只。
1.2.2 刺激器植入术和电刺激治疗 两组大鼠均植入刺激器,刺激器为单级刺激模式,包括一个刺激电极、一对电极和一个脉冲发送器。于造模成功后1周植入。具体方法为:刺激器用环氧乙烷灭菌,模型鼠术前紫外线照射2 h后进行腹腔麻醉,取俯卧位固定于立体定位仪上,正中切口切开头皮以暴露颅骨,于近梗死灶边缘部位植入电极并标记。钻开颅骨至硬膜,将孔扩至1.5 mm左右,挑开硬膜,将刺激电极植入硬膜下梗死边缘皮质表面。电极的硅胶片用生物胶黏合固定在颅骨表面并密封,分离颈背部皮下组织,将脉冲发生器植入皮下,其中将电极与皮下组织表面贴附。非刺激组不施加电刺激治疗,刺激组增加电刺激治疗,具体为:刺激器每天8:00-8:30和20:00-20:30开启,电流为0.65 mA。刺激脉冲是由50,20,5Hz组成的循环脉串,10s一个周期,脉冲宽200μs,电刺激治疗持续2周后停止。
1.2.3 标本制备 从刺激器植入时开始,6周后取脑组织放入多聚甲醛固定,24 h后进行冠状位石蜡包埋连续切片,片厚4 μm,对切片进行连续编号,每个组织在所有脑切片等间隔挑选10张脑片进行染色分析。
1.2.4 微管相关蛋白-2(MAP-2)免疫荧光染色 切片烤片,脱蜡,水化后PBS冲洗3次;抗原修复(微波修复法),室温冷却1 h后再PBS冲洗3次,5%山羊血清封闭20 min,滴加小鼠抗大鼠MAP-2一抗,4 ℃过夜后,37 ℃水浴箱复温,PBS洗片3次,避光加羊抗小鼠FITC荧光二抗后,37 ℃孵育1.5 h,PBS洗片3次,避光封片。
1.2.5 图像分析 每张切片随机选取梗死灶周围及对侧相应皮层各5个视野进行照像(光学显微镜,400倍),用Image-Pro plus 6.0图像分析系统测定梗死周边区及与梗死灶对侧相应皮层MAP-2免疫染色阳性细胞所占的单位面积。
1.3 统计学处理

2 结果
2.1 植入式皮层电刺激对缺血性脑卒中大鼠梗死周围区MAP-2表达水平的影响
研究发现,电刺激组大鼠梗死周围区MAP-2表达呈代偿性的增多,而非刺激组大鼠MAP-2表达稀少。两组大鼠梗死周围区MAP-2表达水平差异有显著统计学意义(t=12.189,P<0.01)。见图1,图2。

A为CES组,B为BNS组(SP,×400,标尺:100 μm)

与NS组比较,*P<0.05,**P<0.01
2.2 植入式皮层电刺激对脑梗死大鼠梗死对侧半球皮层中MAP-2表达水平的影响
研究发现,与非刺激组相比,电刺激组大鼠梗死对侧半球相应皮层中MAP-2表达增加。两组大鼠梗死对侧半球MAP-2表达水平比较差异有统计学意义(t=2.454,P<0.05),见图2、图3。
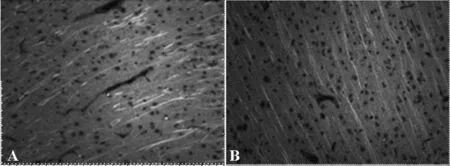
A为CES组,B为BNS组(SP,×400,标尺:100 μm)
3 讨论
皮层电刺激是卒中后神经功能康复的一种新的治疗脑卒中的方法,其机制尚不清楚。自2003年至今,一些动物实验和Ⅰ期、Ⅱ期临床试验均成功地报道了皮层电刺激作为辅助性治疗措施,结合康复训练治疗脑卒中后运动功能障碍的安全性和有效性,使得皮层电刺激可能成为促进脑卒中后神经功能康复的新方法[2-6]。Adkins等[2]将电极植入皮质硬膜外,对康复治疗联合皮层电刺激10天后的行为学研究发现,50 Hz刺激频率相比250 Hz刺激频率具有更好治疗效果,且能增加微管相关蛋白-2的表达水平。Adkins等[3]则利用100 Hz频率电刺激联合康复治疗18天,得出了类似的结果,同时电刺激可增加病灶周围神经元和突触密度,促进突触结构可塑性。Kleim等[4]和Teskey等[6]分别用不同刺激参数进行类似实验,均发现频率为50-100Hz、强度为域值40%-70%的电刺激能够显著提高卒中大鼠运动功能恢复。
以往的皮层电刺激治疗缺血性脑卒中大鼠实验多采用单一频率脉冲串。本课题组前期采用50、20、5 Hz变频脉冲串治疗缺血性脑卒中大鼠16天,可促进卒中后大鼠运动功能恢复,增加病灶周围微管相关蛋白-2表达,其可能的机制是:电流达到皮质组织后可以维持和调节脑梗死边缘区神经组织的兴奋性,促进神经功能恢复[7],而变频脉冲串则可能激活不同部位、不同类型的神经元,达到辅助康复治疗的效果[8]。
突触结构的可塑性是突触可塑性重要的组成部分,其形态变化的内在机制是突触可塑性相关蛋白表达水平的改变。微管相关蛋白-2属于结构性微管相关蛋白家族,是调节微管蛋白组装及动力学的重要调节因子。微管相关蛋白-2在维持神经元结构、细胞分化及调节神经元功能可塑性中发挥重要作用[9]。微管相关蛋白-2丢失可产生神经元形态和功能的改变。Li等[10]研究发现缺血中心区微管相关蛋白-2免疫反应消失,而长时间再灌注的缺血半暗带区微管相关蛋白-2出现选择性的增高,表明病灶周围突触结构重建,可能是一种短暂性局灶性脑缺血的补偿与修复机制。
本实验在已有研究基础上,将观察时间延长至电刺激治疗结束后4周。结果显示,微管相关蛋白-2在电刺激组大鼠梗死灶周围及对侧皮层表达均要高于非刺激组,表明皮层电刺激可以增加梗死灶周围及梗死对侧皮层神经元轴突密度,从而诱导双侧皮层神经元轴突的可塑性改变,而且这种改变在电刺激治疗结束后仍然持续存在。另外,本实验发现电刺激组与非刺激组大鼠梗死灶周围微管相关蛋白-2表达较前期实验差异更显著,推测随着时间的延长皮层电刺激诱导神经可塑性改变更明显。然而,对于皮层电刺激会对梗死侧和梗死对侧神经元轴突的可塑性均会产生影响的机制尚待研究。Andres等[11]用干细胞移植治疗脑梗死时发现干细胞移植可使双侧皮质轴突明显增加,认为双侧皮层轴突的可塑性改变与损伤侧残存脑组织及对侧脑组织间的神经纤维连接回路有关。因此,我们推测皮层电刺激促进双侧皮层的可塑性改变可能与电刺激活化大脑皮质间的神经纤维联系通路有关。
本研究发现,单独应用皮层电刺激而不联合康复训练对动物脑梗死后肢体功能的恢复亦是有效的。运用全植入式皮层电刺激器可以增加梗死灶周围和对侧皮层微管相关蛋白-2的表达,从而诱导双侧皮层神经元轴突的可塑性改变,并且这种改变在皮层电刺激结束后仍然存在,皮层电刺激可能通过诱导双侧神经元轴突的可塑性来改善脑卒中后运动功能的恢复。
作者简介:王嘉慧(1987-),女,硕士研究生,住院医师,主要从事神经病学和放射学的联合应用研究。
参考文献:
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[2]Adkins-Muir DL,Jones TA.Cortical electrical stimulation combined with rehabilitative training:enhanced functional recovery and dendritic plasticity following focal cortical ischemia in rats[J].Neurol Res,2003,25(8):780.
[3]Adkins DL,Hsu JE,Jones TA.Motor cortical stimulation promotes synaptic plasticity and behavioral improvements following sensorimotor cortex lesions[J].Exp Neurol,2008,212(1):14.
[4]Kleim JA,Bruneau R,VandenBerg P,et al.Motor cortex stimulation enhances motor recovery and reduces peri-infarct dysfunction following ischemic insult[J].Neurol Res.2003,25(8):789.
[5]Plautz EJ,Barbay S,Frost SB,et al.Post-infarct cortical plasticity and behavioral recovery using concurrent cortical stimulation and rehabilitative training:a feasibility study in primates[J].Neurol Res,2003,25(8):801.
[6]Teskey GC,Flynn C,Goertzen CD,et al.Cortical stimulation improves skilled forelimb use following a focal ischemic infarct in the rat[J].Neurol Res,2003,25(8):794.
[7]Zhou Q,Zhang Q,Zhao X,et al.Cortical electricalstimulation alone enhances functional recovery and dendritic structures after focal cerebral ischemia in rats[J].Brain Res,2010,1311:148.
[8]Baba T,Kameda M,Yasuhara T,et al.Electrical stimulation of the cerebral cortex exerts antiapoptotic,angiogenic,and anti-inflammatory effects in ischemic stroke rats through phosphoinositide 3-kinase/akt signaling pathway[J].Stroke,2009,40(11):e598.
[9]Pettiew L,Holtz ML,Craddoek SD,et al.Microtubular proteolysis in focal cerebral isehemia[J].J Cereb Blood Flow Metab,1996,16(6):1189.
[10]Li Y,Jiang N,Powers C,Chopp M.Neuronal damage and plasticity identified by microtubule-associated protein 2,growth-associated protein 43,and cyclin D1 immunoreactivity after focal cerebral ischemia in rats[J].Stroke,1998,29(9):1972.
[11]Andres RH,Horie N,Slikker W,et al.Human neural stem cells enhance Structural plasticity and axonal transport in the ischaemic brain[J].Brain,2011,134(Pt 6):1777.
——水芹主要害虫识别与为害症状

