川北米仓山地区灯影组微生物碳酸盐岩发育特征
彭瀚霖, 刘树根, 宋金民, 孙 玮, 丁 一, 尹柯惟
(油气藏地质及开发工程国家重点实验室(成都理工大学),成都 610059)
Burne(1987)首次提出了微生物岩的概念:“底栖微生物群落捕获和黏结碎屑沉积物,并且(或者)形成矿物沉淀位点,通过这种方式加积的生物成因沉积即为微生物沉积岩[1]。”微生物碳酸盐岩“是由微生物的生长、新陈代谢、细胞表面特性,以及与细胞外聚合物有关的矿物沉淀、颗粒捕获,相互作用的综合产物[2]”。近年来,关于微生物碳酸盐岩的研究是沉积学界的一个热点,国内现阶段还处于起步阶段,主要是根据形态学特征,采纳Riding(2000)所提出的分类方案,将微生物碳酸盐岩划分为4类:叠层石、凝块石、树形石、均一石[3]。梅冥相(2007)认为应将核形石、纹理石补充到新分类方案中[4]。
前人早已认识到“蓝藻”在四川盆地震旦系灯影组白云岩的沉积过程中起到了极为重要的作用,识别出球状蓝藻体、丝状蓝藻体、黏球藻体,并认为整个灯影期盆地处于浅水潮坪沉积环境[5-10]。朱同兴等(1992)报道了灯影组肾形藻-表附藻(即附枝菌)泥丘,认为滇东地区的肾形藻泥丘主要产于碳酸盐潮坪的低能环境中[11]。方少仙(2003)首次提出了四川盆地震旦系白云岩非叠层生态系蓝细菌的概念,即主要为球状-椭球状蓝细菌组成的微生物系统在本区白云岩中广泛存在,其生长发育贯穿白云岩沉积期、准同生-同生期、表生期[12]。
本文在前人研究的基础上,借鉴最新的微生物碳酸盐岩研究成果,以川北出露完整、最具代表性的南江县杨坝镇上震旦统灯影组剖面为研究对象(图1),通过近300块薄片鉴定,试图厘清本区灯影组微生物白云岩发育特征,探讨其沉积环境,为四川盆地北缘灯影组天然气勘探提供参考。
1 蓝细菌形态及其保存机制
杨坝灯影组剖面主要发育2种类型蓝细菌:球状蓝细菌和丝状蓝细菌。前者形成了肾形菌(Renalcis,房室型)、附枝菌(Epiphyton,树枝型)、链球型蓝细菌集合体;后者形态可分为管型(部分为葛万菌,Girvanella)、叠层型、凝块型。

图1 川北杨坝震旦系灯影组剖面位置及实测岩性-沉积相综合柱状图Fig.1 Section position and the comprehensive stratigraphic column of the Sinian Dengying Formation in Yangba of North Sichuan(剖面位置据1∶200 000南江幅区域地质图)
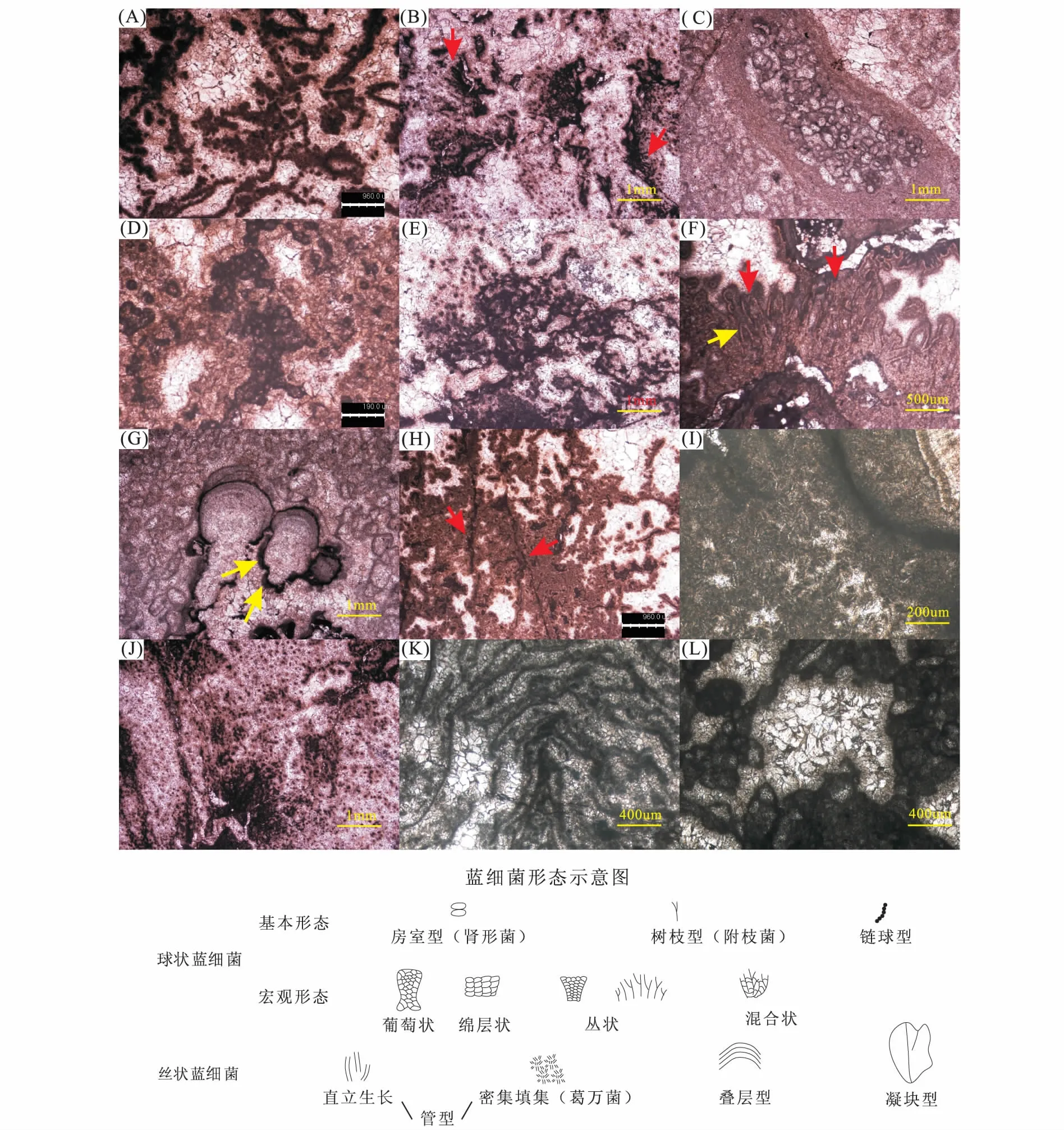
图2 川北杨坝灯影组剖面蓝细菌类型及形态Fig.2 Cyanobacteria types and shapes of the Dengying Formation in Yangba, North Sichuan(A)链球型球状蓝细菌,灯二段,10×2,单偏光; (B)附枝菌,灯二段,10×2,单偏光; (C)绵层状肾形菌、肾形菌礁屑,灯二段,10×2,单偏光; (D)葡萄状肾形菌,灯二段,10×10,单偏光; (E)丛状肾形菌,灯二段,10×2,单偏光; (F)管型蓝细菌,灯二段,10×4,单偏光; (G)绵层状肾形菌,灯二段,10×2,单偏光; (H)凝块型丝状蓝细菌,灯二段,10×2,单偏光; (I)葛万菌,灯二段,10×10, 单偏光; (J)混合型球状蓝细菌集合体,灯二段, 10×2, 单偏光; (K)叠层型丝状蓝细菌形成的生物膜,灯二段,10×5,单偏光; (L)丛状、葡萄状肾形菌,灯二段,10×5,单偏光
1.1 球状蓝细菌
国内外已有震旦系肾形菌、附枝菌的报道,一般认为肾形菌、附枝菌的形成与球状蓝细菌有关[11,13]。另见若干球状蓝细菌形成链球形态(图2-A)。
肾形菌囊状结构发育(图2-L),壁厚,部分经历了后期成岩作用而变形[11]。单体大小变化较大,长径约60~500 μm,以肾形、不规则椭球形产出。单个肾形菌房室内可见2期白云石充填,边缘为纤状白云石,中间为粉-细晶白云石。若干肾形菌组合生长,可呈丛状(图2-E)、葡萄状(图2-D)、绵层状(图2-C)。
附枝菌,较少,单体直径约40 μm,长度约250~350 μm。纵剖面呈树杈状,具一个开口;横切面呈大小均一的点球状(图4-A),直径大小均一,可能受持续的海水搅动影响,限制了球状蓝细菌集合体的直径上限[13]。附枝菌的叶体呈丛状产出(图2-B),类似于Jusun Wooetal.(2008)报道的第3种类型张夏组附枝菌[15]。特别地,见附枝菌与肾形菌混合发育,呈喇叭形(图2-J),显示两者发育环境具一定相似性。
1.2 丝状蓝细菌
叠层型(图2-K)。Turner(2000)认为叠层状的深黑色生物膜是由若干密集填集的丝状蓝细菌构成[16]。生物膜等间距排布形成同心暗色纹层,暗层之间被粗大的白云石或石英晶粒占据。此种类型蓝细菌是本区核形石、以及大部分叠层石的“骨架”。
管型。部分为葛万菌,具中空的、弯曲的、未分叉的深色泥晶管壁[17,18]。国外报道的葛万菌管壁外径变化范围较大,小至1 μm,大者可达100 μm,其中8~30 μm的分布区间较常见[19,20];单体长度可达1 mm,一般为100~200 μm[16,21]。本区葛万菌(图2-I)外管壁直径约20 μm,长约80 μm。管壁为暗色白云质泥晶,管腔为微-粉晶白云石充填,管壁总厚度约为整个菌体宽度的1/2。通常若干葛万菌聚集发育。另一种管型蓝细菌个体较大,外管壁直径约30 μm,长度约150 μm。个体之间呈并列管状(图2-F红色箭头),或者端缘接触(图2-F黄色箭头)呈“V”字形,整体呈现直立向上生长态势。
凝块型(图2-H)。少见,中央丝状菌体清晰,包绕丝状蓝细菌为极厚的、发散的微晶白云石。形态类似于Riding(1982)报道的Angulocellularia[22],但体形较之大得多,整体呈树形。
1.3 蓝细菌的保存机制
普遍认为蓝细菌的保存与细胞外聚合物(extracellular polymeric substance,简称EPS)钙化作用有关,这种作用依赖于蓝细菌CO2浓缩机制(carbon dioxide concentrating mechanisms,简称CCM)[3,18]。特别是管型结构的蓝细菌,能很好地应用上述机制解释:蓝细菌的衣鞘因钙化而保存,菌丝体未钙化在死亡后消失,被后期沉淀的白云石晶粒充填。但对附枝菌、肾形菌等实心菌体的钙化机制现阶段仍然存在极大争议[13,14,16]。特别地,少量薄片中见差异钙化现象,如图2-G中央的囊状蓝细菌集合体,深黑色泥晶为钙化的蓝细菌实体,而实体边缘的云雾状泥晶(黄色箭头)可能与低的微生物活动程度、衣鞘退化作用有关。
部分蓝细菌白云岩在成岩过程中经历了硅化作用,这种成岩作用对蓝细菌形态的保存可能是有利的[23,24]。破坏蓝细菌保存形态的成岩作用明显,一为溶蚀作用,二为重结晶作用[11]。

2 岩石学特征
本区与微生物作用相关的白云岩丰富,前人认为四川盆地灯影组叠层石、层纹石、核形石、凝块、团块等的形成依赖于“蓝藻”[5-9]。但随着“蓝藻非藻,而为菌”等一系列认识的提高,这些与微生物作用相关的碳酸盐岩的特征及其与蓝细菌的具体关系也有必要重新认识。按照Riding(2000)微生物岩分类标准,杨坝剖面微生物碳酸盐岩主要为叠层石和凝块石;而与蓝细菌生物活动相关的碳酸盐岩组构有团块、核形石以及部分碳酸盐岩碎屑。
2.1 叠层石
叠层石最早是由Kalkowsky(1908)命名,其具2种基本属性,发育纹层状构造,且为生物成因。Riding(1991)修订为纹层状的、底栖微生物成因的沉积[25]。认为除骨架叠层石外[26],其余叠层石均缺乏钙化的微生物骨骼[3],即“前寒武纪之谜”[27]。梅冥相(2007)定义纹理石为 “水平状的叠层石”[4]。但国外文献中一般不单独分类,遵循此标准,本文亦将纹理石划归为叠层石。本区叠层石宏观形态主要为丘状、层状,少量为圆柱状(图3-A、B、I)。部分叠层石镜下见钙化的微生物骨骼(图3-E)。

与微生物作用相关的各种孔洞发育。见层状分布的骨架窗格孔(图3-C、G、H),部分已被石英(亮晶白云石)-沥青充填;相同剖面材料中见平底晶洞构造(薛耀松,1984)[31]。两者均为叠层石建设时形成的孔洞[32,33],特别是后者,Pratt(1982)解释为蓝细菌席加积、海水冲洗簸选、同生期胶结作用的综合产物[33],蓝细菌席的幕式发育过程以及黏结作用,直接控制了孔洞底部平坦、顶部不规则的特殊形态。
2.2 凝块石
Aitken(1967)提出凝块石(thrombolite)的概念, 为“一种与叠层石有关的、但缺乏纹层的、具宏观凝结结构的隐藻结构[34]”。他认为后生动物对叠层石的扰动是形成凝块的直接原因。此观点被Kennardetal.(1986)否定,认为“凝块石为一种完全不同于叠层石的微生物岩,若干中型凝块结构(mesoclots)构成了宏观的凝块石,这些中型凝块结构为难以区分的、以钙化球状蓝细菌为主的、不连续的微生物群落组成”[35]。此前学术界对凝块石名称的使用比较混乱,这种混乱始于对凝块石尺度的理解。为统一标准本文采用Shapiro(2000)分类方案:巨型结构(1 m以上,若干凝块石组成的微生物建造,如层状生物礁)、大型结构(分米-米级,如穹隆状的半球)、中型结构(厘米-毫米级,仍然肉眼可见,如斑块状)、微型结构(毫米以下,仅显微镜下可见,如似球粒结构)[36,37]。杨坝灯影组剖面凝块石在块状白云岩中发育,块状白云岩内部成层性差,类似于梅冥相(2006)报道的黔中隆起一带灯影组 “凝块石生物丘”[38],大型结构不明显,中型结构呈杂乱的斑状(图4-I)。

图3 川北杨坝灯影组剖面叠层石Fig.3 Stromatolites of the Dengying Formation in Yangba, North Sichuan(A)低起伏的丘状叠层石,灯四段; (B)层状叠层石,灯二段; (C)密细纹层、沥青,灯四段,10×2,单偏光; (D)含砂屑的密细纹层,灯二段,10×2,单偏光; (E)钙化的管状微生物骨骼,灯二段, 10×2.5,单偏光;(F)混合型纹层,灯二段,10×2,单偏光; (G)密细纹层、窗格孔,灯二段,10×2.5,单偏光; (H) 密细纹层、窗格孔,灯四段,10×2,单偏光; (I)柱状叠层石,灯二段

图4 川北杨坝灯影组剖面凝块石Fig.4 Thrombolites of the Dengying Formation in Yangba,North Sichuan(A)附枝菌横切面,灯二段,10×2,单偏光; (B)凝块结构中的附枝菌,灯二段,10×2,单偏光; (C)凝块结构,附枝菌横切面斑点依稀可见,灯二段,10×2,单偏光; (D)绵层状肾形菌钙化形成微型凝块结构(红色箭头),灯二段,10×5,单偏光; (E)凝块、花边,凝块内部见形态极好的肾形菌发育,灯二段,10×4,单偏光; (F)砾状凝块被后生皮壳包绕,窗格孔,灯二段,10×4,单偏光; (G)砾状凝块,孔洞发育,灯二段,10×2,单偏光; (H) 树形凝块,边缘孔洞发育,灯二段,10×2,单偏光; (I)凝块石,花边构造,灯二段
镜下中-微型结构,大小集中在(2~4)mm×(5~7)mm。形态不好者呈斑状(图4-C);形态较好者呈聚合的叶状(图4-H),具向上生长的趋势;边缘波状起伏的砾状(图4-F、G),此为斑状、叶状凝块溶蚀后的形态,边缘皮壳包绕。凝块石色暗,有机质含量不高时内部呈似球粒结构,并具小型溶孔,凝块相邻区域片状的大型孔洞发育,已被亮晶白云石充填。有机质含量高时,内部窗格孔(图4-F)发育。凝块石发育处,早期溶蚀形成的葡萄-花边状构造也很发育,破坏了凝块原生结构,对凝块石的大型、巨型结构的识别造成极大干扰。关于凝块石的形成机制,正如梅冥相(2007)所述“可能代表了EPS的钙化作用,也可能是这些聚合物所捕获的泥晶[4]”。本区附枝菌(图4中的A-B-C序列)、肾形菌(图4-D、E)、葛万菌的钙化作用为形成凝块的主要机制。因此,按照Riding(2000)的分类方案[3],本文材料中的凝块石应为钙化微生物凝块石。
2.3 与蓝细菌有关的颗粒白云岩
团块可能是由丝状蓝细菌(图5-C)将砂屑(图5-B中黄色箭头)、凝块(图5-B中红色箭头)黏结而形成统一的、粒径>2 mm的聚合颗粒。蓝细菌的大小、活性、生长方向、EPS决定了其黏结、稳固碎屑物质的能力[3]。大量粗砂屑的结构,代表搬运砂屑的原环境能量较高;分选不好、棱角分明,揭示其搬运距离不长(图5-H)。大部分团块边缘不规则,为模糊的微晶白云石,少部分团块周缘具蓝细菌结壳(图5-F),这种颗粒边缘结构的差异可能与水动力的变化、扰动频率有关[37]。部分团块形成似核形石结构(图5-A),同心纹层厚度极薄,为动荡水体沉积物[39]。似核形石之间胶结处常见纤状蓝细菌丛体,为后期蓝细菌与纤状胶结沉淀物竞生而成。特别地,见团块镶嵌在附近的中型凝块结构中,凝块边缘模糊且被截切,呈负凹形(图5-B中绿色箭头),而团块边缘为原始形态。说明团块产于凝块发育的蓝细菌席中,因而常见团块结构与凝块结构伴生发育。
核形石的中心颗粒一般为砂屑、角砾,整体形态呈球状、椭球状甚至棒状,其形态受中心颗粒影响。见2个亚类,低能型和高能型。前者个体小,呈直径<2 mm的球状,同心纹层以暗色纹层为主(图5-E),核形石周围为正常的泥-粉晶结构。后者中心颗粒较大,为长径>2 mm的棱角状砾屑,经纹层修饰,整体改造为较光滑的短棒状,且与周围碎屑间的胶结物为亮晶白云石(图5-D)。核形石生长发育时,中心颗粒受波浪和潮汐影响而翻转,为丝状蓝细菌(可能为葛万菌)的包覆生长提供空间。蓝细菌自身又受阳光控制间歇性生长,生长期,形成暗色的泥晶纹层,同时蓝细菌分泌黏液捕获并黏结部分细粒沉积物;生长停滞期,亦通过生物作用促使周围微环境沉淀出胶结物形成亮色纹层。
与微生物作用有关的碳酸盐岩碎屑主要为微生物礁屑,长径在1~8 mm间,为砂屑状或角砾状。沉积环境不一:(1)礁体内部或边缘发育,黏结在周围蓝细菌钙化形成的微生物骨架中(图2-C);(2)礁体以外的潮下低能环境沉积,不规则角砾状,碎块被假亮晶胶结(图5-G)。另见部分砂屑经建设性泥晶化作用形成包粒,颗粒内部已重结晶成粉晶白云石(图5-I-1)。这种机制的大致过程为碳酸盐颗粒表面丝状蓝细菌钻孔,蓝细菌暴露在外的部分衣鞘钙化,形成泥晶套[37,40]。但是,本区由于营养物质供应充足,大型丝状蓝细菌(直径约15 μm)向颗粒内部发育(图5-I-2),砂屑整体均被蓝细菌钻孔(图5-I-3)。大型丝状蓝细菌EPS钙化作用产生泥晶环边,丝状蓝细菌实体死亡,留下空腔被微晶白云石充填,形成砂屑内部的管状结构。蓝细菌的钻孔活动为一继承性过程(图5-I-1,2,3),环境的改变可能造成蓝细菌钻孔的终止,形成不同程度的钻孔痕迹。早期蓝细菌钻孔形成的泥晶套,在后期亦有不同程度的溶蚀。

图5 川北杨坝灯影组剖面颗粒白云岩Fig.5 Grained dolostones of the Dengying Formation in Yangba, North Sichuan(A)团块形成的似核型石,周缘为同生期沉积的纤状蓝细菌群落,灯二段,10×2,单偏光; (B)团块、微型凝块结构,灯二段,10×4,单偏光; (C)丝状蓝细菌群落黏结形成的团块,灯二段,10×10,单偏光; (D)高能核形石,灯二段,10×2.5,单偏光; (E)低能型核形石,灯二段,10×2.5,单偏光; (F)亮晶胶结的被包壳的团块,灯二段, 10×2.5,单偏光; (G)礁屑,灯二段, 10×2, 单偏光; (H)团块,灯二段,10×2,单偏光; (I)被丝状蓝细菌钻孔的砂屑,灯二段,10×10,单偏光
3 沉积模式
本区灯影组微生物白云岩的沉积受潮汐控制,为潮间-潮下带的沉积物。潮间带主要发育大量的层状、低起伏的丘状叠层石。潮下带沉积物丰富,高能环境为团块、凝块、砂屑、高能型核形石,以及少量圆柱形叠层石;低能环境主要为凝块、礁屑,以及少量低能型核形石。
微生物分带性明显,潮间带蓝细菌类型单一,主要为丝状叠层型蓝细菌。潮下带蓝细菌分布受沉积环境能量的控制,高能环境球状蓝细菌多呈绵层状发育,也含丛状、葡萄状蓝细菌。丝状蓝细菌主要在浅滩颗粒白云岩中发育,另见少量丝状叠层型蓝细菌。潮下低能环境蓝细菌形态保存不好,且群落规模小,以球状蓝细菌为主,链球型多,房室型、树枝型少,后两者多以混合状产出。总体上,潮间带以叠层石生态系统蓝细菌为主;而潮下带以非叠层石生态系统蓝菌为主,其中部分参与凝块石的建设,其余参与到浅滩颗粒白云岩的沉积、改造中。灯影期处于隐生宙-显生宙过渡的特殊时期,稳定碳同位素在灯影组两端点处强烈负偏[41],代表该时期海洋环境了发生较大变化。新远古代以来的长期缺氧环境的结束[42],早期强烈火山活动后导致的高Mg、Ca浓度、Mg/Ca值[7],高盐度的海水,“极端温室效应”延续下的干燥炎热的气候,快速的海侵作用[38,43],浅水碳酸盐台地环境中的强烈潮汐作用等,造就了蓝细菌的繁盛和特殊的发育特征(如绵层状的肾形菌),形成了独特的微生物-碳酸盐岩系统。综上,建立本区微生物岩沉积模式如图6所示。
Riding(2002)探讨了碳酸盐岩礁的定义,并建立了以MSC三角图(Matrix, Skeleton, Ce-ment)为依据的新分类方案,认为礁是“底栖固着生物在原地造成的钙质沉积物”,将微生物礁纳入分类范畴。此观点得到了Flugel(2004)的充分肯定[37,44]。依此观点,本区潮间-潮下环境广泛存在微生物礁。潮间带微生物礁主要为叠层石礁,黏结形成的基质起支撑作用,见少量蓝细菌钙化后形成的骨骼,可能具支撑作用,故为黏结型微生物礁。潮下高能环境的微生物礁为2种:(1)柱状叠层石礁;(2)绵层状肾形菌-凝块石礁。两者均由蓝细菌钙化形成的骨架支撑礁体,同时早期亮晶胶结物也对礁体提供部分支撑作用,故为骨架型微生物礁。后者具两种结构单元,下部为团块-凝块礁基,上部为绵层状蓝细菌钙化骨架。潮下低能环境发育黏结型微生物礁,礁体主要由凝块石构成,见少量钙化后的蓝细菌集合体,但不具支撑作用,微生物礁支撑体主要为黏结的泥晶基质。蓝细菌的生长发育、EPS钙化控制微生物礁的建设,而蓝细菌类型受环境控制,因此不同沉积环境发育的微生物礁类型各异。

图6 川北米仓山地区灯影组微生物碳酸盐岩沉积模式Fig.6 Microbial carbonate sedimentary model of the Dengying Formation in the Micang Mountain area, North Sichuan
4 意 义
早期的研究已注意到灯影组白云岩中的“蓝绿藻”具备富集镁离子的能力,可能有助于白云岩的原生沉淀[7];但是,长期以来由于缺乏在常温常压下成功合成白云石的现代模拟实例,原生白云石化模式一直备受质疑。Vasconcelos(1995)研究小组采用厌氧菌作为媒介,在常温常压下克服了原生白云石化的化学动力学障碍,成功诱导合成了原生白云石[45],证实了自然环境下白云石可以直接沉淀。四川盆地北缘灯影组中大套质纯的微生物白云岩很可能为原生成因,蓝细菌生长发育活动对原生白云石的沉淀起着积极的作用,但两者间的具体联系还需深入研究。

5 结 论
a.米仓山地区灯影组白云岩中发育大量丝状、球状蓝细菌,前者形态分为管型(部分为葛万菌)、叠层型、凝块型,后者主要形成了大量的肾形菌,及少量形态保存较差的附枝菌。这些蓝细菌在岩石中的保存条件主要受控于蓝细菌EPS钙化作用,以及后期的成岩作用。
b.本区微生物碳酸盐岩有叠层石、凝块石;而与微生物作用相关的白云岩颗粒为团块、核形石、礁屑;部分砂屑被蓝细菌钻孔改造。
c.蓝细菌群落类型受环境控制,具分带性,因而造成了本区微生物岩的分带性。
d.本区发育2种类型的微生物礁:黏结型微生物礁和骨架型微生物礁。
e.灯影组微生物白云岩很可能为原生微生物成因,其原始沉积相带,以及后期的深埋溶蚀作用对于储集层发育具有重要控制作用;但是微生物岩成岩演化、储集空间演化的具体过程极其复杂,值得更加深入、系统地研究。
[参考文献]
[1] Burne R V, Moore L S. Microbialites: organosedimentary deposits of benthic microbial communities [J]. Palaios, 1987, 2(3): 241-254.
[2] Riding R. Calcified cyanobacteria[C]//Encyclopedia of Geobiology, Encyclopedia of Earth Science Series.Heidelberg: Springer, 2011: 211-223.
[3] Riding R. Microbial carbonates: the geological record of calcified bacterial-algal mats and biofilms [J]. Sedimentology, 2000, 47(Suppl.1): 179-214.
[4] 梅冥相.微生物碳酸盐岩分类体系的修订:对灰岩成因结构分类体系的补充[J].地学前缘,2007,14(5): 222-234.
Mei M X. Revised classification of microbial carbonates: complementing the classification of limestones [J]. Earth Science Frontiers, 2007, 14(5): 222-234. (In Chinese)
[5] 张荫本.川西南区震旦系地层岩石变质了吗?[J].石油地质实验, 1965(1):34-41.
Zhang Y B. Is the Sinian stratum metamorphic in the Southwest of Sichuan Basin? [J]. Petroleum Geology ﹠ Experiment, 1965(1): 31-41. (In Chinese)
[6] 曹仁关.西南地区震旦纪叠层石、核形石和变形石[J].中国地质科学学院学报:天津地质矿产研究所分刊,1980,1(1):91-101.
Cao R G. Stromatolites, oncolithes and catagraphes of the Sinian system in southwestern China [J]. Acta Geoscientia Sinica, 1980, 1(1): 91-101. (In Chinese)
[7] 唐天福,薛耀松,俞从流.中国南方震旦系碳酸盐岩的分布与形成环境[J].石油学报,1981,2(2):11-19.
Tang T F, Xue Y S, Yu C L. Distribution and depositional environments of the Sinian carbonates rocks in South China [J]. Acta Petrolei Sinica, 1981, 2(2): 11-19. (In Chinese)
[8] 杨万容,唐天福,张俊明,等.我国西南地区震旦系灯影组碳酸盐岩石学特征及其储集性[J].地球化学,1978(4):247-259.
Yang W R, Tang T F, Zhang J M,etal. On carbonate rocks of the Sinian Dengying Formation in Southwest China with respect to their characteristics [J]. Geochimica, 1978(4): 247-259. (In Chinese)
[9] 唐天福,薛耀松,俞从流.中国南方震旦纪藻碳酸盐岩的特征及环境意义[J].科学通报,1980(18):853-855.
Tang T F, Xue Y S, Yu C L. The characters and environment significance of the Sinian algae-carbonates in the southern part of China [J] . Chinese Science Bulletin, 1980(18): 853-855. (In Chinese)
[10] 唐天福,张俊明,杨万容,等.中国西南地区晚震旦世碳酸盐岩与磷块岩的沉积环境[J].地层学杂志,1980, 4(4):264-272.
Tang T F, Zhang J M, Yang W R,etal. The sedimentary environment of the late Simian carbonates in the Southwest of China [J]. Journal of Stratigraphy, 1980, 4(4): 264-272. (In Chinese)
[11] 朱同兴,罗安屏.一个最古老的肾形藻泥丘相的首次发现及其地质意义——以滇东北地区震旦系灯影组为例[J].岩相古地理,1992(4):20-28.
Zhu T X, Luo A P. First discovery of an oldestRenalcismound facies and its geological significance: an example from the Upper Sinian Dengying Formation in northeastern Yunnan [J]. Sedimentary Geology and Tethyan Geology, 1992(4): 20-28. (In Chinese)
[12] 方少仙,侯方浩,董兆雄.上震旦统灯影组中非叠层石生态系蓝细菌白云岩[J].沉积学报,2003,21(1):96-105.
Fang S X, Hou F H, Dong Z X. Non-stromatoltite ecologic system cyanobacteria dolostone in Dengying Formation of Upper-Sinian [J]. Acta Sedmentologica Sinica, 2003, 21(1): 96-105. (In Chinese)
[13] Pratt B R.EpiphytonandRenalcis-diagenetic microfossils from calcification of coccoid blue-green algae [J]. Journal of Sedimentary Petrology, 1984, 54: 948-971.
[14] Stephens N P, Sumner D Y.Renalcidsas fossilized biofilm clusters [J]. Palaios, 2002, 17: 225-236.
[15] Woo J, Chough S K, Han Z Z. Chambers ofEpiphytonthalliin microbial buildups, Zhangxia Formation (Middle Cambrian), Shandong Province, China [J]. Palaios, 2008, 23: 55-64.
[16] Turner E C, James N P, Narbonne G. Taphonomic control on microstructure in Early Neoproterozoic reefal stromatolites and thrombolites [J]. Palaios, 2000, 15: 87-111.
[17] Knoll A H, Fairchild I J, Swett K. Calcified microbes in Neoproterozoic carbonates: implications for our understanding of the Proterozoic/Cambrian transition [J]. Palaios, 1993, 8: 512-525.
[18] Riding R. Cyanobacterial calcification, carbon dioxide concentrating mechanisms, and Proterozoic-Cambrian changes in atmospheric composition [J]. Geobiology, 2006, 4: 299-316.
[19] Riding R.Girvanellaand other algae as depth indicators [J]. Lethaia, 1975, 8: 173-179.
[20] Riding R. CalcifiedPlectonema(blue-green algae), a recent example ofGirvanellafrom Aldabra Atoll [J]. Palaeontology, 1977, 20(part 1):33-46.
[21] Coniglio M, James N P. Calcified algae as sediment contributors to early Paleozoic limestones: evidence from deep-water sediments of the Cow Head Group, western Newfoundland [J]. Journal of Sedimentary Petrology, 1985, 55: 746-754.
[22] Riding R, Voronova L. Recent freshwaterOscillatoriaceananalogue of the Lower Palaeozoic calcareous algaAngulocellularia[J]. Lethaia, 1982, 15: 105 -114.
[23] Kah L C, Knoll A H. Microbenthic distribution of Proterozoic tidal flats: Environmental and taphonomic considerations [J]. Geology, 1996, 24(1): 79-82.
[24] Kazmierczak J, Coleman M L, Gruszczynski M,etal. Cyanobacterial key to the genesis of micritic and peloidal limestones in ancient seas [J]. Acta Palaeontologica Polonica, 1996, 41(4): 319-338.
[25] Riding R, Awramik M A, Winsborough B M,etal. Bahamian giant stromatolites : microbial composition of surface mats [J].Geology, 1991, 128(3): 227-234.
[26]Riding R. Skeletal stromatolites [C]//Fossil Algae, Recent Results and Developments. Berlin: Springer-Verlag, 1977: 57-60.
[27] Riding R, Sharma M. Late Palaeoproterozoic (~1800~1600 Ma) stromatolites, Cuddapah Basin, southern India: cyanobacterial or other bacterial microfabrics? [J]. Precambrian Research, 1998, 92: 21-35.
[28] Riding R. Abiogenic, microbial and hybrid authigenic carbonate crusts: components of Precambrian stromatolites [J]. Geologia Croatica, 2008, 61(2/3): 73-103.
[29] Grotzinger J P, Koll A H. Anomalous carbonate precipitates: is the Precambrian the key to the Permian? [J]. Palaios, 1995, 10(6): 578-596.
[30] Pratt B R. Calcification of cyanobacterial filaments: Girvanella and the origin of Lower Paleozoic lime mud [J]. Geology, 2001, 29(9):763-766.
[31] 薛耀松,唐天福,俞从流.鸟眼构造的成因及其环境意义[J].沉积学报,1984,2(1):85-95.
Xue Y S, Tang T F, Yu C L. The origin and environmental significance of birdseye structures [J]. Acta Sedimentologica Sinica, 1984, 2(1): 85-95. (In Chinese)
[32] Braga J C, Martin J M. Controls on microbial dome fabrics development along a carbonate-siliciclastic shelf-basin transect, Miocene, SE Spain [J]. Palaios, 1995, 10(4): 347-361.
[33] Pratt B R. Stromatolitic framework of carbonate mud-mounds [J]. Journal of Sedimentary Petrology, 1982, 52(4): 1203-1227.
[34] Aitken J D. Classification and environmental significance of cryptalgal limestones and dolomites, with illustrations from the Cambrian and Ordovician of southwestern Alberta [J]. Journal of Sedimentary Petrology, 1967, 37: 1163-1178.
[35] Kennard J M, James N P. Thrombolites and stromatolites: two distinct types of microbial structures [J]. Palaios, 1986, 1: 492-503.
[36] Shapiro R S. A comment on the systematic confusion of thrombolites [J]. Palaios, 2000, 15(2): 166-169.
[37]Flugel E. Microfacies of Carbonate Rocks: Analysis, Interpretation and Application [M]. Berlin, Heidelberg: Springer-Verlag, 2004.
[38] 梅冥相,周鹏,张海,等.上扬子区震旦系层序地层格架及其形成的古地理背景[J].古地理学报,2006, 8(2):219-231.
Mei M X, Zhou P, Zhang H,etal. Sequence-stratigraphic frameworks and their forming backgrounds of paleogeography for the Lower Cambrian of the Upper-Yangtze region [J]. Geoscience, 2006, 20(2): 195-208. (In Chinese)
[39] 宋金民,罗平,杨式升,等.塔里木盆地苏盖特布拉克地区下寒武统肖尔布拉克组碳酸盐岩微生物建造特征[J].古地理学报,2012,14(3):341-354.
Song J M, Luo P, Yang S S,etal. Carbonate rock microbial construction of the Lower Cambrian Xiaoerblak Formation in Sugaitblak area, Tarim Basin [J]. Journal of Palaeogeography, 2012, 14(3): 341-354. (In Chinese)
[40] Perry C T. Biofilm-related calcification, sediment trapping and constructive micrite envelopes: a criterion for the recognition of ancient grass-bed environments? [J]. Sedimentology, 1999, 46: 33-45.
[41] Lambert I B, Walter M R, Zang W L,etal. Palaeoenvironment and carbonate isotope stratigraphy of Upper Proterozoic carbonates of the Yangtze Platform [J]. Nature, 1987, 325(8):140-142.
[42] 王宗哲,杨杰东,孙卫国.扬子地台震旦纪海水碳同位素的变化[J].高校地质学报,1996,2(1):112-120.
Wang Z Z, Yang J D, Sun W G. Carbon isotope record of Sinian seawater in Yangtze Platform [J]. Geological Journal of Universities, 1996, 2(1): 112-120. (In Chinese)
[43] 黄志诚,陈智娜,杨守业,等.中国南方灯影峡期海洋碳酸盐岩原始δ13C和δ18O组成及海水温度[J].古地理学报,1999,3(1):1-7.
Huang Z C, Chen Z N, Yang S Y,etal. Primaryδ13C andδ18O values in marine carbonates and the sea water temperature of Dengyingxia Age in South China [J]. Journal of Palaeogeography, 1999, 3(1): 1-7. (In Chinese)
[44] Riding R. Structure and composition of organic reefs and carbonate mud mounds: concepts and categories [J]. Earth-Science Reviews, 2002, 58: 163-231.
[45] Vasconcelos C, Mckenzie J A, Bernasconi S,etal. Microbial mediation as a possible mechanism for natural dolomite formation at low temperatures [J]. Nature, 1995, 377(21): 220-222.
[46] Mancini E A, Llians J C, Scott R W,etal.Potential reef-reservoir facies: Lower Cretaceous deep-water thrombolites, onshore central Gulf of Mexico [J]. Gulf Coast Association of Geological Societies Transactions, 2005, 55: 505-515.
[47] Mancini E A, Llians J C, Parcell W C,etal. Upper Jurassic thrombolite reservoir play, northeastern Gulf of Mexico [J]. AAPG Bulletin, 2004, 88(11): 1573-1602.
[48] Mancini E A, Parcell W C, Ahr W M,etal. Upper Jurassic updip stratigraphic trap and associated Smackover microbial and nearshore carbonate facies, eastern Gulf coastal plain [J]. AAPG Bulletin, 2008, 92(4): 417-442.
[49] 吴庆余,盛国英,傅家谟.一种蓝细菌的热解产气模拟[J].科学通报,1988(18):1419-1421.
Wu Q Y, Sheng G Y, Fu J M. The pyrogenic decomposition and gas production simulation of one type of cyanobacterium [J]. Chinese Science Bulletin, 1988(18): 1419-1421. (In Chinese)

