住院2型糖尿病患者糖尿病周围神经病变相关因素分析
黄晓敏 李枢 刘伟芳
糖尿病周围神经病变(DPN)是2型糖尿病最常见的慢性并发症之一,表现为肢体顽固性疼痛、麻木及无力等,具有起病缓慢、隐匿性强、症状逐渐加重、不易逆转等特点,严重影响患者的生活质量[1]。本研究探讨了2型糖尿病患者发生DPN的相关因素,旨在为其防治提供依据,现报告如下。
对象和方法
一、研究对象
连续选取2012年10月至2013年9月在我科住院的2型糖尿病患者,同时排除有以下疾病者:①遗传因素、药物、毒物、乙醇、维生素B12缺乏、手术及其他代谢疾病所致周围神经病变;②严重肝、肾功能不全;③严重心脑血管疾病;④脉管炎;⑤颈、腰椎病变;⑥SLE;⑦吉兰-巴雷综合征;⑧糖尿病急性并发症。共纳入患者219例,均符合1999年WHO糖尿病诊断及分型标准。其中男110例,女109例;年龄19~84岁,中位年龄58岁;病程1个月至32年,中位病程8年;空腹血糖(10.4±3.6)mmol/L。根据患者是否合并DPN分为DPN组(153例)及非DPN组(66例)。
二、DPN诊断标准
根据2009年中国医师协会内分泌代谢医师协会制定的DPN诊断标准,以下检查中有2项或2项以上异常诊断为DPN:①足部感觉减退或消失;②踝反射消失;③温度觉异常;④振动觉异常;⑤有2项或2项以上神经传导速度减慢[2]。需排除其他病因引起的神经病变。
三、研究方法
1.一般资料收集
记录患者的年龄、性别、糖尿病病程、吸烟史(吸烟指连续或累计吸烟6个月或以上[3])、饮酒史(饮酒指平均每周饮酒1次或以上[4])、高血压病史,入院首日测定收缩压、舒张压、身高、体质量,计算BMI。
2.实验室指标检测
采用Bio-Rad全自动糖化血红蛋白(HbA1c)分析仪以高压液相法测定HbA1c。采用罗氏Cobas8000生化仪测定生化指标,包括LDL-C、HDL-C、总胆固醇、甘油三酯、血尿酸、标准馒头餐试验的空腹血糖和餐后2 h血糖(2 h PG)。采用DFM-96型放射免疫计数器以放免法测定空腹C肽。留取8 h过夜尿(晚10点~早6点)送检尿微量白蛋白排泄率(UAER)。
3.肌电图检查
以丹麦产Keypoint肌电诱发电位分析仪测定每例患者的正中神经、胫神经、腓总神经的运动神经传导速度和正中神经、腓总神经的感觉神经传导速度。
4.糖尿病肾病筛查
患者UAER≥20 μg/min,且排除尿路感染、尿路梗阻、肾炎、发热等对UAER有影响的因素后,诊为糖尿病肾病(DN)。
5.糖尿病视网膜病变筛查
由眼科专科医师对患者散瞳后行眼底镜检查,必要时行眼底荧光血管造影,根据眼底检查所见,有背景型病变或增殖型病变者诊断为糖尿病视网膜病变(DR)。
三、 统计学处理
结 果
一、非DPN组与DPN组的2型糖尿病患者一般资料比较
219例2型糖尿病患者中,合并DPN 153例,非DPN 66例, DPN的发生率为69.9%(153/219)。与非DPN组相比,DPN组年龄高、糖尿病病程长(P<0.01);DPN组HbA1c、空腹血糖、2 h PG、UAER水平及合并DR比例均高于非DPN组(P<0.05或0.01);两组间其余临床指标比较差异无统计学意义(P均>0.05),见表1。
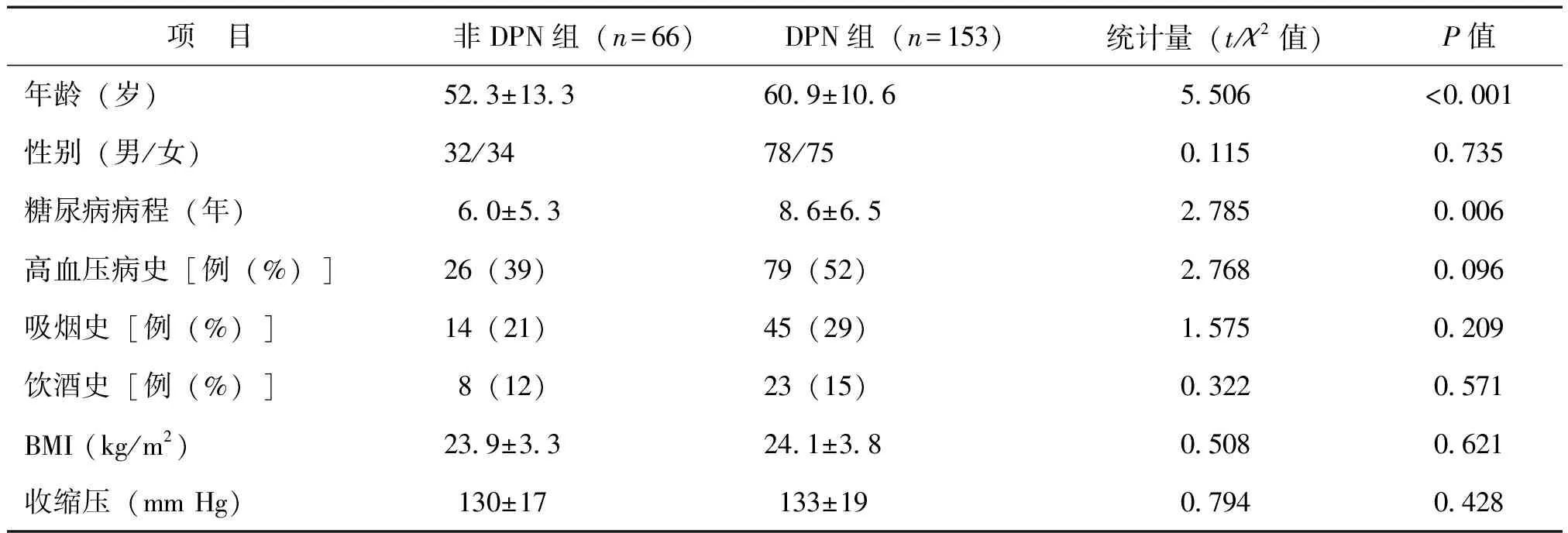
表1 非DPN组与DPN组2型糖尿病患者临床资料比较
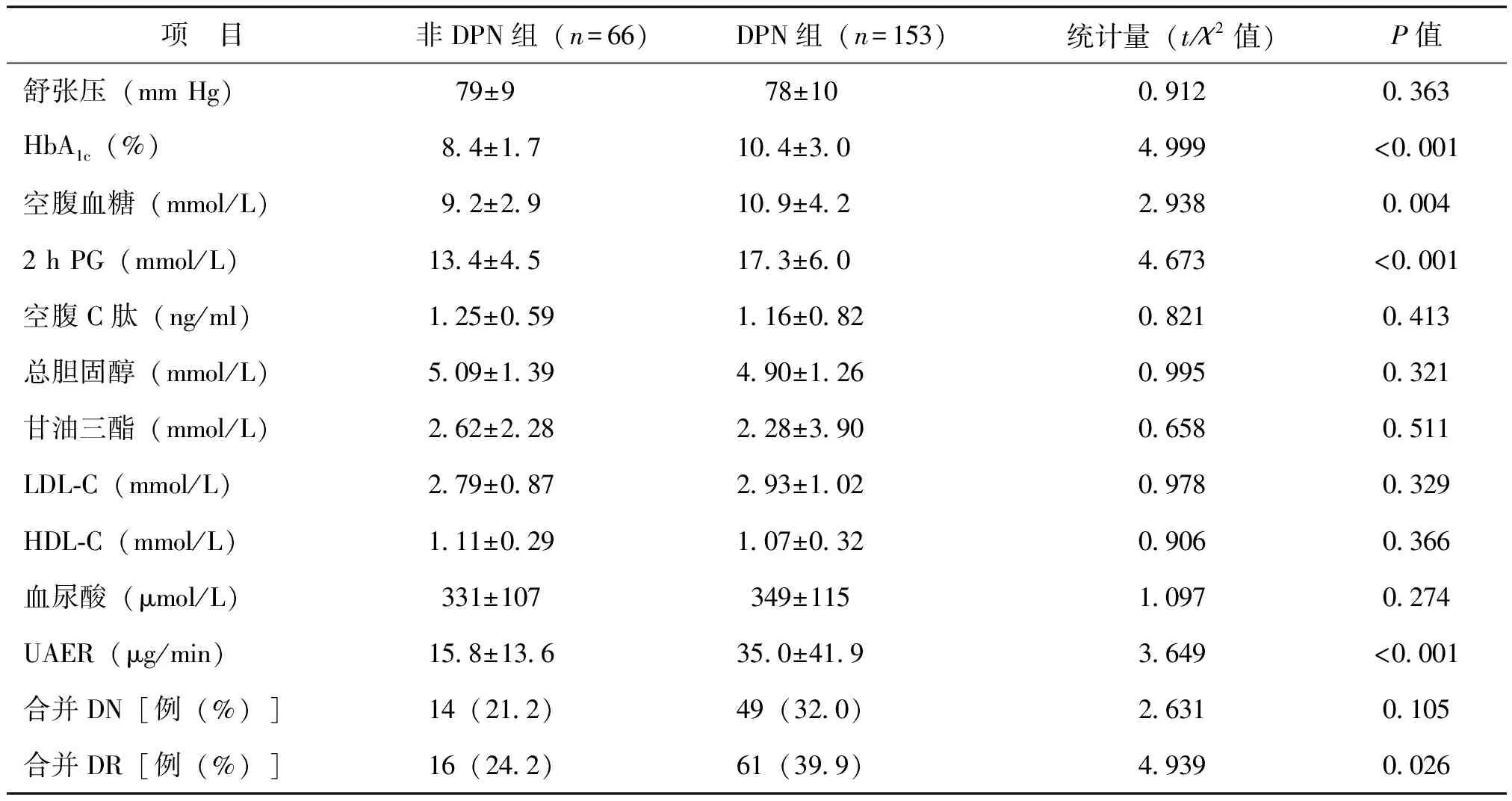
续表
二、Logistic回归分析
将DPN组与非DPN组间比较有统计学意义的年龄、糖尿病病程、HbA1c、空腹血糖、2 h PG、UAER及是否合并DR等因素纳入Logistic回归分析。与空腹血糖及2 h PG相比,HbA1c可以更全面、有效反映血糖长期控制情况,因此以有、无DPN为因变量,选择年龄、糖尿病病程、HbA1c、UAER及是否合并DR为自变量,进行二分类Logistic逐步回归分析。结果显示住院2型糖尿病患者DPN的发生与年龄、HbA1c、UAER及合并DR有关,OR值分别为1.071、1.315、1.039、2.255,即高龄、HbA1c高、UAER高及合并DR的住院2型糖尿病患者可能更易发生DPN,见表2。
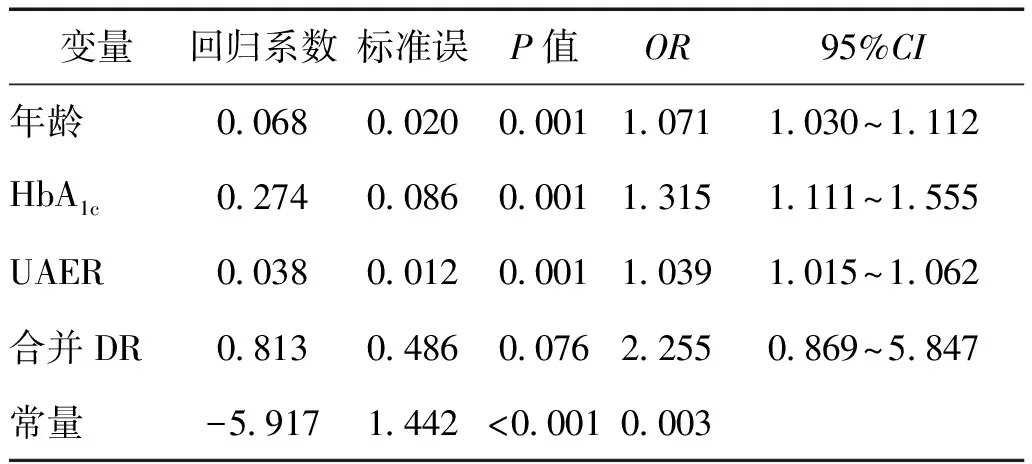
表2 DPN的Logistic逐步回归分析
讨 论
DPN是糖尿病常见的慢性并发症之一,患病率报道不一,李守华等[5]报道的2型糖尿病患者DPN发生率为59.8%,该研究的对象为非住院患者,中位年龄55岁、糖尿病中位病程5年、平均空腹血糖8.9 mmol/L。本研究中,住院2型糖尿病患者DPN发生率为69.9%,DPN发生率相对较高,这可能与本研究的对象为住院患者,中位年龄58.3岁、糖尿病中位病程8年、平均空腹血糖10.4 mmol/L,研究对象年龄较大、病程较长、血糖控制欠佳等有关。
DPN发病机制复杂,现有观点认为与长期高血糖导致的代谢紊乱、微循环障碍、氧化应激损伤、神经生长因子缺乏等因素有关[6]。DPN通常是一个隐匿、渐进的过程,糖尿病患者一旦发生DPN,生活质量常受到严重影响,且过程难以逆转,通过对DPN相关因素的研究,对早期发现、早期治疗DPN,具有重要的意义。目前国内及国外均有对2型糖尿病患者发生DPN的相关因素的研究,因研究背景及研究方法等不同,结论也不尽一致[5,7-8]。本结果显示,两组患者的年龄、糖尿病病程、HbA1c、空腹血糖、2 h PG、UAER及合并DR比例比较差异有统计学意义。Logistic回归分析表明,2型糖尿病患者DPN与年龄、HbA1c、UAER及合并DR有关,OR值分别为1.071、1.315、1.039、2.255,即高龄、HbA1c高、UAER高及合并DR的住院2型糖尿病患者可能更易发生DPN。李守华等[5]研究表明DPN与性别、年龄、糖尿病病程、腰高比、踝肱指数、空腹血糖、空腹胰岛素有关,周燕等[7]研究表明DPN与年龄、LDL、糖尿病病程、HbA1c有关,与本研究不完全一致,可能与研究对象不同及纳入研究指标不同有关。
高血糖是DPN的重要发病因素[9]。良好的血糖控制可延缓DPN的发生[10]。HbA1c是反映糖尿病长期血糖控制情况的重要指标,本研究表明,HbA1c高是2型糖尿病患者DPN的重要相关因素,与国内部分学者研究一致,再次证明了高血糖在DPN发生中的重要作用[7,11]。高血糖导致大量糖基化终末产物形成,引起血管通透性增加和血管壁增厚,血管壁韧性减低,导致血管舒张功能障碍,进而造成神经缺血、缺氧,导致糖尿病神经病变发生。同时,高血糖可激活醛糖还原酶,导致神经细胞内的山梨醇增多,造成水钠潴留及Na+-K+ATP酶活性减低,致使神经细胞水肿、变性、坏死[6]。
研究提示,DPN患病率随患者年龄增长而升高,年龄是2型糖尿病患者发生DPN的独立危险因素,与本研究结果一致[12-13]。本研究还显示,2型糖尿病患者DPN与UAER有关,UAER是早期DN的敏感指标,DPN与DN同属糖尿病微血管并发症,存在着类似的病理基础,高血糖导致组织细胞代谢障碍,如多元醇通路的激活、己糖胺途径的激活、蛋白激酶C途径的激活等,进而导致微血管壁基底膜增厚及内皮细胞功能障碍[14]。UAER是反映糖尿病血管内皮功能障碍的独立预测因子,因此UAER与DPN有一定的相关性。DR是糖尿病微血管病变之一,与DPN两者的病理基础均与糖代谢紊乱、微血管病变有关,本研究结果表明,合并DR是2型糖尿病患者DPN的重要相关因素,即DR患者更易发生DPN,与胡泓等[15]报道一致,两者可能存在正相关平行性。
综上所述,住院2型糖尿病患者DPN发生率高,高龄、HbA1c高、UAER高及合并DR是2型糖尿病患者DPN的重要相关因素。因此,加强相关因素控制可能在DPN防治中起重要作用。本研究样本量较少,研究结论尚需大样本、前瞻性研究进一步证实。
[1] Kim ES, moon SD, Kim HS, et al. Diabetic peripheral neuropathy is associated with increased arterial stiffness without changes in carotid intima-media thickness in type 2 diabetes. Diabetes Care, 2011, 34: 1403-1405.
[2] 胡仁明, 樊东升. 糖尿病周围神经病变诊疗规范:征求意见稿. 中国糖尿病杂志, 2009, 17: 638-640.
[3] 马冠生, 孔灵芝, 栾德春, 等. 中国居民吸烟行为的现状分析. 中国慢性病预防与控制, 2005, 13: 195-199.
[4] 马冠生, 朱丹红, 胡小琪, 等. 中国居民饮酒行为现况. 营养学报, 2005, 27: 362-365.
[5] 李守华, 胡祥, 盛夏, 等. 宜昌市夷陵区农村2型糖尿病患者糖尿病周围神经病变患病状况及相关因素的研究. 中国糖尿病杂志, 2013, 21: 502-504.
[6] 施君, 张文川. 糖尿病周围神经病变发病机制的研究进展. 上海交通大学学报:医学版, 2012, 32:116-119.
[7] 周雁, 郭立新, 于冬妮, 等. 住院老年2型糖尿病患者微血管病变的相关因素分析. 中国老年医学, 2012, 32: 2005-2008.
[8] Wang W, Balamurugan A, Biddle J, et al. Diabetic neuropathy status and the concerns in underserved rural communities: challenges and opportunities for diabetes educators. Diabetes Educ, 2011, 37: 536-548.
[9] Ylitalo KR, Sowers M, Heeringa S. Peripheral vascular disease and peripheral neuropathy in individuals with cardiometabolic clustering and obesity:National Health and Nutrition Examination Survey 2001-2004. Diabetes Care, 2011, 34: 1642-1647.
[10] ISmail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes:an analysis of the ACCORD randomised trial. Lancet, 2010, 376: 419-430.
[11] 聂琛, 鲍海萍. 糖尿病周围神经病变的相关危险因素分析. 中华实验和临床病毒学杂志, 2012, 26: 467-469.
[12] Lu B, Yang Z, Wang M, et al. High prevalence of diabetic neuropathy in population-based patients diagnosed with type 2 diabetes in the Shanghai downtown. Diabetes Res Clin Pract, 2010, 88: 289-294.
[13] Booya F, Bandarian F, Larijani B, et al. Potential risk factors for diabetic neuropathy: A case control study. BMC Neurol, 2005, 5: 24.
[14] Wirta OR, Pasternack AI, Mustonen JT, et al. Urinary albumin excretion rate is independently related to autonomic neuropathy in type 2 diabetes mellitus. J Intern Med, 1999, 245: 329-335.
[15] 胡泓, 李红, 郑芬萍, 等. 不同神经病变评分系统在无症状糖尿病周围神经病变筛查中的临床价值比较. 中华内科杂志, 2012, 51: 14-17.

