冠心病患者血清内脂素水平与炎症标志物及组织因子的关系
赵剑 夏大胜 李彬 李超 张峰
内脂素又称为前B细胞克隆增强因子,是一种由脂肪组织分泌的细胞因子,临床研究发现冠状动脉粥样硬化性心脏病(冠心病)患者存在高内脂素血症[1]。磷酸化c-jun是激活蛋白-1的活性形式,可作为核转录因子对动脉粥样硬化形成过程中各种炎症因子的生成进行调控;CD40L是相对分子量为39×103的Ⅱ型跨膜蛋白,主要表达于血小板膜表面,通过与CD40结合实现炎症信号细胞内传导。磷酸化c-jun与CD40L是体内重要的炎症反应标志物,研究显示冠心病患者磷酸化c-jun及CD40L水平升高[2-3]。组织因子(TF)是凝血途径的启动因子,与动脉粥样硬化整个病理过程关系密切[4]。本研究旨在探讨冠心病患者内脂素与炎症标志物磷酸化c-jun 、CD40L及组织因子的关系。
对象与方法
一、 研究对象
随机选取2012年9月 至2014年3月首次在天津市第一中心医院心内科住院治疗的75例不稳定型心绞痛(UAP)患者、65例稳定型心绞痛(SAP)患者,均经冠状动脉造影确诊,符合中华医学会心血管病学会制定的UAP或SAP诊断标准[5]。对照组60例,为冠状动脉造影正常、运动平板实验阴性的患者。所选研究对象均为排除脑血管疾病、周围动脉疾病、感染、全身免疫性疾病、肝肾功能不全、恶性肿瘤者的患者,且均未服用过影响血液炎性因子水平的药物,如激素类、免疫抑制剂、他汀类等药物。
二、方 法
1.内脂素、磷酸化c-jun、TF、组织因子途径抑制物(TFPI)指标检测
所有受试对象隔夜禁食12 h,清晨7时采集肘静脉血5 ml,室温下放置2 h后,以3 000×g离心10 min分离血清,-80℃冰箱中保存待检查。内脂素试剂盒购自美国ADL公司,磷酸化c-jun试剂盒购自美国CST公司,TF、TFPI试剂盒购自美国ADI公司,均采用双抗体夹心ELISA,严格按试剂盒说明书进行操作。通过计算机软件计算出内脂素、磷酸化c-jun、TF、TFPI血清水平。
2.血小板表面CD40L表达水平测定
受试者隔夜禁食12 h,清晨7时采取肘静脉血2 ml,加入含1%的EDTA抗凝试管中,全血检测血小板CD40L。流式抗体FTIC Mouse IgGκ及FTIC anti-human CD40L购自美国 BD PharMingen公司,按说明书要求进行操作。取2支FALCON管,分别标记(+)和(-),两管均加入标本(EDTA-K2抗凝静脉血)5 μl。向(-)管中加入FTIC Mouse IgGκ 20 μl,向(+)管中加入FTIC anti-human CD40L 20 μl,混匀。室温避光静置30 min。每管加入生理盐水2 ml,混匀,2 000 rpm离心5 min,弃上清。再向每管加入生理盐水1 ml,混匀,通过流式细胞仪统计血小板膜CD40L平均荧光强度。
三、统计学处理
结 果
一、UAP组、SAP组、对照组患者一般临床资料比较
UAP组、SAP组、对照组一般临床资料比较见表1。
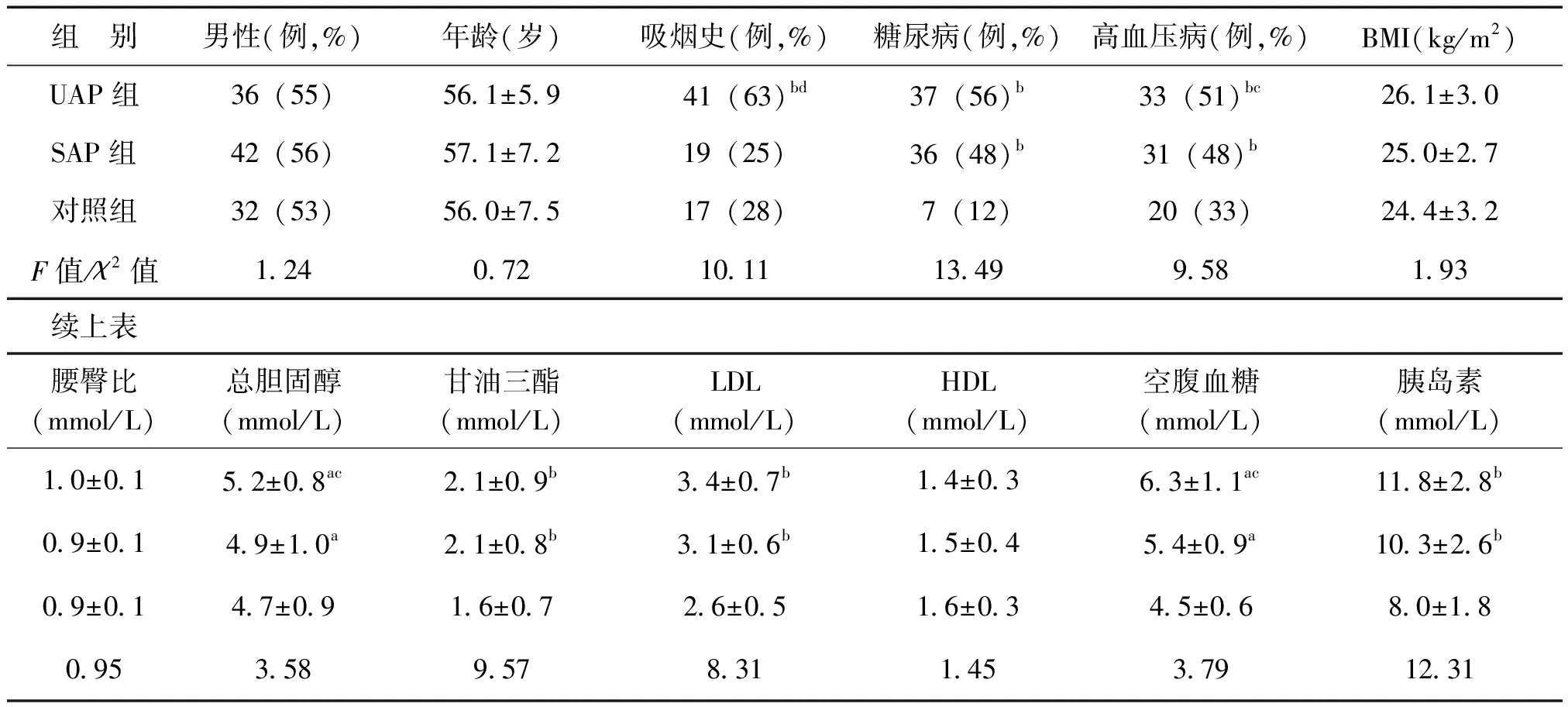
表1 UAP组、SAP组、对照组患者一般临床资料比较
二、UAP组、SAP组、对照组患者血清内脂素、磷酸化c-jun、CD40L、TF、TFPI及TF/TFPI水平的比较
UAP组患者血清内脂素、磷酸化c-jun、CD40L、TF、TFPI水平及TF/TFPI值高于SAP组及对照组(P<0.05或P<0.01);SAP组上述指标均高于对照组(P<0.05或P<0.01),见表2。
三、线性相关分析
冠心病患者内脂素水平与磷酸化c-jun、CD40L、TF、TFPI水平及TF/TFPI值呈正相关,相关系数分别为0.66、0.57、0.56、0.53、0.47(P均<0.01)。
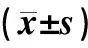
表2 三组患者血清内脂素、磷酸化c-jun、CD40L、TF、TFPI及TF/TFPI的比较
四、多重线性逐步回归分析
以冠心病患者年龄、性别(女=0,男=1)、吸烟史(否=0,是=1)、糖尿病史(否=0,是=1)、高血压病史(否=0,是=1)、BMI、WHR、TC、TG、LDL-C、HDL-C、空腹血糖、空腹胰岛素及内脂素为自变量,分别以磷酸化c-jun、CD40L、组织因子为因变量,进行多重线性逐步回归分析,结果显示血清内脂素水平与磷酸化c-jun、CD40L、TF水平呈独立正相关,见表3-5。
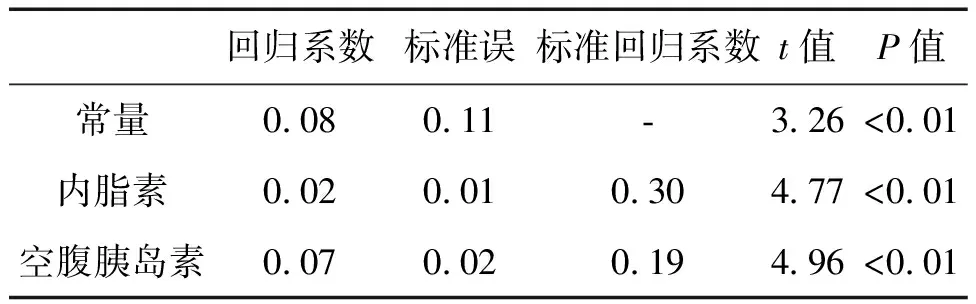
表3 冠心病患者血清磷酸化c-jun水平影响因素的多重线性回归分析
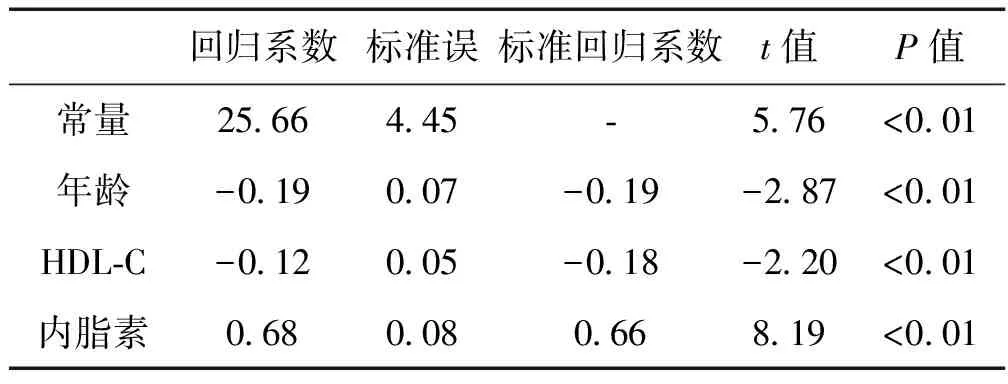
表4 冠心病患者血清CD40L水平影响因素的多重线性回归分析
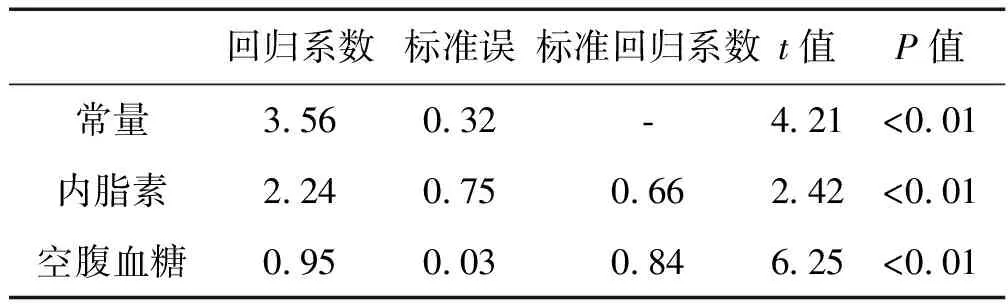
表5 冠心病患者血清TF水平影响因素的多重线性回归分析
讨 论
近年来人们对脂肪组织内分泌特性有了新的认识,以内脂素为代表的脂肪细胞因子日益受到关注。本研究结果显示冠心病患者表现为高内脂素血症,且血浆内脂素水平与病情程度相关。其机制可能是高内脂素血症通过促进内皮细胞增生、诱导血管平滑肌细胞增殖与变性、促进血小板聚集而影响冠状动脉粥样硬化发生和发展[5]。
内脂素与炎症反应关系密切,是体内重要的促炎症因子。研究显示内脂素通过促进IL-6、IL-8、MCP-1等炎症因子分泌和释放、诱导转录因子NF-kB活化参与机体炎症反应[6-7]。磷酸化c-jun与CD40L是体内重要的炎症反应标志物,本文结果表明冠心病患者磷酸化c-jun与CD40L水平明显升高;线性相关分析显示血清内脂素水平与磷酸化c-jun及CD40L呈正相关,在校正混杂因素后,二者仍呈独立正相关。磷酸化c-jun可以促进内皮细胞黏附分子产生、增加趋化因子表达,并通过促进巨噬细胞表面LOX-1表达增加泡沫细胞生成,进而促进动脉粥样硬化形成与发展。研究表明高内脂素血症通过诱导氧化应激反应提高内皮细胞活性氧化物(ROS)水平,ROS可以增加内脂素信号传导途径上c-jun氨基末端激酶磷酸化强度,进而促进c-jun活化[8]。另外,内脂素通过刺激血管紧张素原生成、增加血管紧张素转换酶活性促进血管紧张素Ⅱ(AngⅡ)产生,AngⅡ与受体AT1特异性结合,通过MAPK-JNK等细胞内信号传导通路实现c-jun磷酸化[9-10]。CD40L又称肿瘤坏死因子相关激活蛋白,存在于血小板α颗粒中,在血小板激活后迅速表达于血小板表面,与内皮细胞表达CD40相互作用实现炎症信号细胞内传导。内脂素通过促进内皮细胞炎症反应,致内皮损伤,激活凝血途径;诱导嗜酸粒细胞分泌血小板活化因子,促进血小板活化,提高 CD40L表达水平[11]。
TF即第三凝血因子,又称组织凝血活酶,是一个分子量约47 KD的跨膜糖蛋白,在启动凝血反应时,细胞表面TF首先与Ⅶa和(或)Ⅶ结合成TF-Ⅶa或TF-Ⅶ复合物。TF既是凝血因子Ⅶ(FⅦ)在细胞表面的受体,又是FⅦ或激活的因子Ⅶ的辅因子,它与Ⅶ或Ⅶa形成复合物,进而激活凝血因子Ⅹ与凝血因子Ⅸ,同时启动内、外两条凝血途径。血液中单核/巨噬细胞、多形核白细胞等均可表达TF,TF/FⅦa促进单核细胞向巨噬细胞转化,并诱导巨噬细胞产生炎症反应,同时通过调控细胞信号转导,促进成纤维细胞、单核细胞等迁移和增殖,参与动脉粥样硬化发生发展[12]。本研究发现冠心病患者血清TF水平升高,且UAP组高于SAP组;内脂素与TF水平呈独立正相关。高内脂素血症通过上调炎症相关转录因子NF-kB活性,引起TF mRNA转录增加,促进内皮细胞中组织因子合成[13]。高内脂素血症刺激单核/巨噬细胞分泌TNF-α、IL-6、IL-12,促进T淋巴细胞分泌IL-2、TNF-α、IL-18等细胞因子;影响肝脏分泌CRP;导致内皮细胞炎症反应,加剧内皮损伤、斑块破裂,进而促进组织因子表达。TFPI是生理条件下血液中存在的一种天然抗凝物质,可直接抑制FXa活性,也可形成TFPI-FXa-FⅦa-TF复合物抑制FⅦa-TF活性,抑制血栓形成。本文结果提示内脂素与TFPI、TF/TFPI呈正相关,表明内脂素在引起TF升高的同时,TFPI的表达也会代偿性升高,但增加的TFPI不能阻断TF所介导的凝血活性,TF-TFPI系统的失衡会随着内脂素水平升高而加剧。
综上所述,血清内脂素水平升高能够促进炎症标志物磷酸化c-jun、CD40L及组织因子表达,进而影响动脉粥样硬化形成与发展。
[1] Zhong M, Tan HW, Gong HP, et al.Increased serum visfatin in patients with metabolic syndrome and carotid atherosclerosis. Clin Endocrinol (Oxf),2008,69:878-884.
[2] 杨丽霞,郭瑞威,齐峰巨,等.噬细胞游走抑制因子及其下游信号通路血浆水平与冠状动脉病变程度的相关性.中华心血管病杂志,2008,36:912-915.
[3] Lievens D, Eijgelaar WJ, Biessen EA, et al.The multi-functionality of CD40L and its receptor CD40 in atherosclerosis. Thromb Haemost,2009,102:206-214.
[4] Breitenstein A, Tanner FC, Lüscher TF.Tissue factor and cardiovascular disease: quo vadis? Circ J,2010,74:3-12.
[5] Romacho T, Sánchez-Ferrer CF, Peiró C. Visfatin/Nampt: an adipokine with cardiovascular impact. Mediators Inflamm, 2013:946427.
[6] Liu SW, Qiao SB, Yuan JS, et al.Visfatin stimulates production of monocyte chemotactic protein-1 and interleukin-6 in human vein umbilical endothelial cells. Horm Metab Res,2009,41:281-286.
[7] Lee WJ, Wu CS, Lin H, et al.Visfatin-induced expression of inflammatory mediators in human endothelial cells through the NF-kappaB pathway. Int J Obes (Lond),2009,33:465-472.
[8] Oita RC, Ferdinando D, Wilson S, et al.Visfatin induces oxidative stress in differentiated C2C12 myotubes in an Akt- and MAPK-independent, NFkB- dependent manner. Pflugers Arch,2010,459:619-630.
[9] Huang Q, Guo Y, Zeng H, et al.Visfatin stimulates a cellular renin-angiotensin system in cultured rat mesangial cells. Endocr Res,2011,36:93-100.
[10] Ding G, Zhang A, Huang S, et al.ANG II induces c-Jun NH2-terminal kinase activation and proliferation of human mesangial cells via redox-sensitive transactivation of the EGFR. Am J Physiol Renal Physiol,2007,293:F1889-F1897.
[11] Moschen AR, Kaser A, Enrich B, et al.Visfatin, an adipocytokine with proinflammatory and immunomodulating properties. J Immunol,2007,178:1748-1758.
[12] ten Cate H.Tissue factor-driven thrombin generation and inflammation in atherosclerosis. Thromb Res,2012,129 Suppl 2:S38-S40.
[13] Cirillo P, Di Palma V, Maresca F, et al.The adipokine visfatin induces tissue factor expression in human coronary artery endothelial cells: another piece in the adipokines puzzle. Thromb Res,2012,130:403-408.

