珠子参ISSR-PCR反应体系的建立及优化
宋小妹,许苗苗,刘银环,王 薇,刘 超,杨新杰,崔九成(陕西中医学院,咸阳 712046)
珠子参为五加科人参属植物珠子参PanaxjaponicusC.A. Mey. var.major(Burk.) C.Y. Wu et K.M. Feng或羽叶三七PanaxjaponicusC.A. Mey. var.bipinnatifidus(Seem.) C.Y. Wu et K.M. Feng的干燥根茎,常用于治疗气阴两虚、烦热口渴、虚劳咳嗽、跌扑损伤、关节疼痛、咳血、外伤出血等症[1]。珠子参也是民间习用特色中药材太白七药之一,分布于我国陕西、四川、云南、甘肃、贵州等地。目前对珠子参的研究主要集中在生药、化学、药效[2-7]等方面,而在植物分子生物学研究方面的报道甚少;而珠子参由于受其生长环境等因素及人为过度采挖而被列为濒危药用植物。因此,开展珠子参的分子生物学和遗传学多样性方面的研究,对珠子参种质资源保护及资源的开发利用都将产生重要影响。
简单重复序列间区多态性标记(ISSR)是Zietkiewicz等[8]于1994年提出的一种基于微卫星(SSR)的十分有效的分子标记,具有多态性高、产率中等、重复性好、操作简单、引物开发无需任何DNA序列信息等优点,在不同的物种间具有通用性,比较适合于基因组未测序已知DNA序列信息量小的物种使用。目前,ISSR标记已广泛应用于植物种质资源鉴定评价、遗传图谱构建、重要性状标记、进化及分子生态学等研究中[9]。本实验旨在探索珠子参基因组DNA最优提取方法,建立和优化ISSR-PCR反应体系,为珠子参的分子鉴别提供理论基础和技术支持。
1 仪器与试药
1.1仪器 CT 9612型基因扩增仪(杭州柏恒科技有限公司);DYY-10C型电泳仪(北京六一仪器厂);UV-1800紫外检测器(日本岛津公司);S.M-76S型凝胶成像系统(意大利BIO-RAD Lab公司);3-18K型台式冷冻离心机(德国Sigma公司)。
1.2试药
1.2.1植物材料 23份样品(1,2及12~14号为新鲜根茎,其余均为新鲜叶片)分别采自陕西、四川、云南3个主产区的10个不同地区,保存于-80℃超低温冰箱中备用。所有样本均经陕西中医学院标本馆王继涛高级实验师鉴定,其中,除10号样本为羽叶三七PanaxjaponicusC.A. Mey. var.bipinnatifidus(Seem.) C.Y. Wu et K.M. Feng外,其余样本均为珠子参PanaxjaponicusC.A. Mey. var.major(Burk.) C.Y. Wu et K.M. Feng。
1.2.2试剂及引物 10×PCR Buffer、MgCl2、Taq DNA聚合酶、dNTP Mixture、DL2000 DNA Marker、新型植物基因组DNA提取试剂盒(nuclean plantgen DNA kit)均购自北京康为世纪生物科技有限公司;无水乙醇、氢氧化钠均为国产分析纯。所用ISSR引物参照加拿大的不列颠哥伦比亚大学所公布的序列,由上海生物工程有限公司合成。
2 实验方法
2.1基因组DNA的提取及检测 采用新型植物基因组DNA提取试剂盒(nuclean plantgen DNA kit),具体操作步骤如下:
取植物新鲜组织100 mg,加入液氮充分研磨。将研磨后的粉末收集到离心管中,加入400 μL Buffer GLP1和6 μL RNase A(10 mg·mL-1),涡旋振荡1 min,室温放置10 min,使其充分裂解。加入130 μL Buffer LP2,混匀,涡旋振荡1 min。以12 000 r·min-1离心5 min,将上清液移至新的离心管中。加入1.5倍体积的Buffer LP3充分混匀。将上步所得溶液和沉淀全部加入到已装入收集管的吸附柱中。以12 000 r·min-1离心1 min,弃去收集管中的废液,将吸附柱重新放回收集管中。向吸附柱中加入500 μL Buffer GW(使用前加无水乙醇),以12 000 r·min-1离心1 min,弃去收集管中的废液,将吸附柱重新放回收集管中。以12 000 r·min-1离心2 min,弃去收集管中的废液。将吸附柱置于室温数分钟,彻底晾干。将吸附柱重新放到一个新的离心管中,向吸附膜的中间部位悬空滴加50~100 μL Buffer GE或灭菌水,室温放置3 min,以12 000 r·min-1离心1 min,收集DNA溶液。-20 ℃保存备用。
采用18 g·L-1琼脂糖凝胶电泳以DL2000为标准检测DNA完整性,在紫外分光光度计上,根据A260/A280确定DNA的质量和浓度。将检验合格的所有供试DNA样品储存在-20 ℃冰箱中,保存备用。
2.2ISSR-PCR扩增条件优化 在前期查阅资料[10-14]及预实验的基础上,认为影响ISSR-PCR反应的主要因素为:dNTPs、引物、Taq DNA聚合酶、Mg2+、模板DNA浓度等,因此,采用L16(45)正交设计对影响ISSR-PCR反应的主要因素进行优化。影响因素水平见表1,实验设计方案见表2。
PCR总反应液体积除表1中所列外,还包括2 μL 10×PCR Buffer,用去离子水补足到20 μL。扩增引物采用通用引物UBC818,样品采用陕西太白县太白山山神庙珠子参叶DNA。

表1 ISSR-PCR反应体系正交实验因素水平表
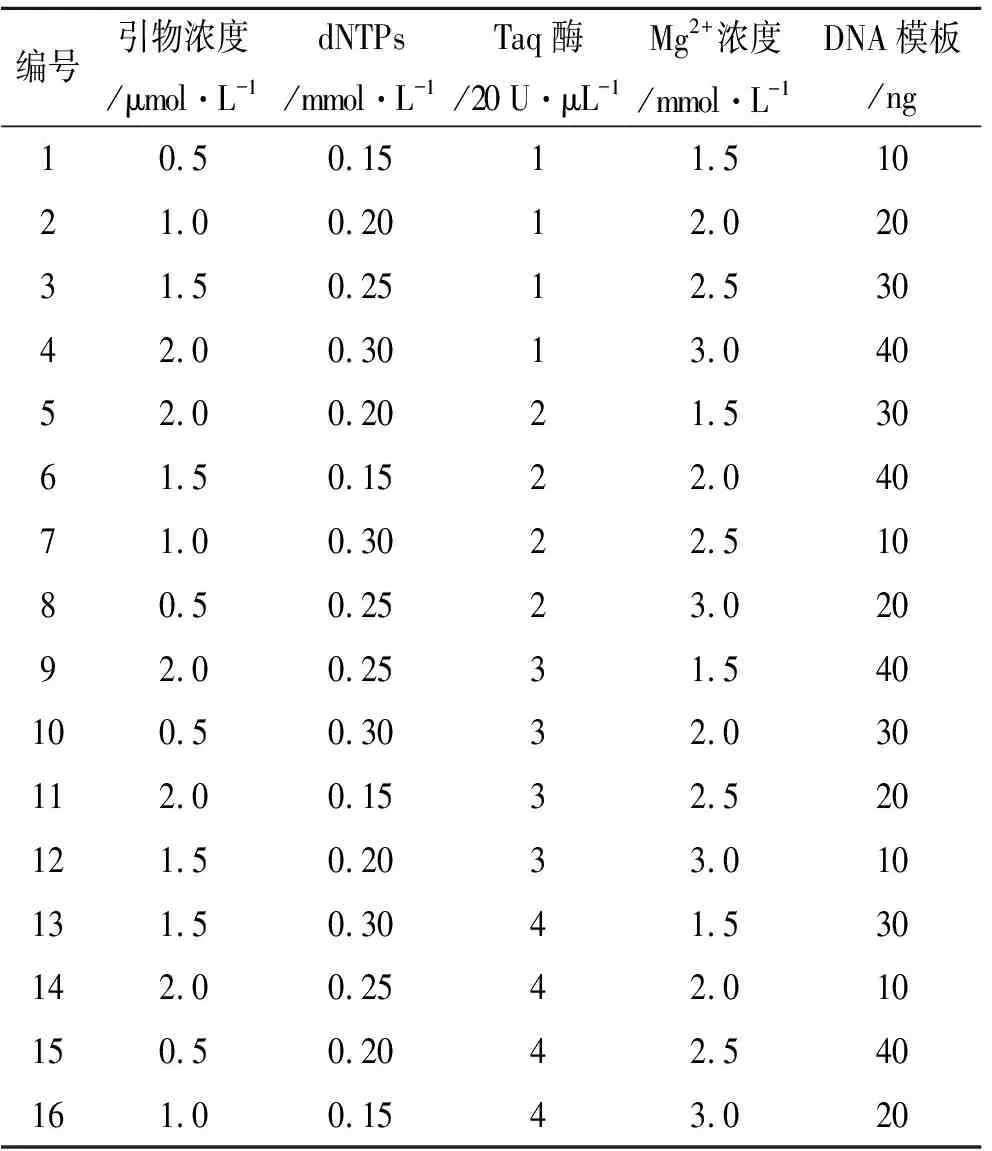
表2 ISSR反应体系L16(45)正交实验设计
初步设定的ISSR-PCR扩增程序为:95 ℃预变性5 min;94 ℃变性30 s;58 ℃退火30 min;72 ℃延伸1 min;循环40次;72 ℃延伸10 min,4 ℃保存。取10 μL扩增产物采用18 g·L-1的琼脂糖凝胶电泳检测,EB染色,置于紫外凝胶成像分析仪中观察拍照。
2.3ISSR-PCR扩增 按照优选出的反应体系采用UBC 818对23个DNA样品全部进行ISSR-PCR扩增。
3 结果与分析
3.1基因组DNA检测结果 在紫外分光光度计上测定DNA的A260与A280比值在1.8~2.0之间,电泳条带集中整齐、清晰明亮、无拖尾、无弥散,表明满足ISSR反应对DNA质量的要求。电泳结果见图1。

图1 珠子参基因组DNA
3.2正交实验结果和分析及引物筛选 琼脂糖凝胶电泳结果见图2,依据所显示的条带清晰度及条带数量等指标进行直观分析,14号条带扩增效果较好,即对应的表2中14号正交实验结果较好。因此最终优化出最佳反应体系为:20 μL的PCR反应体系中含2 μL 10×PCR Buffer、10 ng模板DNA、0.25 mmol· L-1dNTPs、2 μmol·L-1引物、4 U TaqDNA聚合酶、2 mmol·L-1Mg2+。扩增程序为:95 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 min,72 ℃延伸1 min,循环40次,72 ℃延伸10 min,4 ℃保存。

图2 正交实验ISSR-PCR反应体系扩增电泳图
3.3ISSR-PCR扩增结果 采用UBC 818对所有样本进行扩增的结果见图3。结果显示,此反应体系可以给出清晰的指纹图谱,而且,ISSR-PCR反应体系稳定可靠,可用于珠子参的分子的鉴别和遗传关系分析。

图3 样品的ISSR引物UBC818扩增谱带
4 讨论
珠子参所含皂苷类、多糖类等成分含量较高,在DNA提取过程中易与DNA共沉淀,形成黏稠的胶状物,难以溶解或产生褐变[15]。本实验珠子参DNA基因组的提取采用了新型的提取试剂盒,不仅提取步骤简便、效果好,而且获得的DNA样本纯度高、杂质少,特别适合于从野外采集样品DNA基因组的快速、高效提取。
影响ISSR-PCR扩增的因素很多。基于正交设计具有均衡分散、效应明确、综合可比、信息量大等优点,本研究采用5因素4水平正交实验确定了影响珠子参ISSR-PCR的引物浓度、模板浓度、Taq DNA聚合酶浓度、dNTP浓度、Mg2+浓度的最佳组合,筛选出了扩增条带清晰、多态性丰富的ISSR引物13个,建立了稳定的、可重复的珠子参ISSR-PCR最佳反应体系及PCR扩增参数。本研究主要应用引物UBC818进行扩增,优选出的条件基本适用于其他大多数引物,但是在具体使用的过程中还要根据不同引物的特征进行适当的微调,主要调整扩增过程中的退火温度,以期达到最好的扩增效果。
从图2和图3可以看出,样品10与其他样品DNA间差异较大。从来源得知,10号样品为羽叶三七,虽然与珠子参同为竹节参的变种均作为珠子参药用,但是从分子水平角度初步说明二者间有一定差异。
目前对珠子参从DNA层面展开的研究较少,前人对珠子参的ISSR-PCR分子标记技术研究很少,很多东西无从借鉴,这就为珠子参的更深入的研究带来一定的难度。本研究针对珠子参ISSR-PCR反应体系的研究,为珠子参种质资源的保护、遗传多样性的研究、药效成分的体内代谢和人工规模化栽培珠子参奠定了一定的基础。
参考文献:
[1] 国家药典委员会.中国药典2010年版[S].一部. 北京:中国医药科技出版社,2010:254.
[2] 王薇,李峰,宋小妹. 不同产地珠子参生药鉴定研究[J]. 时珍国医国药,2010,21(6):1468-1469.
[3] 宋小妹,刘越,蔡宝昌. 珠子参的化学成分[J]. 沈阳药科大学学报,2010,27(8):626-629.
[4] 宋小妹,杨新杰,王薇,等. 珠子参的HPLC指纹图谱及模式识别研究[J]. 中国实验方剂学杂志,2011,17(11):59-61.
[5] 张志清, 山学祥, 李东明, 等. 珠子参、羽叶三七规范化栽培生物学研究[J]. 云南中医药杂志,2011,32(9):34-36.
[6] 张志清,曹蕾,宋亮,等. 珠子参类药物历史沿革与应用展望[J]. 云南中医中药杂志,2012,33(9):68-71.
[7] 宋小妹,李渊源,宋蓓. 珠子参不同药用部位微量元素分析[J]. 西北药学杂志,2011,26(2):79-81.
[8] Zietkiewicz E,Rafalski A,Labuda D. Genome fingerprinting by simple sequence repeat(ISSR)anchored polymerasechain reaction amplification[J]. Genomics,1994,20:176-183.
[9] Pradeep Reddy M,Sarla N,Siddiq E A.Inter-simple sequence repeat ( ISSR) polymorphism and its application in plant breeding[J]. Euphytica,2002,128: 9-17.
[10]杨翠芳,陈伯伦,黄诚梅,等. 大果油茶基因组DNA 提取及ISSR 反应体系建立[J]. 南方农业学报,2011,42(3):233-235.
[11]汪琛颖,赵建成. 真藓科植物ISSR-PCR反应体系的优化及ISSR指纹图谱的初步构建[J]. 安徽农业科学,2011,39(27):16490-16493.
[12]王文峰,李毅,马彦军,等. 青海云杉ISSR-PCR反应体系的建立与优化[J]. 安徽农业科学,2009,7(21):9868-9871.
[13]庞赫,郭太君,胡志军,等. 大花君子兰ISSR-PCR反应体系的建立与优化[J]. 吉林农业大学学报,2010,32(2):167-171.
[14]刘峰,顾志敏,陈析丰,等. 长春花ISSR-PCR反应体系的正交优化[J]. 安徽农业科学,2010,38(5):2261-2262,2267.
[15]黄晓丹,张云贵,应铁进. 高质量植物基因组DNA的提取[J]. 植物生理学通讯,2006,42(2):311-314.

