茵陈多糖提取工艺优化
徐红欣,管立,回鹏,陈秋玲
(河北大学 药学院,河北省药物质量分析控制重点实验室,河北 保定 071002)
茵陈为菊科植物滨蒿(ArtemisiascopariaWaldst Et Kit)或茵陈蒿(ArtemisiacapillariesThunb)的干燥地上部分.苦、辛、微寒,归脾、胃、肝、胆经,清湿热,退黄疸,常用于黄疸尿少、湿疮瘙痒、传染性黄疸型肝炎等.其含有香豆素、黄酮、色原酮、有机酸、烯炔、三萜、甾体、多糖和醛酮等多类化学成分,其多糖主要含有葡萄糖、阿拉伯糖、甘露糖、木糖、半乳糖及果糖等组分[1-2].茵陈多糖具有抑菌[1,3]、护肝、调节细胞免疫平衡[4-7]、抗鼻咽癌[8]、抑制幽门螺旋杆菌对胃癌上皮细胞的粘附[9]等多方面的药理作用.目前对茵陈多糖提取工艺的研究基本上还是空白,本文利用单因素和均匀设计实验优化了茵陈多糖的提取工艺,得到的优化工艺条件为:提取温度100 ℃,提取时间80 min,提取液(mL)固(g)比50∶1,提取1次.验证实验3次,平均得率为2.25%,与预测值2.26%相比,误差仅为0.44%.
1 仪器与试剂
FA2104N型电子分析天平(上海民桥精密科学仪器有限公司);HH-1数显恒温水浴锅(金坛市晶玻实验仪器厂);80-2离心机(上海荣泰生化工程有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);GZX-9070电热恒温鼓风干燥箱(上海博讯实业有限公司医疗设备厂);DZF-6050真空干燥箱(巩义市予华仪器责任有限责任公司);SHD-Ⅲ型循环水式多用真空泵(保定市新区阳光科教仪器厂);BCD-223MT冰箱(河南新飞电器有限公司);722可见分光光度计(上海菁华科技仪器有限公司);移液枪(上海佳安分析仪器厂);95%乙醇(分析纯,天津市美琳工贸有限公司);苯酚(分析纯,天津市福晨化学试剂厂).蒸馏水(实验室自制);茵陈(河北省安国药材市场),经笔者鉴定为茵陈蒿ArtemisiacapillariesThunb 的干燥地上部分.
2 实验方法
2.1 茵陈多糖的提取工艺流程
将茵陈蒿在70 ℃真空干燥3 h后,粉碎,过筛,精确称取2.5 g于250 mL茄型瓶中,加入规定液固比的蒸馏水,在选择的水浴温度加热回流规定时间,过滤,将滤液真空旋转蒸发浓缩至约10 mL,加体积分数为95%乙醇30 mL,置具塞锥形瓶中,放置冰箱4 ℃过夜,然后离心弃去上清液,取沉淀,于50 ℃真空干燥,精密称重.
2.2 提取工艺最优参数的确定
在单因素实验时,依次改变提取液固比、提取温度、提取时间,以纯多糖得率为评价指标进行分析,并在此基础上确定均匀设计实验的参数,均匀设计实验方案及结果见表1.
2.3 苯酚硫酸法测定多糖含量
2.3.1 标准曲线的绘制
储备液的制备:精密称取干燥至恒重的葡萄糖0.125 9 g,加蒸馏水溶解,转移至100 mL容量瓶中定容,摇匀得125.9 mg/L的储备液.
标准液的制备:分别精密量取储备液1.0,0.8,0.6,0.4,0.2 mL,置于25 mL的容量瓶中定容,则得5个不同浓度的标准液.
50 g/L苯酚溶液的制备:取苯酚100 g,加入铝片0.2 g,碳酸氢钠0.2 g,蒸馏,收集(180±2) ℃馏分,称取馏分1.2512 g于烧杯中,用约50 ℃的蒸馏水溶解,转移至250 mL棕色容量瓶中定容,置于冰箱中备用.
标准曲线的绘制:分别移取2 mL各浓度标准溶液于具塞试管中,快速加入1 mL 50 g/L的苯酚溶液,充分混匀,再移取5 mL浓硫酸快速加入其中,盖好试管塞,充分摇匀.沸水浴15 min,冷水浴10 min,室温放置5 min.以蒸馏水为空白对照,分别在490 nm处测定吸光度,以吸光度A为纵坐标,以葡萄糖标准溶液c为横坐标,绘制标准曲线,得方程:A=0.014 6c+0.074,相关系数:r2=0.999 2,线性为:10.072~50.360 mg/L.
2.3.2 茵陈多糖含量的测定
精密称取实验所得粗多糖约0.010 0 g于小烧杯中,加少量蒸馏水搅拌溶解,转移至250 mL容量瓶中定容,得茵陈多糖供试品溶液.移取2 mL供试品溶液于具塞试管中,加入1 mL 50 g/L的苯酚溶液,充分混匀,再加入5 mL浓硫酸,充分混匀.沸水浴15 min,冷水浴10 min,室温放置5 min,在490 nm处测定吸光度,以蒸馏水为空白对照.依标准曲线方程计算多糖浓度及产率.
3 结果与讨论
3.1 单因素实验结果
3.1.1 提取液固比对茵陈多糖产率的影响
采用提取温度80 ℃,提取时间2.5 h,提取1次,考察了液固比对多糖产率的影响.考察液固比依次为40∶1,50∶1,60∶1,70∶1,80∶1,多糖产率分别为1.56%,1.70%,1.44%,1.41%,1.39%,如图1所示.
图1表明,液固比在40∶1和50∶1之间纯多糖产率共提高8.97%,在50∶1到60∶1之间,反而大幅度下降15.29%,在60∶1与80∶1之间仍呈下降趋势,但下降趋势已不明显.判断液固比到达50∶1之后,多糖成分已基本溶出,所以液固比50∶1左右最为合适.
3.1.2 提取温度对茵陈多糖产率的影响
采用提取液固比为40∶1,提取时间2.5 h,提取1次,考察了提取温度对多糖产率的影响.考察温度为60,70,80,90,100 ℃,多糖产率分别为1.05%,1.13%,1.46%,1.61%,2.30%,如图2所示.
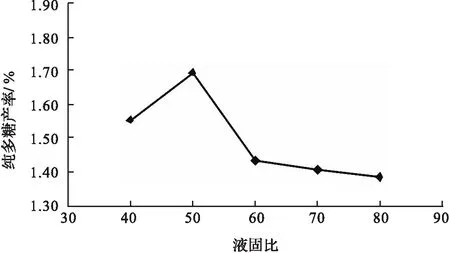
图1 提取液固比对茵陈多糖产率的影响 Fig.1 effect of liquid-solid ratio on Artemisia capillaris polysaccharides yield
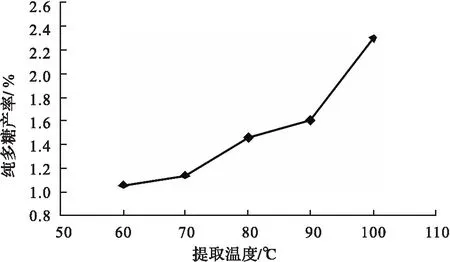
图2 提取温度对茵陈多糖产率的影响 Fig.2 effect of extracting temperature on Artemisia capillaris polysaccharides yield
由图2可以看出,随着温度的上升,纯多糖产率呈上升趋势,说明温度的提高对多糖的溶出有帮助,得出多糖的最佳提取温度为100 ℃.
3.1.3 提取时间对茵陈多糖产率的影响
采用提取温度80 ℃,提取液固比40∶1,提取1次,考察了提取时间对纯多糖产率的影响.考察时间分别为0.5,1,1.5,2,2.5,3 h,多糖产率相应依次为1.57%,1.73%,1.62%,1.56%,1.50%.如图3所示.
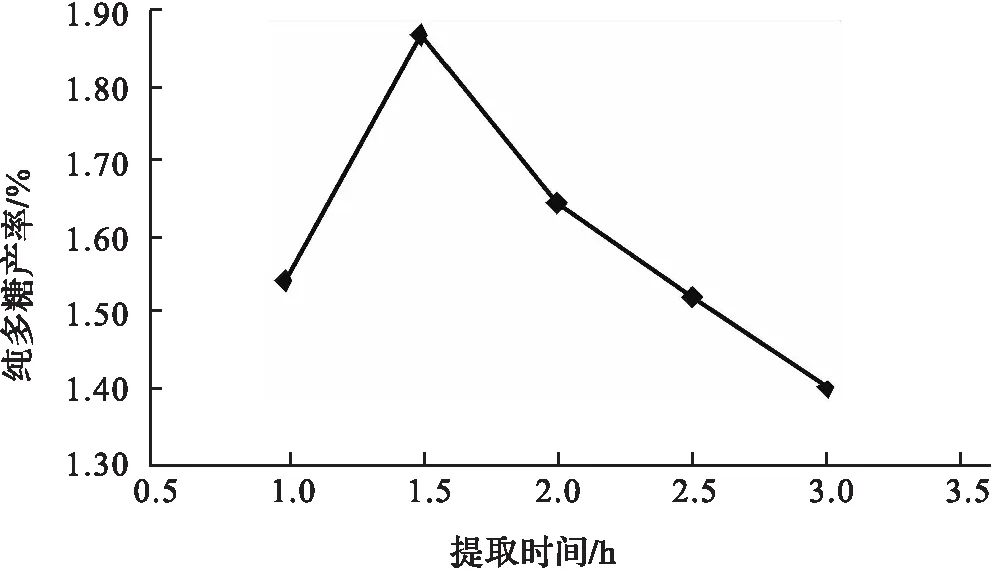
图3 提取时间对茵陈多糖产率的影响 Fig.3 Effect of extraction time on Artemisia capillaris polysaccharides yield
由图3可以看出,提取时间超过1.5 h后多糖产率并未继续增加,反而下降;而1.5 h之前,多糖产率呈增加趋势且1.5 h时达到最高,故1.5 h左右为最佳提取时间.
3.2 均匀设计实验结果
依据之前单因素实验结果,确定了温度、液固比和时间这3个因素的取值范围:提取温度X1∶55~100 ℃;液固比X2∶30∶1~75∶1;提取时间X3∶50 ~140 min.所设计均匀设计实验方案及结果见表1.

表1 均匀设计实验方案U10(103)及结果Tab.1 Uniform design experimental program U10 (103) and results
用SPSS 19.0以纯多糖得率为因变量,以提取温度、提取液固比、提取时间为自变量进行回归分析,得回归方程如表2所示.

表2 回归方程列表Tab.2 Regression equation list
表2中,Y为纯多糖产率,X1为提取温度,X2为提取液固比(取其倍数值用于回归),X3为提取时间.方程1为X1,X2,X3及其所有交叉作用项采用逐步回归分析所得;方程2为X1,X2,X3以进入方式回归所得.在模型汇总中,方程1调整R2=0.983,剩余标准差为0.214 17,P<0.01;方程2调整R2=0.992,剩余标准差为0.014 833,P<0.01.由调整R2值及剩余标准差可知两个方程均高度有效,方程2优于方程1,方程2的最大预测值为2.26%,综合两个方程显示的关系及前面单因素实验和均匀设计实验的结果,得出优化提取条件为提取温度100 ℃,提取液固比50∶1,提取时间80 min,提取1次。
3.3 优化提取工艺的验证
按上述工艺条件重复3次进行验证.结果纯多糖产率分别为2.20%,2.26%,2.29%,平均值为2.25%,与理论得率2.26%相比,误差仅为0.44%.
另外,在优化工艺条件下,提取3次,纯多糖得率分别为2.20%,2.36%,2.39%,平均值为2.32%,与前述提取1次平均值2.25%相比,仅提高3.11%,说明在此工艺条件下,提取1次已经比较完全,从成本计,没有必要再增加提取次数.
4 结论
以上实验得出茵陈多糖的优化提取条件为:提取温度为100 ℃,提取液固比为50∶1,提取时间为80 min, 提取次数为1次,纯多糖得率可达2.25%.
均匀设计在实验条件范围变化大而需要进行多水平实验的情况下,与正交设计相比可极大地减少实验次数,本实验结果的处理采用回归分析方法,建立了可定量描述指标和因素间关系的数学模型.验证实验的真实值与理论值十分接近,说明本实验采用均匀设计和回归分析方法得到的实验参数较为可靠,为茵陈多糖的进一步开发利用打下些许基础.
参 考 文 献:
[1] 曹锦花. 茵陈的化学成分和药理作用研究进展[J]. 沈阳药科大学学报, 2013,30(6):489-494.
CAO Jinhua. Advanced study on chemical constituents and pharmaceutical activities of Artemisiae Scopariae Herba[J]. JOURNAL OF SHENYANG PHARMACEUTICAL UNIVERSITY, 2013, 30(6): 489-494.
[2] 范丽梅,徐立堃,张兰,等. 茵陈中多糖组分的提取及分析[J].中国现代医生,2012,50(34):98-101.
FAN Limei, XU Likun, ZHANG Lan, et al. Extraction and analysis of polysaccharides moity in artemisiae capillaries[J]. CHINA MODERN DOCTOR, 2012, 50(34): 98-101.
[3] 陈晓清. 鱼腥草与茵陈多糖提取物的抗菌活性[J]. 微量元素与健康研究,2007,24(5):17-18.
CHEN Xiaoqing. Antimicrobial activities of the polysaccharide extracts from Houttuynia cordata Thunb and Artemisia caillaris Thunb[J]. Studies of Trace Elements and Health, 2007, 24(5): 17-18.
[4] 赫长胜,李源渊,岳洪义,等. 茵陈多糖对梗阻性黄疸幼鼠肝脏纤维化的保护作用研究[J]. 中国医药导报,2012,9(8):25-27.
HE Changsheng, LI Yuanyuan, YUE Hongyi, et al. Protective effects of Artemisia capillaries polysaccharides for hepatic fibrosis on immature rats with obstructive jaundice[J]. CHINA MEDICAL HERALD, 2012, 9(8): 25-27.
[5] 范丽梅,胡春玲,谢琼,等. 茵陈多糖对妊娠胆汁淤积大鼠Th1/Th2细胞免疫平衡的影响[J]. 中国热带医学,2013,13(3):267-269.
FAN Limei, HU Chunling, XIE Qiong, et al. Effect of artemisiae capillaries polysaccharides on immunologic balance of Th1/Th2 in rats with ICP[J]. China Tropical Medicine, 2013, 13(3): 267-269.
[6] 范丽梅,徐立堃,张兰,等. 茵陈多糖对妊娠胆汁淤积大鼠肝脏氧化损伤的保护作用研究[J]. 中国医药导报,2013,10(7):11-13.
FAN Limei, XU Likun, ZHANG Lan, et al. Protective effect of capillary Artemisia polysaccharide for liver oxidative damage rats with intrahepatic cholestasis of pregnancy[J]. CHINA MEDICAL HERALD, 2013, 10(7): 11-13.
[7] HE Changsheng, YUE Hongyi, XU Jian, et al. Protective effects of capillary artemisia polysaccharide on oxidative injury to the liver in rats with obstructive jaundice[J]. EXPERIMENTAL AND THERAPEUTIC MEDICINE 2012, 4(4): 645-648.
[8] FENG Guofang, WANG Xiaoqing, YOU Changxuan, et al. Antiproliferative potential of Artemisia capillaris polysaccharide against human nasopharyngeal carcinoma cells[J]. Carbohydrate Polymers, 2013, 92 (2): 1040-1045.
[9] LEE JH, PARK EK, UHM CS, et al. Inhibition of Helicobacter pylori adhesion to human gastric adenocarcinoma epithelial cells by acidic polysaccharides from Artemisia capillaris and Panax ginseng[J]. Planta medica,2004, 70(7): 615-619.

