核糖体蛋白L22对果蝇发育的影响及机制
李红艳
(西藏民族学院 医学院,陕西 咸阳 712082)
核糖体蛋白在核糖体组装和蛋白质合成中有重要作用.人类中一些核糖体蛋白的异常表达常引起一些疾病的发生,如Diamond-Blackfan贫血症[1]、特纳综合征[2]、听力丧失[3]和癌症[4].研究发现,果蝇中一些核糖体蛋白的突变可引起幼虫发育迟缓,刚毛短小、稀疏,生殖力和生活力低下,并隐性致死等特征,这些表型被称为Minute表型.目前对其解释为:某一核糖体蛋白基因突变后,引起细胞生长和增殖率减少[5-6];编码核糖体蛋白的基因发生突变,导致核糖体合成受损,引起蛋白合成速率减少[7].另外,一些核糖体蛋白在细胞周期、凋亡、DNA损伤修复等过程中也有着重要作用,但这些作用和该核糖体蛋白在核糖体组装和蛋白质合成中的作用无关.
L22是核糖体60 S大亚基的组成成分,除了自身参与核糖体组装和蛋白质合成外,并与其他多亚基核糖核蛋白颗粒一起发挥相应的生物学功能[8].另外,L22通过与病毒调节蛋白如ICP-4和ICP-22相互作用[9],调节病毒早期基因EAP的转录[10].L22诱导p53表达,选择性阻止αβT细胞发育[11].果蝇Kc细胞删除L22后,通过与组蛋白H1相互作用抑制基因的转录[12].但有关L22在果蝇发育中的作用及机制还不清楚.本研究证实,L22对于果蝇正常发育是不可缺少的,且主要是通过细胞凋亡和细胞周期阻滞的方式发挥作用的.
1 材料和方法
1.1 L22 RNAi转基因果蝇的获取和饲养
以果蝇L22 cDNA编码区为模板,进行PCR扩增(上游引物5-caagcggccgcggtgaacaacctgggcaa-3;下游引物5-ccggaattcgcatcgtcgtcctcatcgtc-3).将扩增产物通过Not I和EcoR酶切位点克隆到SympUAST-w载体中,称为L22-SympUAST-w.通过显微注射法将L22-SympUAST-w质粒注射到果蝇w1118胚胎中,经多步筛选最终获得L22RNAi转基因果蝇.为了驱动L22在果蝇中特异性干扰,实验中用到的其他商品化果蝇品系有Hsp70-Gal4,act5c-Gal4,ey-Gal4和 vg-Gal4.果蝇饲养在18 ℃/25 ℃玉米粉-蔗糖培养基上.
1.2 果蝇幼虫体长测量
L22RNAi雌蝇与Hsp70-Gal4雄蝇在25 ℃下杂交,间隔1 h产卵,1 h后将果蝇转移到新的培养基下使其再次产卵,依次循环.产卵24 h后,将幼虫在37 ℃热激30 min.之后每隔24 h随机收集1次幼虫,每组收集至少10只,至对照组发育到蛹期.使用MZ16体视显微镜对幼虫拍照.利用MetaMorph软件统计幼虫体长.
1.3 吖啶橙染色
在PBS缓冲液中解剖L22RNAi与vg-Gal4杂交后的三期幼虫翅膀discs.解剖好后立即放到4 ℃果蝇细胞培养基中,使其维持正常的生理环境.之后转移到载玻片上,并用100 μL的培养基洗1次.室温下,以1 μg/mL 吖啶橙(sigma)染色5 min后,即刻在荧光镜下收集数据.
1.4 果蝇S2细胞中干扰L22
PCR扩增果蝇L22编码序列(上游引物[含有1个T7启动子]:5-taatacgactcactatagggagaatggctcctaccgccaagacc-3;下游引物5-taatacgactcactatagggagattactcggcatcgtcgtcctc-3).PCR产物纯化后作为模板,再通过MEGAscrip T7 (Ambion)试剂盒生成单链RNA(ssRNAs).ssRNAs在65 ℃中退火,孵育30 min,自然降温至室温即生成双链RNA(dsRNAs).经乙醇沉淀,重悬在一定量的无RNA酶水中.再经凝胶电泳对其定量,-80 ℃保存备用.
S2细胞培养在Schneider 果蝇基本培养基(Gibco)中,补加终质量浓度为100 g/L的胎牛血清(Gibco),160 μg/mL 青霉素,250 μg/mL 链霉素和4 mmol/LL-谷氨酰胺(Sigma),25 ℃培养.依照之前的方法[12]在S2细胞中对L22 进行干扰.用无血清培养基将S2 细胞以1×106个/mL密度种植在35 cm 培养瓶中(Corning).室温,1 mL无血清培养基加终质量浓度为5 μg/mL L22 dsRNA抚育60 min.随后补加含有血清的正常培养基2 mL继续培养.同时以GFP dsRNA作为对照组,处理对照组细胞.在处理后的第4和第8天收集细胞,用作实验.
1.5 RT-PCR
根据试剂盒(Qiagen)要求提取收集到的细胞总RNA.并对提取的RNA进行DNase(TaKaRa)处理,以防止基因组DNA污染.以提取的RNA为模板,用M-MLV 反转录酶(Invitrogen)和oligo-dT 引物合成cDNA.PCR扩增条件(25 μL 反应体系):95 ℃预变性5 min;94 ℃, 30 s,60 ℃,30 s,72 ℃,45 s,30 个循环;72 ℃延伸8 min.同时实验中为了进一步排除基因组污染的干扰,一并检测了每一组RNA 样品在没有加反转录酶的情况下参照基因的表达.用到的引物见表1.

表1 RT-PCR引物
1.6 统计分析
所有实验重复在3次以上.数据使用Excel 软件进行统计分析.组间样本均数比较采用t检验,以P<0.05为有统计学意义.
2 结果
2.1 减少L22表达延迟果蝇幼虫发育
实验首先用act5c-Gal4驱动L22表达广泛减少,以初步了解L22在果蝇发育中的作用.结果果蝇死在胚胎期,而对照组发育正常.同时用Hsp70-Gal4驱动子诱导性驱动L22沉默(方法见材料部分).L22RNAi/Hsp70-Gal4从一期到三期幼虫均发育延迟,持续10~12 d,最后死在三期幼虫期;对照组发育正常,在幼虫期持续6~7 d,之后发育成蛹和成虫.在早48 h,L22RNAi/Hsp70-Gal4生长与对照组比没有明显变化,而72 h后,较对照组体长明显变小(图1 a,b).由此说明L22是果蝇早期发育所必须的.
2.2 减少L22表达引起果蝇眼和翅膀生长缺陷
实验进一步用特异性驱动L22在眼睛和翅膀中表达沉默的ey-Gal4和vg-Gal4驱动子.果蝇复眼由一定数目的单眼和特异性视网膜细胞精确排列组成.复眼已成为一个很好的研究细胞增殖和细胞存活的系统[13].统计了500只L22RNAi/ey-Gal4果蝇,其表型可分为3类:第1类(占17%)与正常对照组比没有显著差异.第2类(占6%)眼表型与对照组相比较小,可以从蛹中正常孵育出来(图2a).而第3类(占77%)死在蛹期,解剖发现这些果蝇身体其他部位发育完整,只是缺少头部结构.所有L22RNAi/vg-Gal4果蝇的翅膀变小而且多褶皱(图2c).这些异常表型暗示:L22干扰后引起眼和翅膀discs发育不完全,可能是由细胞增殖阻滞或细胞死亡引起的.
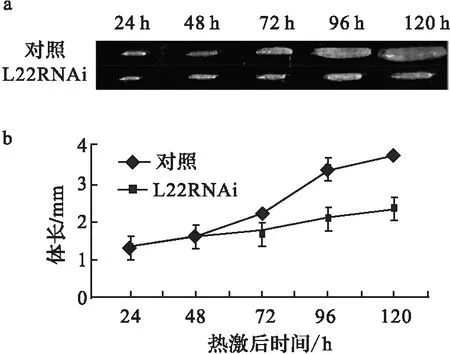
a.热激后L22RNAi/Hsp70-Gal4 幼虫和对照组幼虫长度比较;b.前48 h,L22RNAi/Hsp70-Gal4幼虫和对照组体长相差不显著; 72 h 后,L22RNAi/Hsp70-Gal4 幼虫生长显著慢于对照组(P<0.05).图1 减少L22表达阻滞果蝇幼虫发育Fig.1 Decreased expression of L22 caused the Drosophila larvae growth arrest
2.3 减少L22表达降低S2细胞数目和果蝇翅膀disc中出现细胞凋亡
已知细胞数目反应了细胞增长和细胞凋亡之间的关系[14].所以在果蝇S2细胞中干扰L22表达,以GFP作为对照,统计细胞数.结果发现,在L22干扰后S2细胞数目减少(图3a).且这种变化随着时间的延长越来越明显.这一结果与异常的眼和翅膀表型吻合.表明L22RNAi后影响了果蝇的发育,且可能是通过细胞凋亡的方式完成的.同时吖啶橙(细胞凋亡荧光染料)染色实验证实,在L22RNAi/vg-Gal4三期幼虫的翅膀discs中确实有明显的细胞凋亡信号出现(图2d).
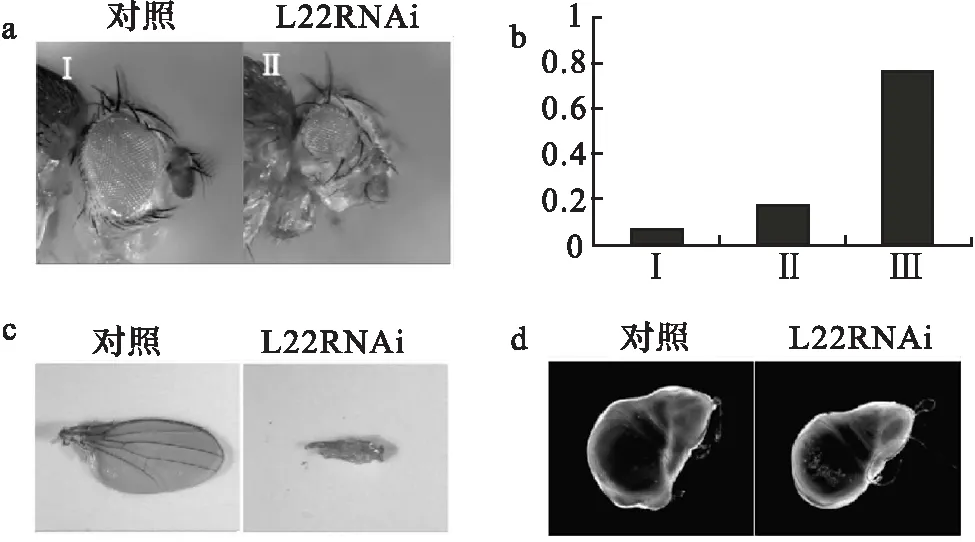
a.与野生型相比,6%L22RNAi/ey-Gal4 眼睛变小,77%无头;b.在统计的500只果蝇中L22RNAi/ey-Gal4各种表型所占的比例;c.L22RNAi/vg-Gal4后代翅膀缺陷;d.吖啶橙染色显示,L22RNAi/vg-Gal4 三期幼虫的翅膀 disc 细胞出现凋亡现象.图2 减少L22表达造成果蝇眼睛和翅膀缺陷Fig.2 Eye and wing defects in L22-depleted flies
2.4 L22删除后细胞凋亡/细胞周期相关基因表达异常
以上结果表明,L22干扰后引起了细胞凋亡,而凋亡与细胞周期紧密相关.因此通过RT-PCR检测了与细胞凋亡相关基因(hid,reaper,dcp-1和p53)和细胞周期相关基因(MCM5,cdc45,incenp和cyclinB)在S2细胞中L22干扰后的变化情况.结果发现,删除L22,引起hid,reaper,dcp-1和p53基因表达水平升高(图3b),而这种变化与他们各自在细胞凋亡中的作用是一致的.已知p53是一肿瘤抑制蛋白,在各种应激条件下均可以开启凋亡的发生[2],通常是通过刺激细胞色素C释放来激活caspase活性引起的[15].Dcp-1是果蝇caspase家族的一个成员,也在细胞凋亡过程中有着重要作用[16].Reaper和hid是果蝇中另外2个与细胞凋亡相关的基因[17-18],它们可以直接或间接通过激活p53来参与凋亡[19],另外发现它们在发挥细胞凋亡过程中也激活了caspase通路[2-21].
另外,L22RNAi后G1-S期的MCM5与cdc45 和G2-M期的incenp与cyclinB表达水平分别减少(图3c).MCM5是p53的一个转录抑制target,在G1-S期中有着重要作用[22].细胞分裂周期蛋白45 (cdc45)对于细胞周期起始以及DNA复制延伸都有着重要作用[23].研究发现,Cdc45与MCM5/cdc46,MCM7/cdc47和ORC[24]相互作用.Cyclin B 有控制细胞进入有丝分裂期的作用,减少cyclin B表达导致G2期阻滞,而且该过程受到p53依赖的转录抑制调控[25].Incenp在细胞分裂过程中有重要作用.研究发现Incenp与Aurora B 和survivin 形成Aurora B/incenp/survivin复合体,在染色体正常分离过程中发挥作用[26-28].在黑色素细胞中,p53可以通过直接与survivin启动子结合或者激活p21来抑制survivin表达[29].因此,Incenp与p53之间可能有一种负相关.
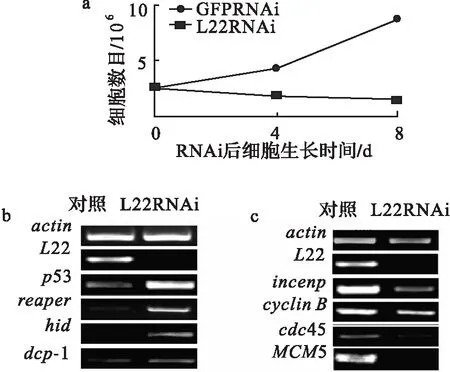
a.L22 RNAi后S2细胞生长受到抑制,而GFPRNAi对照组细胞生长正常;b.L22RNAi导致p53,hid,dcp-1和reaper的转录水平上升; c.actin转录正常,而MCM5,cdc45,cyclin B和incenp转录水平均下降.图3 S2细胞中减少L22表达引起细胞凋亡和细胞周期相关基因表达异常Fig.3 Abnormal expression of the genes related to apoptosis and cell cycle in L22-depleted S2 cells
综上所述,L22对于果蝇正常发育是不可缺少的,L22RNAi后主要是通过细胞凋亡的方式来影响果蝇发育的.
致谢:感谢清华大学孙方霖教授给予的实验指导和经费支持;感谢清华大学陈苏同学在实验过程中所给的帮助.
参 考 文 献:
[1] DRAPTCHINSKAIA N, GUSTAVSSON P, ANDERSSON B, et al.The gene encoding ribosomal protein S19 is mutated in Diamond-Blackfan anaemia[J].Nat Genet, 1999, 21: 169-175.
[2] FISHER E M, BEER-ROMERO P, BROWN L G, et al.Homologous ribosomal protein genes on the human X and Y chromosomes: escape from X inactivation and possible implications forTurnersyndrome[J].Cell, 1990, 63: 1205-1218.
[3] O’BRIEN T W, O’BRIEN B J, NORMAN R A.Nuclear MRP genes and mitochondrial disease[J].Gene, 2005, 354: 147-151.
[4] RUGGERO D, PANDOLFI P P.Does the ribosome translate cancer[J].Nat Rev Cancer,2003, 3: 179-192.
[5] SCHULTZ J.The minute reaction in the development ofDrosophilamelanogaster[J].Genetics, 1929, 14: 366-419.
[6] LAMBERTSSON A.The minute genes inDrosophilaand their molecular functions[J].Adv Genet, 1998, 38: 69-134.
[7] ENERLY E, LARSSON J, LAMBERTSSON A.Silencing theDrosophilaribosomal protein L14 gene using targeted RNA interference causes distinct somatic anomalies[J].Gene, 2003, 320: 41-48.
[8] WOOD J, FREDERICKSON R M, FIELDS S, et al.Hepatitis C virus 3’X region interacts with human ribosomal proteins[J].J Virol, 2001, 75: 1348-1358.
[9] NG T I, CHANG Y E, ROIZMAN B.Infected cell protein 22 of herpes simplex virus 1 regulates the expression of virion host shutoff gene U(L)41[J].Virology, 1997, 234: 226-234.
[10] DOBBELSTEIN M, SHENK T.In vitro selection of RNA ligands for the ribosomal L22 protein associated with Epstein-Barr virus-expressed RNA by using randomized and cDNA-derived RNA libraries[J].J Virol, 1995, 69: 8027-8034.
[11] ANDERSON S J, LAURITSEN J P, HARTMAN M G, et al.Ablation of ribosomal protein L22 selectively impairs alphabeta T cell development by activation of a p53-dependent checkpoint[J].Immunity, 2007, 26: 759-772.
[12] NI J Q, LIU L P, HESS D, et al.Drosophilaribosomal proteins are associated with linker histone H1 and suppress gene transcription[J].Genes Dev, 2006, 20: 1959-1973.
[13] SHI W, STAMPAS A, ZAPATA C, et al.The pineapple eye gene is required for survival ofDrosophilaimaginal disc cells[J].Genetics, 2003, 165: 1869-1879.
[14] KASTAN M B, CANMAN C E, LEONARD C J.Leonard.P53, cell cycle control and apoptosis: implications for cancer[J].Cancer Metastasis Rev, 1995, 14: 3-15.
[15] SCHULER M, BOSSY-WETZEL J C, GOLDSTEIN J C, et al.P53 induces apoptosis by caspase activation through mitochondrial cytochrome c release[J].J Biol Chem, 2000, 275: 7337-7342.
[16] SONG Z, MCCALL K, STELLER H.DCP-1, aDrosophilacell death protease essential for development[J].Science, 1997, 275: 536-540.
[17] GRETHER M E, ABRAMS J M, AGAPITE J, et al.The head involution defective gene ofDrosophilamelanogasterfunctions in programmed cell death[J].Genes Dev, 1995, 9: 1694-1708.
[18] WHITE K, GRETHER M E, ABRAMS J M, et al.Genetic control of programmed cell death inDrosophila[J].Science, 1994, 264: 677-683.
[19] BRODSKY M H, WEINERT B T, TSANG G, et al.DrosophilamelanogasterMNK/Chk2 and p53 regulate multiple DNA repair and apoptotic pathways following DNA damage[J].Mol Cell Biol, 2004, 24: 1219-1231.
[20] WHITE K, TAHAOGLU E, STELLER H.Cell killing by theDrosophilagene reaper[J].Science, 1996, 271: 805-807.
[21] ZHOU L, SCHNITZLER A, AGAPITE J, et al.Cooperative functions of the reaper and head involution defective genes in the programmed cell death ofDrosophilacentral nervous system midline cells[J].Proc Natl Acad Sci, 1997, 94: 5131-5136.
[22] AGARWAL M K, RUHUL AMIN A R, AGARWA L M L.DNA replication licensing factor minichromosome maintenance deficient 5 rescues p53-mediated growth arrest[J].Cancer Res, 2007, 67: 116-121.
[23] POLLOK S, GROSSE F.Cdc45 degradation during differentiation and apoptosis[J].Biochem Biophys Res Commun, 2007, 362: 910-915.
[24] HARDY C F.Identification of Cdc45p, an essential factor required for DNA replication[J].Gene, 1997, 187: 239-246.
[25] KRAUSE K, WASNER M, REINHARD W, et al.The tumour suppressor protein p53 can repress transcription of cyclin B[J].Nucleic Acids Res, 2000, 28: 4410-4418.
[26] SUGIHARA Y, HONDA H, IIDA T, et al.Proteomic analysis of rodent ribosomes revealed heterogeneity including ribosomal proteins L10-like, L22-like 1, and L39-like[J].J Proteome Res, 2010, 9: 1351-1366.
[27] CHEESEMAN I M, ANDERSON S, JWA M, et al.Phospho-regulation of kinetochore-microtubule attachments by the Aurora kinase Ipl1p[J].Cell, 2002, 111: 163-172.
[28] BOLTON M A, LAN W, POWERS S E, et al.Aurora B kinase exists in a complex with survivin and INCENP and its kinase activity is stimulated by survivin binding and phosphorylation[J].Mol Biol Cell, 2002, 13: 3064-3077.
[29] RAJ D, LIU T, SAMADASHWILY G, et al.Survivin repression by p53, Rb and E2F2 in normal human melanocytes[J].Carcinogenesis, 2008, 29: 194-201.

