生物素化胆甾醇基普鲁兰糖合成及其自聚集性质
杨文智,王苗苗,李海鹰,马丽兰,李霞霞
(河北大学 药学院,河北 保定 071002)
高分子材料用作药物的纳米载体,可增大药物溶解度,改善药物生物利用度,达到缓释或靶向作用,为肿瘤治疗提供了一种新方法.近年来,文献报道采用新型高分子材料制备载药微球、脂质体或纳米粒,作为药物的新型传递系统[1-3].
普鲁兰糖是中性直链多糖,具有易溶、安全、无毒、生物相容与降解性好和多羟基易化学修饰等优点,备受研究者关注[4].接枝改性普鲁兰糖是其研究的热点之一,文献报道用聚酯[5]、酰基[6]或聚乙二醇[7]等对多糖链进行接枝改性,制备两亲性普鲁兰糖高分子材料,得到材料可在水中自聚集成纳米粒,用于负载药物和多肽,实现药物的可控和靶向释放.胆甾醇基普鲁兰糖(CHSP)是一种新型两亲性材料,其自聚集纳米粒可负载抗肿瘤药物或作为蛋白药物分子伴侣,实现药物的体外缓释及被动靶向作用[8-11].但其与组织或细胞缺少特异性结合,难以实现主动靶向.肿瘤组织生长需大量生物素,相比正常细胞,肿瘤细胞表面有大量生物素受体,导致其更易识别结合生物素.生物素化学键合纳米载体可主动靶向传递抗瘤药物[12].文献报道,生物素化纳米颗粒与乳腺或宫颈肿瘤细胞共孵育,肿瘤细胞摄取纳米粒量优于未接生物素的纳米粒[13].
基于以上原因,本文设计将生物素键合到CHSP材料上,获得适宜取代度的生物素化胆甾醇基普鲁兰(Bio-CHSP)两亲性材料,希望获得其自聚集纳米粒,为下一步负载抗肿瘤药物,实现生物素介导载药纳米粒的主动靶向作用提供实验支持.
1 实验材料
核磁共振仪(瑞士布鲁克公司,型号:Bruker AVANCE Ⅲ 600);X线粉末衍射仪(德国布鲁克公司,型号:D8 Advance);荧光分光光度计(上海精密科学仪器有限公司, 型号:970CRT);动态激光粒度分析仪(美国贝克曼库尔特公司,型号:Delsa Nano zeta);气浴恒温振荡器(金坛市医疗仪器厂,型号:THZ-82);透射电镜(日本电子株式会社, 型号:JEM-100C);LCD探头超声仪(宁波新芝生物科技股份有限公司,型号:SCIENTZ JY 92-Ⅱ).
胆甾醇基普鲁兰糖(CHSP)参考文献[14]合成,胆甾醇的取代度为5.4%;生物素(国药集团化学试剂有限公司,上海);1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐/EDC· HCL(Sigma Co. USA);4-二甲氨基吡啶(DMAP, Sigma Co. USA);芘(Aldrich Co. USA);透析袋(截留相对分子质量为8~14 ku,美国);其余试剂均为分析纯.
2 实验方法
2.1 生物素化胆甾醇基普鲁兰糖(Bio-CHSP)材料的合成
2.1.1 材料合成方法
取胆甾醇基普鲁兰糖(CHSP)0.5 g和适量生物素溶于4 mL 二甲基亚砜(DMSO)中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC· HCL)(n(EDC)/n(生物素)=1.2),4-二甲氨基吡啶(DMAP)((n(DMAP) /n(生物素)=0.1),45 ℃反应5 d.反应结束,反应液滴入体积分数95%乙醇中,抽滤,滤饼分别用二氯甲烷、稀碱液和无水乙醇洗涤,干燥,即得生物素化胆甾醇基普鲁兰糖,备用.材料的合成路线见图1.
2.1.2 X线粉末衍射分析
生物素、CHSP、Bio-CHSP和生物素与CHSP的物理混合的干燥样品在2θ为5~80°内扫描样品的X线粉末衍射图谱.
2.1.3 氢核磁测定与材料生物素取代度确定
生物素、CHSP和Bio-CHSP样品溶于DMSO-d6,置于AVANCE Ⅲ 600 MHz核磁共振仪中,测定样品的氢核磁图谱.采用1HNMR法测定生物素的取代度,计算每100个葡萄糖残基上偶联生物素个数.
2.2 Bio-CHSP 纳米粒的制备及表征
透析法制备Bio-CHSP自组装纳米粒[7].称取不同取代度的Bio-CHSP材料适量溶于DMSO中,转移到截留相对分子质量8~14 ku的透析袋中,置于1 000 mL蒸馏水中透析9 h,透析完毕,定容,100 W探头超声2 min,即得自组装纳米粒,备用.将制得的自组装纳米粒溶液制样,采用透射电镜(TEM)观察形态;利用动态激光粒度分析仪(DLS)测其粒径分布及Zeta电势.
2.3 临界聚集浓度(CAC)的测定
取 10 mL容量瓶,加入适当浓度的芘-甲醇溶液,氮气吹干,分别加入精密配制的不同浓度的Bio-CHSP 纳米溶液,使芘最终浓度为6×10-7mol/L,37 ℃恒温振荡1 h.荧光测定样品,激发波长334 nm,发射光谱扫描300~500 nm,激发与发射狭缝宽度分别为5 nm和2 nm,记录372 nm和383 nm处的荧光吸收强度(I),以I372/I383对浓度ρ(mg/mL)的logρ作图,计算CAC.
3 结果与讨论
3.1 Bio-CHSP的合成与表征
Bio-CHSP衍生物的合成路线见图1,EDC·HCl作为脱水剂和偶合剂,DMAP作为催化剂,通过酯化反应将生物素连接于胆甾醇基普鲁兰多糖上,获得Bio-CHSP.
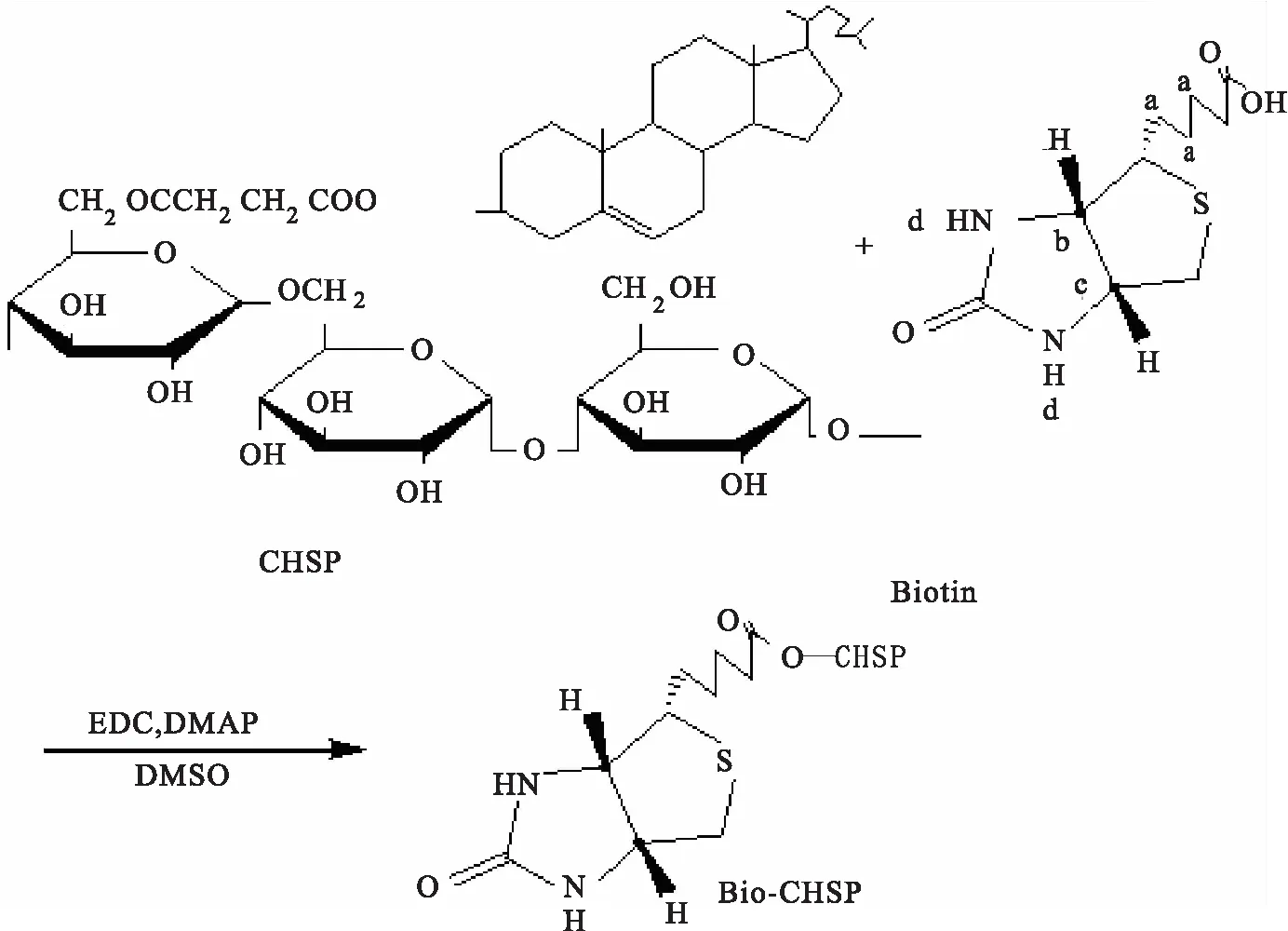
图1 Bio-CHSP合成路线Fig.1 Synthesis route of Bio-CHSP
图2为生物素、CHSP和Bio-CHSP 的1HNMR谱.文献报道CHSP氢核磁数据[14]:0.40~1.20(胆甾醇骨架氢),2.49(DMSO-d6),2.53(琥珀酰2个亚甲基峰,—OCH2CH2O—),2.60~4.60(糖环上C2,C3,C4,C5,C6氢峰),4.60(C1,1H,α-1,6),5.05(C1,1H,α-1,4),4.60~5.40(羟基吸收峰,—OH). Bio-CHSP氢谱中除CHSP 的特征峰外,出现生物素特征峰,如:1.20~1.80(a, 6H, —(CH2)3—, m),4.17(b, 1H, dd), 4.32(c, 1H, m) 和6.45(d, 2H, =N—H, brs);由于生物素化学键合到CHSP糖链上,6.45脲(—NH—CO—NH—)吸收峰为宽单峰,明显有别于单独的生物素氢核磁峰.同时,Bio-CHSP氢谱上未见12.0处羧基峰(—COOH)[15];这些氢核磁数据表明,生物素成功接枝到胆甾醇基普鲁兰多糖链上.
普鲁兰多糖由单糖通过α-1,4和α-1,6糖苷键连接而成. Bio-CHSP 氢谱的4.17(b, 1H, dd)和4.32(c, 1H, m)的“=CH—”核磁峰明显且无干扰,故CHSP多糖链接枝生物素取代度可按如下公式(1)计算,A代表在某化学位移处峰面积,不同投料比合成Bio-CHSP材料的生物素取代度(DS)见表1.
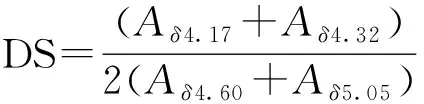
×100. (1)
a生物素与CHSP投料物质的量比;bDLS测定Bio-CHSP纳米粒粒径(Dh)及粒径分布(PDI);c荧光法测定不同取代度Bio-CHSP材料水中的临界聚集浓度;dDLS测得水中自聚集Bio-CHSP 纳米粒的(ζ)电势.
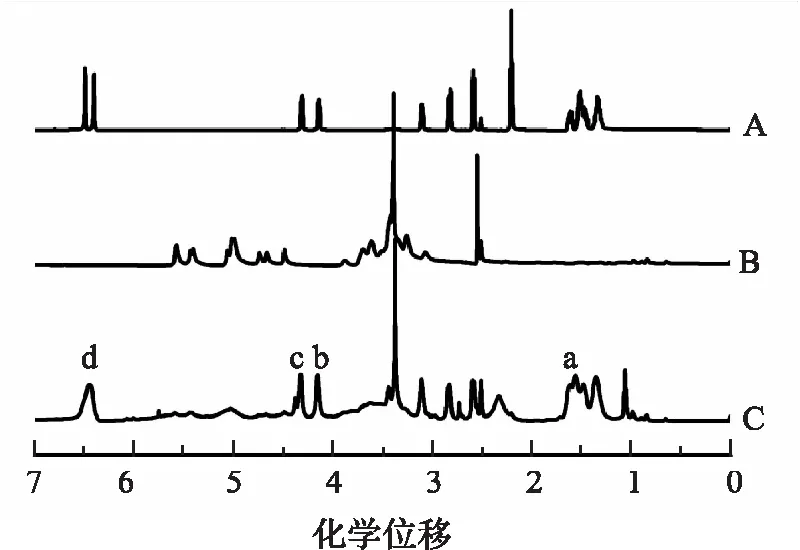
A.生物素;B.CHSP;C.Bio-CHSP.图2 氢核磁共振图谱Fig.2 1HNMR spectra
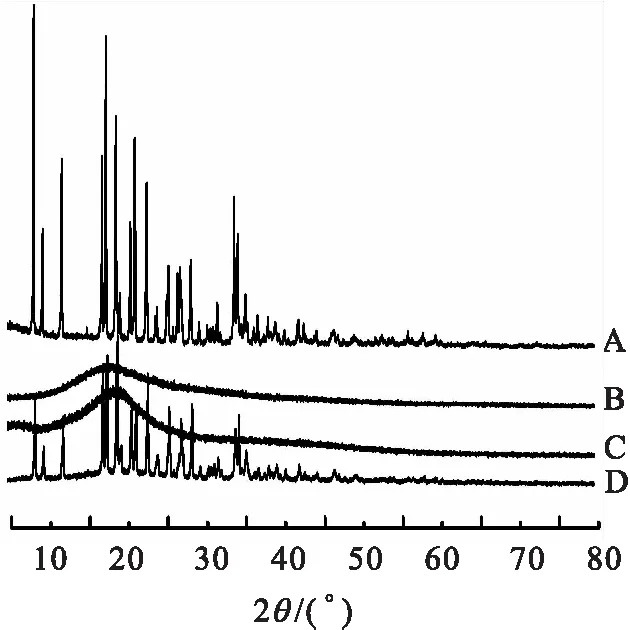
A.生物素;B.CHSP;C.Bio-CHSP;D.a与b物理混合(质量比1∶10).图3 X衍射谱Fig.3 Xray diffraction patterns
生物素、CHSP、Bio-CHSP和生物素与CHSP混合样品的X粉末衍射图谱,见图3.生物素在2θ为8.4,12.1,17.7,18.8,21.3,22.5,28.5,34.1°处显示出尖锐特征峰,表明其为小分子结晶态.CHSP与Bio-CHSP材料均为非晶态,CHSP 在2θ为17.9°处具有宽衍射峰,而Bio-CHSP 宽衍射峰出现在18.7°处;生物素与CHSP物理混合样品的图谱中存在明显尖锐的生物素特征峰.由上可知,生物素化学键合到CHSP多糖链上[16].
1HNMR 与X线粉末衍射数据分析,证明生物素化胆甾醇基普鲁兰糖的合成.
3.2 透射电镜及粒径分析
具有适宜生物素取代度的Bio-CHSP可在水中自聚集形成纳米凝胶,纳米粒子呈圆形或椭圆形,结果见图4.图 4a是Bio-CHSP-2自组装纳米粒的透射电镜图.从图中可以看出纳米粒成球形,粒径约为150 nm,分散比较均匀.不同生物素取代度的Bio-CHSP自聚集纳米粒子的粒径和Zeta电位见表1.Bio-CHSP自组装纳米粒在水中自聚集粒径为100~180 nm.自聚集纳米粒的粒径与生物素取代度有关,取代度增大,粒径变小,即疏水性强,利于Bio-CHSP自聚集纳米粒形成更紧密的疏水核心,导致纳米粒粒径减小.DLS测得的自聚集纳米粒粒径较 TEM 观察的粒径大,粒径分布见图4b.透射电镜测定的是自聚集纳米粒干态粒径,DLS测定自聚集纳米粒水合粒径,故同一样品DLS测定粒径偏大.Bio-CHSP自聚集纳米粒Zeta 电位呈现负值.
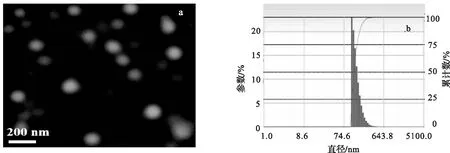
a.透射电镜照片;b.DLS粒径分布.图4 Bio-CHSP纳米粒Fig.4 Bio-CHSP-2NPs
3.3 临界聚集浓度(CAC)的测定
在溶液体系中,芘分子自发地由极性环境向非极性环境转移,当溶液体系的极性发生变化,即非极性环境变强,可使荧光检测信号显著增强.实验选择芘作为荧光探针,水溶液芘浓度低于10-5mol/L,其在372,379,383,390,397 nm处出现激发态荧光的5重发射峰,第1与第3发射峰强度比(I372/I383)常用作芘“极性标尺”,反映芘所处环境的极性状况.一般通过I372/I383的比值大小来推测溶液中胶束浓度的变化.利用此原理,可评价水中高分子胶束的疏水结构域的生成状况.亲水普鲁兰糖长链化学键合疏水胆甾醇及生物素基团,当疏水基适宜取代,材料则显双亲性质.故本实验采用芘为荧光探针,应用稳态荧光探针法,评价Bio-CHSP材料两亲性强弱,并测定其自聚集水凝胶纳米粒的临界聚集浓度(CAC)[17].见图5,将不同浓度的Bio-CHSP 胶束溶液下测定的I372/I383与logρ作图,对曲线两端线性拟合,其交点浓度即为Bio-CHSP自聚集纳米粒的CAC值,结果见表1.接枝糖链的生物素增多,疏水作用力增强,Bio-CHSP易发生自聚集,表现为CAC值减小[18].
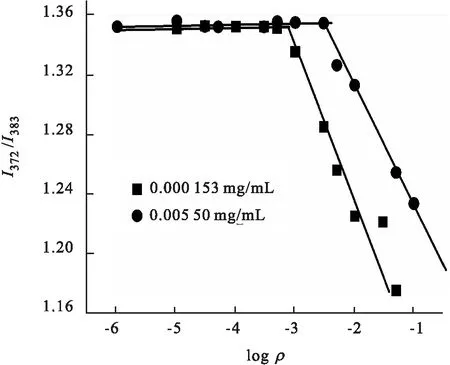
■ Bio-CHSP-1; ●Bio-CHSP-2.图5 Bio-CHSP 芘荧光发射光谱I372/I383与logρ之间的关系Fig.5 Intensity ratio (I372/I383) from excitation spectra of pyrene (6.0×10-7mol/L) with various concentrations of Bio-CHSP
4 结论
成功合成并表征了不同生物素取代的胆甾醇基普鲁兰糖衍生物,合成材料具备两亲性,可在水中自聚集成球形纳米粒,获得的Bio-CHSP材料纳米粒用作抗瘤药物载体及其生物学效应评价正在实验中.
参 考 文 献:
[1] JENOG Y I,NA H S,OH J S,et al.Adriamycin release from self-assembling nanospheres of poly(dl-lactide-co-glycolide)-grafted pullulan[J].International Journal of Pharmaceutics,2006,322(1-2):154-160.
[2] FUNDUEANU G,CONSTANTIN M,ASCENZI P.Preparation and characterization of pH-and temperature-sensitive pullulan microspheres for controlled release of drugs[J].Biomaterials,2008,29(18):2767-2775.
[3] SIVAKUMAR P A,PANDURANGA R K.The use of cholesteryl pullulan for the preparation of stable vincristine liposomes[J].Carbohydrate Polymers,2003,51(3):327-332.
[4] LEATHERS T D.Biotechnological production and applications of pullulan[J].Appl Microbiol Biotechnol,2003,62(5-6):468-473.
[5] FISCHER S,UETZ-VON ALLMEN E,WAECKERLE-MEN Y,et al.The preservation of phenotype and functionality of dendritic cells upon phagocytosis of polyelectrolyte-coated PLGA microparticles[J].Biomaterials,2007,28(6):994-1004.
[6] ZHANG Huizhu,GAO Fuping,LIU Lirong,et al.Pullulan acetate nanoparticles prepared by solvent diffusion method for epirubicin chemotherapy[J].Colloids and Surfaces B: Biointerfaces,2009,71(1):19-26.
[7] JUNG S W,JEONG Y I, KIM Y H,et al.Self-assembled polymeric nanoparticles of poly(ethylene glycol) grafted pullulan acetate as a novel drug carrier[J].Arch Pharm Res,2004,27(5):562-569.
[8] HIRAKURA T,YASUGI K,AKIYOSHI K,et al.Hybrid hyaluronan hydrogel encapsulating nanogel as a protein nanocarrier: New system for sustained delivery of protein with a chaperone-like function[J].Journal of Controlled Release,2010,142(3):483-489.
[9] SUNAMOTO J,USHIO K, LAI DT.Folate-modified cholesterol-bearing pullulan, a new cancer-targeted nanoparticle drug carrier: synthesis and applications[J].J Bioact Compat Polym,2006,21(6):603-617.
[10] TAO Xiaojun,ZHANG Qiufang,LING Kai,et al.Effect of pullulan nanoparticle surface charges on HSA complexation and drug release behavior of HSA-bound nanoparticles[J].PLOS ONE,2012,7(11):e49304.
[11] TAO Xiaojun,ZHANG Qiufang,YANG Wenzhi,et al.The interaction between human serum albumin and cholesterol-modified pullulan nanoparticle[J].Current Nanoscience,2012,8(6):830-837.
[12] NA K,LEE T,PARK K H,et al.Self-assembled nanoparticles of hydrophobically-modified polysaccharide bearing vitamin H as a targeted anti-cancer drug delivery system[J].European Journal of Pharmaceutical Sciences,2003,18(2):165-173.
[13] KIM S Y,CHO S H,LEE Y M,et al.Biotin-conjugated block copolymeric nanoparticles as tumor-targeted drug delivery systems[J].Macromolecular Research,2007,15(7):646-655.
[14] YANG Wenzhi,CHEN Hongli,GAO Fuping,et al.Self-aggregated nanoparticles of cholesterol-modified pullulan conjugate as a novel carrier of mitoxantronep[J].Current Nanoscience,2010,6(3):298-306.
[15] TONG Dajun,YAO Jia,LI Haoran,et al.Synthesis and characterization of thermo- and pH-sensitive block copolymers bearing a biotin group at the poly(ethylene oxide) chain end[J].Journal of Applied Polymer Science,2006,102:3552-3558.
[16] JUNG S W,JENOG Y I, KIM S H.Characterization of hydrophobized pullulan with various hydrophobicities[J].International Journal of Pharmaceutics,2003,254(2):109-121.
[17] CHEN Mingmao,LIU Ran,YANG Wenzhi,et al.Preparation and characterization of self-assembled nanoparticles of 6-O-cholesterol-modified chitosan for drug delivery[J].Carbohydrate Polymers,2011,84(4):1244-1251.
[18] NA K,PARK K M,JO E,et al.Self-organized pullulan/deoxycholic acid nanogels: Physicochemical characterization and anti-cancer drug-releasing behavior[J].Biotechnol Bioprocess Eng,2006,11(3):262-267.

