WHBE兔、日本大耳白兔和新西兰兔遗传多样性的RAPD分析
蔡月琴,陈民利,潘永明,朱亮,徐剑钦,屠珏,王德军,徐孝平
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
大耳白黑眼兔特征为全身纯白色的毛被、黑眼,又称为白毛黑眼兔(white hair black eyes rabbit,简称WHBE兔),该兔是本研究组在实验用日本大耳白兔(JW兔)生产群中发现了一只雄性WHBE兔后,通过回交—近交方式(包括同胞和半同胞之间的交配)进行保存的一个新实验兔封闭群,已连续封闭繁殖7代,生产种群达400多对,经鉴定命名为日本大耳兔黑眼系,现主要用于抗体的制备。本研究组对WHBE兔血液学研究发现,WHBE兔的网织红细胞、白细胞显著低于JW兔,而淋巴细胞和血红蛋白含量均显著高于JW兔[1];遗传学分析发现WHBE兔群体的基因纯合度高于JW兔,具有更优的遗传稳定性[2-4]。在WHBE兔与JW兔遗传育种中,发现第一代中未出现WHBE兔,在进行回交或第二代中均出现了WHBE兔,WHBE兔自交后代未出现分化,这在毛色基因遗传学研究中是一种新发现,由于WHBE兔遗传性状稳定,表型易于鉴别,遗传容易控制,为实验动物遗传质量标准化研究的极为理想的实验动物。
RAPD技术自创立以来,由于其灵敏、方便、多态性高等优点,被广泛用于多种动植物的系统进化、种质鉴定、群体遗传变异分析、目标性状基因的分子标记以及遗传图谱的快速构建等领域[5-8]。本文利用RAPD分子标记技术对3个品系兔群体遗传多样性进行研究,检测实验兔不同品系之间以及同一品系不同个体之间的亲缘关系及其遗传多样性。
1 材料与方法
1.1 材料
1.1.1 样品采集
WHBE兔30只,JW兔30只,NZW兔30只,雌雄各半,由浙江中医药大学实验兔生产基地[SCXK(浙)2009-0042]提供。采集耳廓皮肤样品,-20℃保存。
1.1.2 主要仪器和试剂
S1000 PCR扩增仪(Bio-Rad);EPS 601水平电泳仪(GE);Bioimaging Systems凝胶成像系统(UVP);台式冷冻离心机(Thermo);UHQ无离子纯水仪(Millipore),Varioskan flash多功能酶标仪( Thermo)。
PCR引物由上海生工生物工程公司合成,PCR反应试剂包括dNTP mixture,Taq DNA聚合酶(5 U/μL),10× PCR buffer,Mgcl2(25 mmol/L), DL2000 DNA marker购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 样品基因组DNA的提取
分别取90只兔的耳廓皮肤组织100 mg 剪碎,加入500 μL 消化缓冲液,混匀后加入终浓度为100 μg/mL 的蛋白酶K,55℃消化过夜。经苯酚∶氯仿∶异戊醇(25∶24∶1)抽提,无水乙醇沉淀基因组DNA,70%无水乙醇洗涤一遍,烘干,加入200 μL TE缓冲液溶解的DNA,经多功能酶标仪检测DNA纯度和DNA含量,将DNA浓度稀释至50 μg/mL,-20℃冻存备用。
1.2.2 RAPD-PCR
根据文献[9-12],选择了60个RAPD-PCR引物用于本实验。
20 μL PCR反应体系:1× PCR buffer,2.5 mmol/L MgCl2,0.25 mmol/L dNTP,20 pmol随机引物,1.25 U Taq酶,300 ng DNA模板,加ddH2O至20 μL。
PCR程序:预变性94℃ 7 min,然后94℃ 1 min,36℃退火 1 min,72℃延伸 2 min,共40个循环,72℃延伸10mins,4℃保存。
1.2.3 PCR产物的琼脂糖水平电泳鉴定
(1) 电泳缓冲液的制备:配制50× TAE缓冲液,取60 mL加蒸馏水至3000 mL,配置成1.0× TAE稀释缓冲液,待用。
(2) 水平电泳胶制备:称取0.45 g琼脂糖,置于锥形瓶中,加入30 mL 1.0× TAE缓冲液,放入微波炉加热至琼脂糖全部熔化,取出,加入2.5 μL Gelred染液,摇匀。
(3) 胶板制备:将胶槽置于水平面上,插上梳子,小心倒入已制备好的电泳胶,形成均匀的胶层。待胶完全凝固后拔出梳子,然后向槽内加入1.0× TAE缓冲液至液面没过胶板上表面。
(4) 加样电泳:取PCR产物5 μL,加入1 μL 6× loading buffer,并用移液枪小心将样品点入电泳槽内,最后在第一孔加入2.5 μL DL2000 DNA marker。合上电泳槽盖,接通电源,电压在60 V,电流40 mA,时间90 min。
(5) 拍照观察:凝胶用UVP凝胶成像系统拍照,保存。
1.2.4 数据统计和处理
记录下电泳后凝胶上清晰可见的扩增条带,每一个体的扩增条带以”1”或”0”记录,出现扩增条带的记为”1”,相应位点无扩增条带的记为”0”,将此结果输入Popgene 3.2软件中,统计相应结果:
(1) 多态位点比:在某一特定位点上,若扩增片段出现的频率小于0.99,则此位点称为多态位点。多态位点比率P =(多态位点数/检测到的位点总数)× 100
(2) 遗传相似系数和遗传距离:按Nei[13]的方法计算群体间的遗传相似系数S:S = 2Nij/(Ni + Nj),其中Nij 为两群体共有的位点数,Ni 和Nj分别表示两群体各自的位点数。遗传距离:D = 1- S。
(3) Shannon多样性指数:Shannon多样性指数是生态学中用于度量物种多样性的最常用方法,Chalmers将其改进后用于量化分析RAPD数据的遗传多样性。其计算公式:
H = -Σ PilnPi/N,
其中H为多样性指数;Pi为表型频率,即第i个位点在群体中出现的频率,N为检测到的总位点数。以上数据均利用Popgene 3.2软件进行计算。
2 结果
2.1 PCR扩增结果
从60个引物 (p1~p60,上海生工生物工程公司)中筛选出25个扩增重复性好、多态性较高的引物对3个实验兔品系进行RAPD扩增。表1列出了这25个随机引物的序列及其在3个实验兔品系中的扩增结果,共检测到493个扩增片段,长度在100 ~1800 bp之间。结果显示WHBE兔的扩增条带数最多(182),其次是JW兔(164),条带最少的是NZW兔(147);JW兔与NZW兔的共有条带数最多,WHBE兔与JW兔的共有条带数比WHBE兔与NZW兔的共有条带数多。
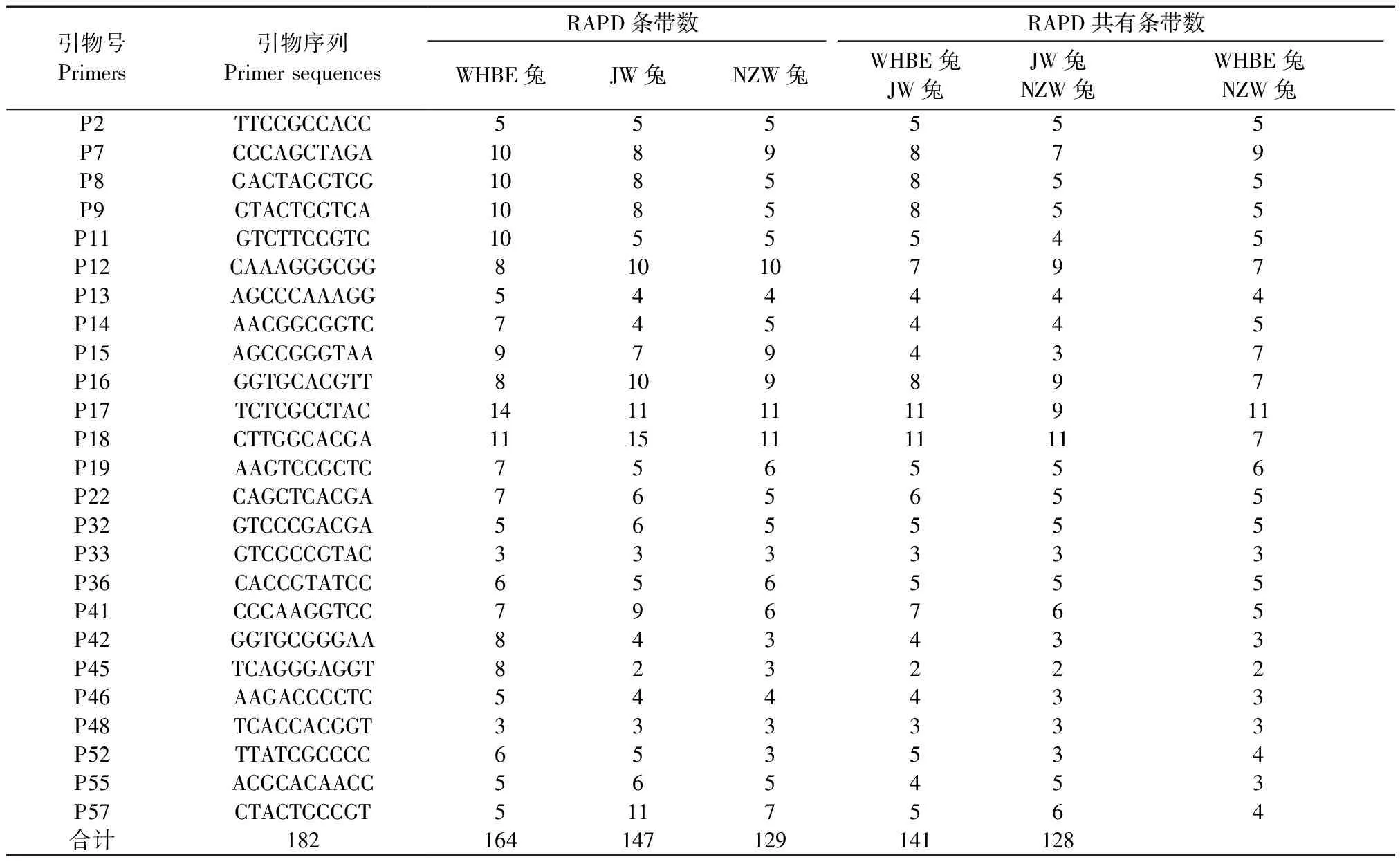
表1 25个随机引物序列及其在3个实验兔品系中的扩增结果

表2 35个未扩增出条带或无多态性的随机引物序列
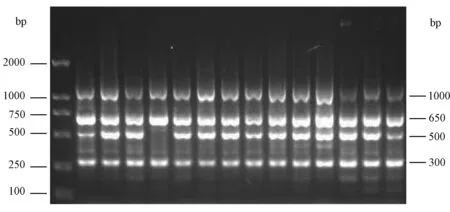
图1 引物P14扩增图谱
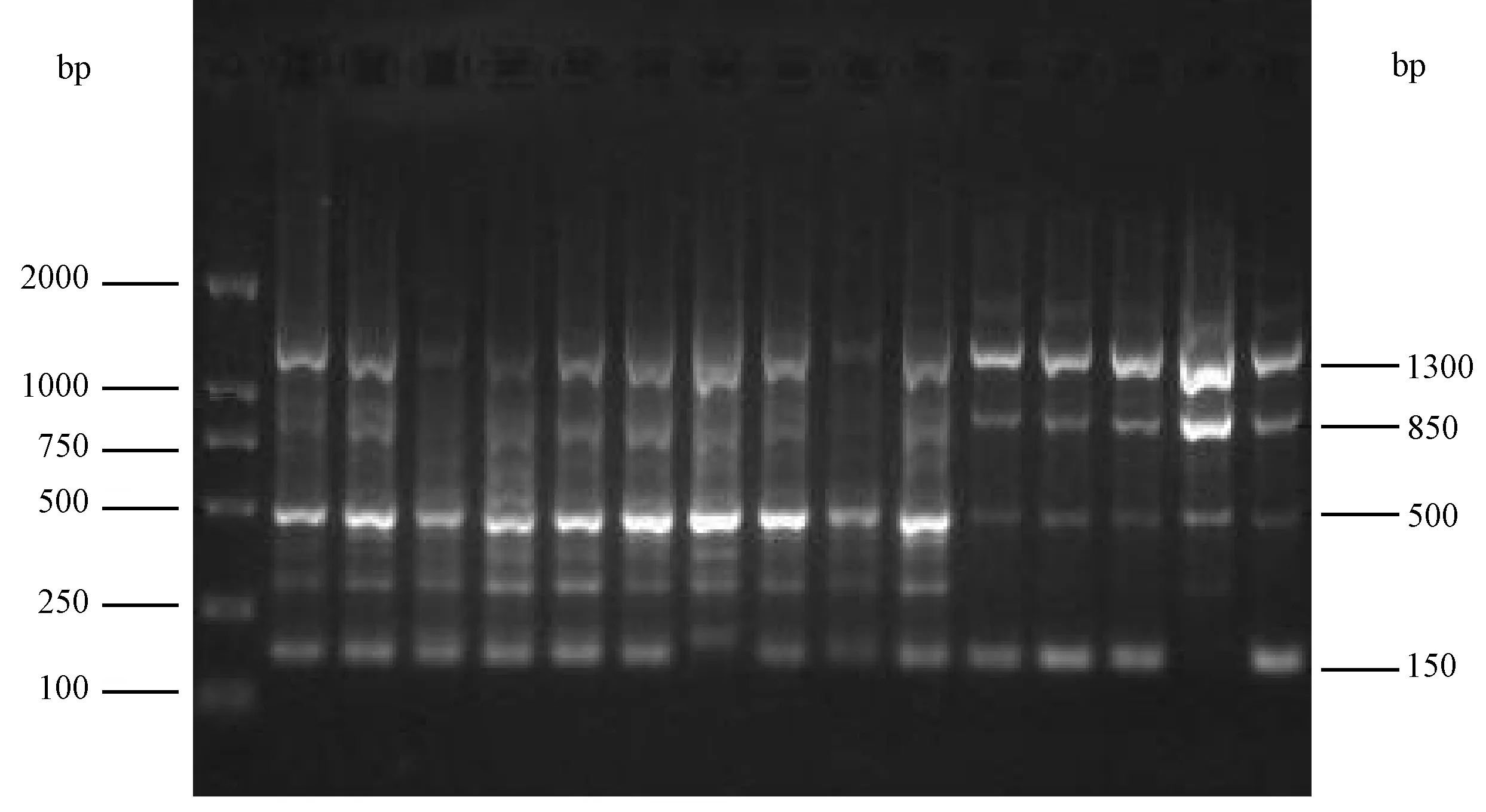
图2 引物P32扩增图谱
2.2 遗传多样性结果
3个群体位点数为228~234个不等,多态位点数在94~166个不等,多态位点比例在40.69%~70.94%之间,Shannon指数为0.1905-0.3385(表3)。WHBE兔的多态位点比例和Shannon多样性值在三个群体中均为最高,说明WHBE兔相对于JW兔和NZW兔而言具有较高的遗传多样性水平。
2.3 遗传相似性结果
群体间的遗传距离和遗传相似系数见表4,JW兔与NZW兔的遗传相似系数最高,为0.8443,WHBE兔与JW兔的遗传相似系数为0.8204,高于WHBE兔与NZW兔的遗传相似系数(0.7862);JW兔与NZW兔的遗传距离最小(0.1557),WHBE兔和JW兔之间的遗传距离(0.1796)小于WHBE兔和NZW兔之间遗传距离(0.2138)。

表3 3个实验兔品系RAPD标记结果分析
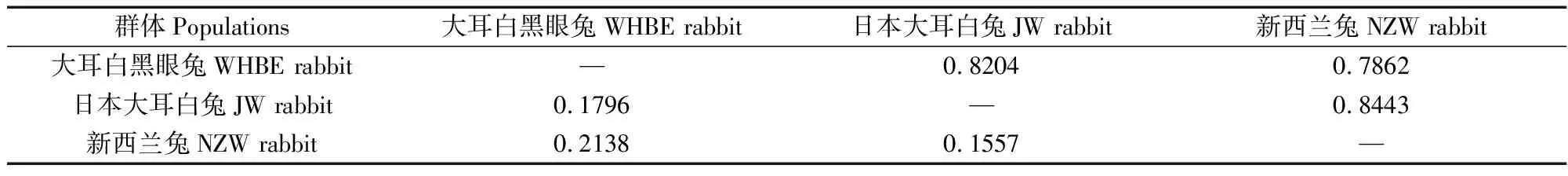
表4 3个实验兔品系的遗传相似性指数(上)及遗传距离(下)
3 讨论
随机扩增多态性DNA技术(random amplified polymorphic DNA,RAPD)是1990年由Willams和Welsh几乎同时发展起来的一项基于PCR技术的DNA分子水平上的大分子多态性检测技术[14,15]。因其具有简便、快速、经济、需样量少和多态性好等特点,受到广泛关注。近年来,此技术已成功应用于遗传多样性检测、基因定位、品系鉴定、医学诊断、遗传图谱构建和系统学研究等诸多领域。
家兔的RAPD标记多态性丰富,RAPD技术能迅速而较准确地提供大量的遗传标记,将不同品系加以区分[9-12,16]。陈民利等[9]选用10个随机引物对3个实验兔品系共22个样本DNA样本进行了RAPD扩增,可扩增出不同品系之间共有的条带和各自的特征条带,可将WHBE兔与日本大耳白兔和新西兰兔品系很好地区分开来。赵立虎等[10]从7套共140个随机引物中筛选出10个多态性较高的引物用于新西兰白兔、青紫兰兔和日本大耳白兔3个品系的RAPD鉴定。庞荣清等[11]从25个随机引物中筛选出5个具有较高多态性的引物,分别对5个群体的80只家兔基因组DNA进行了RAPD-PCR扩增,得到了5个家兔群体之间的远近不同的进化亲缘关系和聚类结果。Soto等[12]利用RAPD技术从31个引物中选用8个多态性好的引物用于Volcano 兔(Romerolagusdiazi)的遗传分析。本研究选用了60个针对兔的RAPD-PCR引物用于本次实验,以获得更多的多态性位点,使结果更趋准确。对三个实验兔品系随机采样,共采集90个样品(WHBE兔30只,JW兔30只,NZW兔30只),能均匀覆盖种群内所有的世代和家系,因此,由这些个体得出的实验结果能够真实全面地反映三个种群的遗传多样性。
利用筛选出来的25条多态性高的引物在3个实验兔品系中进行遗传分析,共检测到493个扩增片段,长度在100 ~1800 bp之间。其中WHBE兔的多态位点比例和Shannon多样性值在三个群体中均为最高,分别为70.94%和0.3385,而NZW兔的多态位点比例和Shannon多样性值在三个群体中最低,分别为40.69%和0.1905,说明WHBE兔相对于JW兔和NZW兔而言具有较高的遗传多样性水平,这一结果也证实了中科院上海实验动物中心刚引进的新西兰兔品系个体遗传品质相对较纯。3个品系实验兔的遗传相似系数范围在0.7862~0.8443 之间,其中WHBE兔与JW兔的遗传相似系数为0.8204,高于WHBE兔与NZW兔的遗传相似系数(0.7862);WHBE兔和JW兔之间的遗传距离(0.1796)小于WHBE兔和NZW兔之间遗传距离(0.2138),这些结果与WHBE兔来源于日本大耳白兔,其血缘关系较近相一致。
日本大耳白兔和新西兰兔作为特种经济动物在我国饲养已有很长的历史,人为地定向选育,造成了血缘杂交,同时长期的饲养环境改变或特殊的饲养环境导致出现遗传学上的基因突变或漂变,WHBE兔的出现可能就是这种结果,该兔的眼球为黑色,且存在血液学和免疫学上的特点。本次研究用大量引物对该三个品系进行RAPD分析,不但可以提供品系鉴定的分子依据,还可以结合其它标记方法进行目的基因的克隆和标记辅助选择,为WHBE兔的遗传育种及其在医学领域中的应用提供参考。
[1] 寿旗扬,陈民利,朱科燕,等.WHBE兔血液流变学及凝血功能测定及分析 [J].实验动物与比较医学,2009,29(6):415-418.
[2] 陈民利,赵伟春,应华忠,等.WHBE兔遗传特异性的RAPD分析 [J].浙江大学学报(农业与生命科学版),2005,31(4):493-498.
[3] 蔡月琴,屠珏,余佳,等.RAPD标记技术用于WHBE兔近交系培育中的遗传分析 [J].中国实验动物学报,2009,17(5):326-329.
[4] 陈民利,朱亮,蔡月琴,等.微卫星技术在大耳白黑眼兔近交系培育中的监测分析 [J].动物学研究,2010,31(4):401-407.
[5] Yap FC,Yan YJ,Loon KT,et al.Phylogenetic analysis of different breeds of domestic chickens in selected area of Peninsular Malaysia inferred from partial cytochrome b gene information and RAPD markers [J].Anim Biotechnol,2010,21(4):226-240.
[6] Yazbeck GM,Brandão RL,Cunha HM,et al.Detection of two morphologically cryptic species from the cursor complex (Akodon spp; Rodentia,Cricetidae) through the use of RAPD markers [J].Genet Mol Res,2011,10(4):2881-2892.
[7] Dutra NC,Telles MP,Dutra DL,et al.Genetic diversity in populations of the viperBothropsmoojeniHoge,1966 in Central Brazil using RAPD markers [J].Genet Mol Res,2008,7(3):603-613.
[8] Apostolidis AP,Gelia D,Mamuris Z.Genetic diversity among Balkan trout populations based on RAPD analysis [J].Genetika,2011,47(8):1097-1102.
[9] 陈民利,赵伟春,应华忠,等.WHBE兔遗传特异性的RAPD分析 [J].浙江大学学报.2005,31(4): 493-498.
[10] 赵立虎,谢夏阳,赵丹凤,等.RAPD分子标记技术用于实验兔品系鉴定的初探 [J].上海交通大学学报.2007,25(1):66-70.
[11] 庞荣清,陈成功,刘万臣,等.家兔随机扩增多态性DNA分析 [J].中国兽医学报.2000,20(2):195-194.
[12] Soto V,Montiel J,Matzumura P,et al.Assessment of the genetic variability in the captive population of Volcano Rabbit (Romerolagus diazi) [J].Vet Méx,2005,36(2):119-127.
[13] Nei M.Genetic distance between populations [J].AmNat,1972,106(949):283-292.
[14] Williams JG,Kubelik AR,Livak KJ,et al.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers [J].Nucl Acids Res,1990,18 (22):6531-6535.
[15] Welsh J,McClelland M.Fingerprinting genomes using PCR with arbitrary primers [J].Nucl Acids Res,1990,18(24):7213-7218.
[16] 杨丽萍,张玉笙,吕连山,等.不同品系家兔的RAPD遗传分析 [J].中国养兔杂志,2000,(3):15-18.

