低温冻存对兔脂肪间充质干细胞部分生物学特性的影响
刘琴,陈芳,杨丽君,王丽平,朱以良,张宜
(解放军广州军区武汉总医院医学实验科,武汉 430070)
脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADMSCs)来源于脂肪组织,具有自我更新、多向分化潜能、对自体损伤小、免疫原性弱、自体移植不发生排斥反应等特点,是组织工程中最有应用前景的种子细胞之一,特别是在骨组织再生利用中具有重要的意义[1-3]。兔脂肪间充质干细胞是体外研究组织工程以及间充质干细胞分化机制的常用间充质干细胞之一。但是,如何获得足量的兔脂肪间充质干细胞,解决兔脂肪间充质干细胞体外扩增、冻存及建立细胞库等问题一直是学者们研究的重要内容。目前,对于兔脂肪间充质干细胞体外扩增、诱导分化的研究已经较为详尽,而对于兔脂肪间充质干细胞低温保存、复苏方面的研究比较少。因此,本课题以兔脂肪间充质干细胞为研究对象,探讨低温保存是否对兔脂肪间充质干细胞的体外生长特性及多向分化潜能产生影响。
1 材料和方法
1.1 材料
1.1.1 实验动物
普通级日本大耳白兔2只,雌雄不限,体重2.5~3.0 kg,由武汉市万千佳兴生物科技有限公司提供【SCXY(鄂)2011-0011】,实验在广州军区武汉总医院医学实验科进行【SYXK(鄂)2008-0007】。实验过程中对动物的处置符合赫尔辛基宣言动物伦理学标准。
1.1.2 主要试剂
DMEM/F12、PBS购自Hyclone,FBS购自Gibco,MTT、DMSO购自Sigma,成脂、成骨诱导试剂盒购自Cyagen公司,FITC-CD90、FITC-CD44、FITC-CD45及相应的同型对照购自美国BD公司,ALP磷酸酶检测试剂盒购自南京建成生物工程研究所,通用细胞冻存液购自Solarbio公司。
1.2 方法
1.2.1 兔脂肪间充质干细胞的分离、培养
参考文献[4]。日本大耳白兔以10%的水合氯醛(2 mL/kg)腹腔注射麻醉,固定于手术台上,手术区脱毛备皮,1%碘伏、75%医用酒精依次消毒,铺单,取股沟处的脂肪组织,移入超净台上,PBS漂洗3~4次,清除组织中肉眼可见的小血管、筋膜,剪碎至糜状,将组织块均匀地铺在25 cm2玻璃细胞培养瓶中,置37℃、5% CO2的细胞培养箱内培养。30 min后取出培养瓶,轻柔地加入2~3 mL含10% FBS的DMEM/F12培养基浸润组织块,继续培养。每天观察细胞生长情况,每3 d更换培养液,7~8 d时刮除组织块。倒置显微镜动态观察培养的兔脂肪间充质干细胞生长形态、结构的变化。待细胞达到80%~90%左右融合时用0.25% trypsin-EDTA进行1∶3传代,记为第一代细胞(P1)。
1.2.2 细胞免疫表型的流式细胞分析
0.25% trypsin-EDTA消化收集对数生长期的第3代细胞,细胞计数,每管含5×105个细胞,800 r/min、2 min,弃上清,每管加入100 μL PBS重悬细胞,加入CD90、CD44、CD45抗体和相应的同型对照10 μL,室温避光孵育30 min,PBS洗涤2~3次,用流式细胞仪检测。
1.2.3 细胞的冻存复苏及复苏率的检测
取经形态学和细胞免疫表型鉴定的第3代细胞,常规方法消化,收集细胞悬液,计数,每支细胞含量1×106个,1000 r/min、2 min,去上清后加入通用细胞冻存液,将冻存管置4℃ 1 h,-20℃ 2 h,再置 -80℃ 过夜,第2天放入-196℃液氮保存,6个月后取出冻存管,在37℃水浴箱中快速解冻,接种至培养瓶内,加入适量DMEM/F12,6 h后换液,待细胞达80%~90%融合时以1∶3进行常规传代。同时取复苏后部分细胞,制成单细胞悬液,用台盼蓝染色计数,计算细胞活力,活率=活细胞总数 /细胞总数×100%,共3次,取3次平均值。
1.2.4 MTT绘制生长曲线
将实验分为两组,实验组为冻存6个月复苏后传至第7代的细胞(P7),调整细胞密度为1×104/mL,接种到96孔板(每孔200 μL),并设调零孔和对照孔,连续测8d;对照组为未经低温冻存的第7代细胞,以相同的细胞密度接种到96孔板。从接种后的第2天起,每天同一时间取样,用PBS冲洗1~2次,各滴加50 μL MTT溶液(5g/L),37℃孵育4 h后吸弃各孔内的液体,加入150 μL DMSO,置摇床上低速振荡10 min,采用酶标仪在490 nm波长处测定各孔吸光值,计算出各组的均值,以时间(d)为横坐标,吸收值(A) 为纵坐标,绘制生长曲线。
1.2.5 细胞分化潜能的检测
根据成脂、成骨分化诱导试剂盒说明书介绍的方法,实验组与对照组分别进行体外成脂、成骨诱导分化实验,诱导2周后分别进行油红O染色、茜素红染色。
1.2.6 ALP 活性测定
实验组与对照组细胞分别成骨诱导3、5、7、9、11、13、15、17 d,取每组4孔细胞,按ALP试剂盒检测各组细胞的碱性磷酸酶活性,检测结果单位换算为 U/104个细胞。碱性磷酸酶活性为金氏单位/g,换算公式为每克组织蛋白在37℃与基质作用15 min产生1 mg酚为一个金氏单位,参考文献[5]。
1.2.7 统计学分析方法
采用 SPSS 10.01 统计软件包进行分析。数据以均数±标准差表示,组间比较采用配对t检验,P值< 0.05为有统计学意义。
2 结果
2.1 兔脂肪间充质干细胞的生长特性
将组织块接种到培养瓶2~3 d后,可见少量细胞从组织块中爬行出来,形态以长梭形为主,少数为圆形、多角形。培养3~4 d后,在光镜下可见更多的细胞从组织块中爬行出来,细胞大小比较均一,形态多为典型的长梭形,见图1A。12~14 d后,细胞数量明显增多,细胞形态变为均一的长梭形,并达到80%左右融合,见图1B。细胞传至第3代时,可见大量成纤维细胞样的细胞呈明显的漩涡状生长,见图1C(图1见彩插9)。
2.2 细胞免疫表型的分析
流式细胞仪分析第3代细胞的细胞表型,检测结果显示:培养的细胞强烈表达间充质干细胞相关的标志物CD44、CD90,阳性率分别达97.60%、99.96%;低表达造血干细胞相关的标志物CD45,阳性率低于0.19%,见图2。表明分离培养的细胞是具有均一间充质干细胞表面特征的细胞群。

图2 流式细胞仪检测第3代兔脂肪间充质干细胞细胞表型
2.3 兔脂肪间充质干细胞冻存复苏培养观察
取冻存6个月的第3代兔脂肪间充质干细胞复苏,台盼兰染色后细胞存活率可达83%。复苏的细胞6 h内贴壁,少许悬浮,贴壁细胞以长梭形为主,生长状态良好,5~6 d达到80%~90%融合,与冻存前兔脂肪间充质干细胞在形态上无明显差别,见图3(彩插9)。传代后细胞增殖速度较快,形态较均一,以长梭形为主。
2.4 生长曲线
采用MTT法绘制冻存前后兔脂肪间充质干细胞的生长曲线,两组均呈典型的“S”形,接种细胞经2天左右的潜伏期后在第4天进入对数生长期,随着培养时间的增加而增殖,在第7天进入平台期,冻存后兔脂肪间充质干细胞的增殖能力与冻存前没有显著差异(P>0.05),见图4。
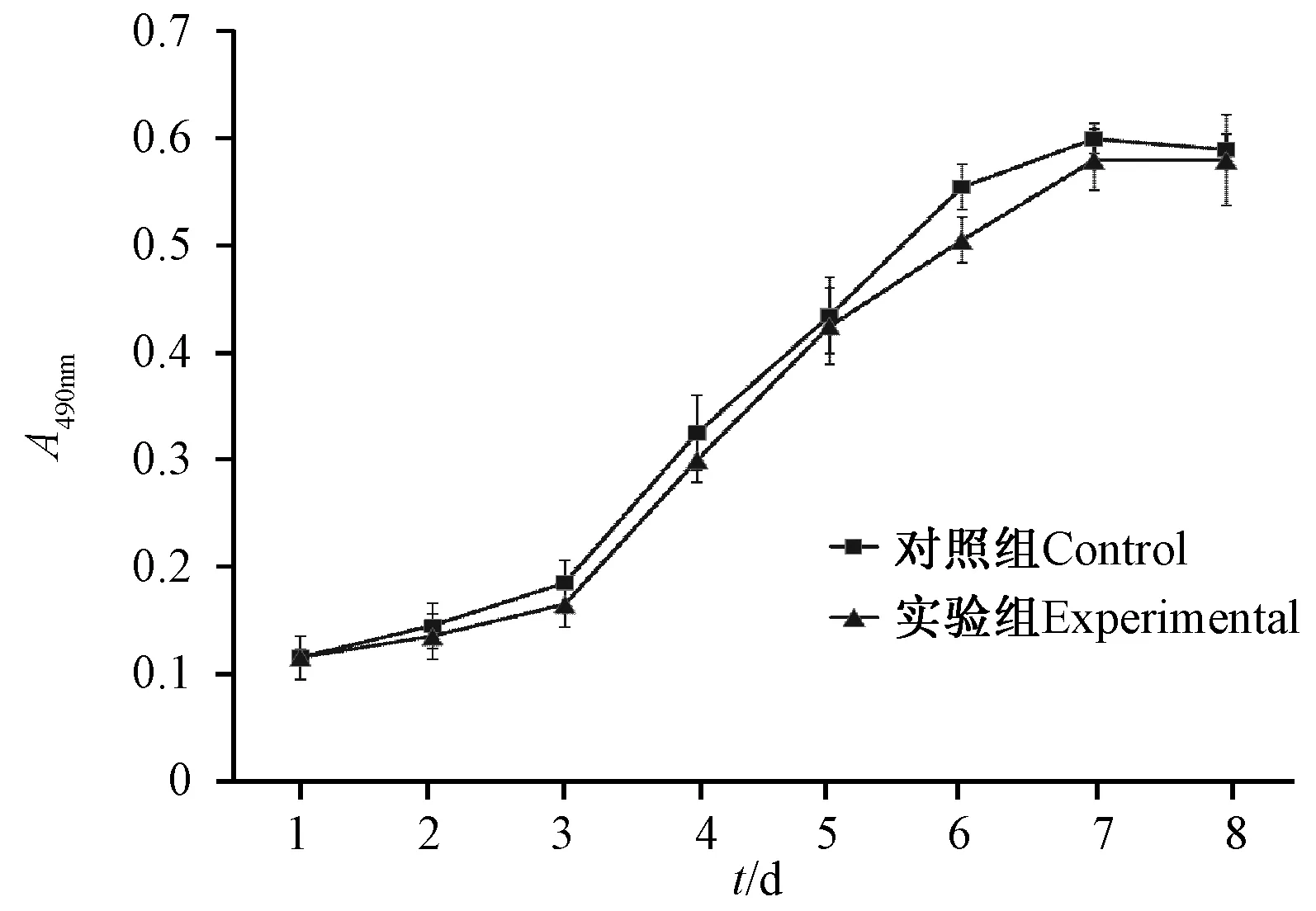
图4 兔脂肪间充质干细胞冻存前后细胞的生长曲线
2.5 油红O染色
为鉴定复苏兔脂肪间充质干细胞向脂肪细胞的分化能力,取复苏后传代至第7代的细胞及未冻存的第7代兔脂肪间充质干细胞,做成细胞爬片,加入成脂诱导液培养,诱导3~4d后少量细胞形态由长梭形逐渐变为多角形、不规则形。诱导5~6 d后胞质内出现少量的脂滴。10~12d时细胞形态以多角形、不规则形为主,细胞内出现大量脂滴。2周时油红O染色,两组细胞内均出现大量红染颗粒,见图5(彩插9)。表明冻存复苏的兔脂肪间充质干细胞可被诱导为脂肪细胞。
2.6 茜素红染色
为鉴定复苏兔脂肪间充质干细胞向成骨细胞的分化能力,取复苏后传代至第7代的细胞及未冻存的第7代兔脂肪间充质干细胞,做成细胞爬片,加入成骨诱导液培养,诱导5~6d后,可见细胞部分形态由长梭形变为不规则形、类圆形、多角形。10~12d后可见不规则形、多角形细胞堆积,呈明显的簇状生长。2周时小心吸弃诱导培养液,用4%多聚甲醛固定后加入茜素红染色,两组细胞均可见桔红色的钙结节,见图6(彩插9)。表明复苏冻存后的兔脂肪间充质干细胞可被诱导为成骨细胞。
2.7 碱性磷酸酶活性测定
冻存后兔脂肪间充质干细胞的碱性磷酸酶表达活性存在明显的变化趋势。成骨诱导1 d时即可检测到低水平表达的碱性磷酸酶,3 d后碱性磷酸酶值开始持续增加,13 d左右达到峰值,之后缓慢下降,与冻存前兔脂肪间充质干细胞碱性磷酸酶表达变化趋势无显著差异(P>0.05),见图7。

图7 冻存前后后兔脂肪间充质干细胞的碱性磷酸酶活性
3 讨论
体外获得足够量的、生物学性状稳定的兔脂肪间充质干细胞是其应用于骨组织工程[6-8],以及脂肪间充质干细胞成骨机制[9]、成软骨机制[10]等研究的先决条件。但兔脂肪间充质干细胞随着传代时间的增加,其增殖、分化能力均逐渐下降;另一方面,若同一课题组不同研究者要进行长期的、连续的实验,则需重新分离细胞,浪费动物和经费,限制兔脂肪间充质干细胞的广泛应用。低温冻存是长期保存细胞的重要方法,可在一定程度上弥补以上不足之处。
本实验采用组织块贴壁法分离培养兔脂肪间充质干细胞,细胞状态良好,形态呈典型的成纤维样。关于脂肪间充质干细胞的分子特征,目前尚无研究发现它有特异性的细胞表型标志物,并且不同的研究结果有着不同的说法。Gronthos[11]及Gu等[12]认为人脂肪间充质干细胞表达CD34。但是,Zuk等[13]和Dominici等[14]的研究结果与之相反。Yoshimura等[15]认为脂肪间充质干细胞表达CD34、CD90,不表达CD31、CD45、CD106、CD146。而Varma MJ等[16]认为脂肪间充质干细胞表达CD34、CD54、CD90、CD105、CD117、HLA-ABC、HLA-DR,阴性表达CD31、CD45、CD106、CD146、CD166。Lindroos等[17]及Baer等[18]认为供体的不均匀性、脂肪间充质干细胞的体外分离方法与抗体的来源、抗体的质量、检测方法的敏感性、细胞培养的条件、鉴定细胞的代数可能是导致研究结果不一致的原因。实验选用具有鉴别意义的细胞表型标记物CD90、CD44、CD45作为兔脂肪间充质干细胞的表型鉴定[19],流式细胞仪检测结果显示,第3代细胞高表达间充质干细胞相关的表面抗原CD44、CD90,阳性率超过90%;不表达造血细胞相关的表面抗原CD45,阳性率低于1%,与文献[20]报道的研究结果基本一致。
二甲基亚砜是细胞冻存液的主要成分, 是一种重要的渗透型细胞保护剂。二甲基亚砜能够降低未结冰溶液中电解质的浓度,在缓慢降温过程中,可使细胞内水分渗出细胞外,防止细胞内液冰晶形成、渗透压改变、细胞结构紊乱等导致的损伤。复苏时1~2 min内复温,可使细胞外结晶在短时间内融化,避免细胞内再形成结晶[21]。将第3代经形态学及表面抗原鉴定的兔脂肪间充质干细胞冻存于液氮中,6个月后复苏,复苏率达83%,复苏的细胞贴壁快,生长状态良好,5~7 d达到80%~90%融合,细胞形态以长梭形为主。传代后,细胞的生长曲线呈典型的“S”形。冻存后细胞的形态、生长曲线与冻存前不存在明显的差别,表明低温冻存不会影响兔脂肪间充质干细胞的自我更新和增殖能力。
为证实冻存复苏多次传代后的兔脂肪间充质干细胞仍具有向脂肪细胞、成骨细胞分化的能力,对冻存复苏传代至第7代及未冻存的第7代兔脂肪间充质干细胞分别进行成脂、成骨诱导。脂滴是成脂诱导过程中形成的特异性物质。细胞外基质钙化是骨组织矿化的标志,是成骨分化的终末期表现[22]。碱性磷酸酶是成骨过程中分泌的特异性蛋白质,其高表达是成骨细胞早期分化的特异性标志[23-24]。实验针对以上指标进行了验证,结果显示,成脂诱导的冻存前后的兔脂肪间充质干细胞油红O染色为阳性。成骨诱导的冻存前后的兔脂肪间充质干细胞茜素红染色为阳性,细胞碱性磷酸酶活性均随着时间的增加明显升高,且冻存前后细胞的碱性磷酸酶活性无显著差异(P>0.05),表面冻存复苏多次传代后的兔脂肪间充质干细胞具有向脂肪细胞、成骨细胞分化的潜能,与报道的冻存复苏多次传代后的脐带间充质干细胞具有多向分化潜能相符合[25]。
综上述,低温冻存可作为长期保存兔脂肪间充质干细胞的一种有效方法,冻存复苏传代后的兔脂肪间充质干细胞保持着干细胞的生物活性,具有较强的增殖能力和向脂肪细胞、成骨细胞分化的能力,为今后建立兔脂肪间充质干细胞库以及兔脂肪间充质干细胞在组织工程、疾病、干细胞分化机制等领域中的应用提供实验依据。
(本文图1,3,5,6见彩插9。)
[1] Fakhry M,Hamade E,Badran B,et al.Molecular mechanisms of mesenchymal stem cell differentiation towards osteoblasts [J].World J Stem Cells,2013,5(4):136-148.
[2] Dorronsoro A,Fernández-Rueda J,Fechter K,et al.Human mesenchymal stromal cell-mediated immunoregulation: mechanisms of action and clinical applications [J].Bone Marrow Res,2013,2013:203643.
[3] 石金鑫,刘剑锋,王海滨,等.棕色脂肪干细胞与白色脂肪干细胞移植对心肌梗死大鼠心功能的影响 [J].中国医药导报,2013,10(15):18-21.
[4] Priya N,Sarcar S,Majumdar AS,et al.Explant culture: a simple,reproducible,efficient and economic technique for isolation of mesenchymal stromal cells from human adipose tissue and lipoaspirate [J].J Tissue Eng Regen Med,2012 July 27:1-9.
[5] 野向阳,李相军,徐岩,等.人脐带间充质干细胞体外成骨及其免疫学特征 [J].中国组织工程研究,2009,13(36):7029-7033.
[6] Tang ZB,Cao JK,Wen N,et al.Posterolateral spinal fusion with nano-hydroxyapatite-collagen/PLA composite and autologous adipose-derived mesenchymal stem cells in a rabbit model [J].J Tissue Eng Regen Med,2012,6(4):325-336.
[7] Mohan BG,Suresh Babu S,Varma HK,et al.In vitro evaluation of bioactive strontium-based ceramic with rabbit adipose-derived stem cells for bone tissue regeneration [J].J Mater Sci Mater Med,2013,24(12):2831-2844.
[8] Arrigoni E,de Girolamo L,Di Giancamillo A,et al.Adipose-derived stem cells and rabbit bone regeneration: histomorphometric,immunohistochemical and mechanical characterization [J].J Orthop Sci,2013,18(2):331-339.
[9] Xu L,Sun X,Cao K,et al.Hypoxia induces osteogenesis in rabbit adipose-derived stem cells overexpressing bone morphogenic protein-2 [J].Oral Dis,2013,doi: 10.1111/odi.12148.[Epub ahead of print].
[10] 杨军,张传辉,李建军,等.动态压力联合胰岛素样生长因子1基因转染促进兔脂肪间充质干细胞低氧诱导因子1α的表达 [J].中华医学杂志,2010,90(45):3220-3224.
[11] Gronthos S,Franklin DM,Leddy HA,et al.Surface protein characterization of human adipose tissue-derived stromal cells [J].J Cell Physiol,2001,189(1):54-63.
[12] 顾繁,高建华,鲁峰.hASCs的单克隆培养及干细胞相关标志物表达的实验研究 [J].南方医科大学学报,2008,28(6):1067-1069.
[13] Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells [J].Mol Biol Cell,2002,13(12):4279-4295.
[14] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for dening multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement [J].Cytotherapy.2006,8(4):315-317
[15] Yoshimura K,Shigeura T,Matsumoto D,et al. Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates [J].J Cell Physiol,2006,208(1): 64-76.
[16] Varma MJ,Breuls RG,Schouten TE,et al.Phenotypical and functional characterization of freshly isolated adipose tissue-derived stem cells [J].Stem Cells Dev,2007,16(1):91-104.
[17] Lindroos B,Suuronen R,Miettinen S.The potential of adipose stem cells in regenerative medicine [J].Stem Cell Rev,2011,7(2):269-291.
[18] Baer PC,Geiger H.Adipose-derived mesenchymal stromal/stem cells: tissue localization,characterization,and heterogeneity [J].Stem Cells Int,2012,2012:812693.
[19] Zuk P.Adipose-derived stem cells in tissue regeneration: a review [J].ISRN Stem Cells,2013,2013:1-35.
[20] Wang Y,Zhao Z,Ren Z,et al.Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration [J].Neurosci Lett,2012,514(1):96-101.
[21] 王璇,刘奕杉,马艳,等.不同组织冻存体系对牙周膜干细胞体外扩增的影响 [J].中国组织工程研究,2013,17(32):5855-5862.
[22] Yu J,Deng Z,Shi J,et al.Differentiation of dental pulp stem cells into regular-shaped dentin-pulp complex induced by tooth germ cell conditioned medium [J].Tissue Eng,2006,12(11):3097-3105.
[23] Dong J,Uemura T,Shirasaki Y,et al.Promotion of bone formation using highly pure porous β-TCP combined with bone marrow-derived osteoprogenitor cells [J].Biomaterials,2002,23(23):4493-4502.
[24] Wang HS,Hung SC,Peng ST,et al.Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord [J].Stem Cells,2004,22(7):1330-1337.
[25] 陈妍,潘丽杰,袁杰,等.冻存脐带间充质干细胞向成骨细胞的分化 [J].中国组织工程研究,2013,17(36):6436-6442.

