母代高脂饮食诱导子代在小鼠生命早期出现糖脂代谢紊乱且具有雄性易感性
郑佳,肖新华,张茜,于淼,许建萍,王志新
(中国医学科学院,北京协和医学院,北京协和医院内分泌科,卫生部内分泌重点实验室,北京 100730)
众所周知,孕期和(或)哺乳期是影响子代生长发育的关键时期。早在20世纪90年代,英国南安普敦大学Barker教授和剑桥大学Hales 教授就提出“胎儿代谢编程假说”,认为生命早期包括孕期和(或)哺乳期营养不良对子代一生有长远影响,即早期营养不良者在成年时患肥胖、高血压、动脉粥样硬化、胰岛素抵抗,糖尿病等代谢性疾病风险明显升高[1]。近年来,大量的临床队列研究和动物模型也证实了这一假说的存在。
大量动物研究表明,母鼠营养过剩能够导致子代出现肥胖,糖耐量异常,胰岛素抵抗和血脂紊乱[3-5]。然而,这些动物实验普遍关注的是母鼠高脂饮食对子鼠成年期甚至老年期的影响,在子鼠生命更早期如断乳时是否存在代谢紊乱仍不清楚。因此,本研究旨在探讨母鼠高脂饮食对子代生命早期糖脂代谢的影响。
1 材料与方法
1.1 实验动物、分组及处理
SPF级 C57BL/6J小鼠,7周龄,雌性16只,雄性8只,体重18~20 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2013-0107】,饲养于中国医学科学院医学实验动物研究所SPF级的饲养间【SYXK(京)2013-0012】。普通饲料高脂饲料均由北京科澳协力饲料有限公司提供。基于以往实验动物模型,普通饲料的能量组成为:11.4%脂肪、62.8%碳水化合物、25.8%蛋白质(总热量:12.6 kJ/g)。高脂饲料的能量组成为:58%脂肪、25.6%碳水化合物、16.4%蛋白质(总热量:23.4 kJ/g)[6]。
7周龄C57BL/6J雌性和雄性小鼠给予1周时间适应环境,期间均给予正常饮食。于8周龄时进行交配,下午7时雌雄鼠2∶1合笼,翌日上午6 时观察阴栓,以观察到阴栓记录为确定怀孕并记录怀孕第0.5天。孕鼠单笼饲养并随机分为高脂饮食组(high fat diet,HFD)和正常饮食组(normal chow diet,NCD),每组8只。生产后将窝仔数量调整为6只,在哺乳期继续孕期饮食饲养,3周后断乳,具体实验流程如图(图1)。孕期和哺乳期均自由摄食饮水,昼夜各12 h循环,环境温度保持在22±2°C,湿度适宜,每天记录摄食情况。
子鼠于3周龄时,空腹12 h后,处死小鼠,从眼眶静脉丛采血,4000 r/min,5 min常温离心后取血清,置于-80℃以待进行代谢指标的测定。另外取肝脏组织置于放入4% 多聚甲醛固定。所有操作均在中国医学科学院医学实验动物研究所进行,均经过中国医学科学院医学实验动物研究所动物伦理委员会审核通过。

图1 动物实验流程图
1.2 实验方法
1.2.1 子代体重测量
母鼠于怀孕第0.5天与怀孕第20天测定体重。子鼠于出生第0.5天记录出生体重,为了减少窝仔数量的差异,出生体重=窝重/只数。在哺乳期每只子鼠每三天测量1 次体重。
1.2.2 子代腹腔糖耐量实验
子代小鼠3 周龄时禁食12 h 后取尾静脉血用德国拜安康血糖仪测定空腹血糖值,记为BG0。随即,给予20%葡萄糖溶液(2 mg/g 体重)腹腔注射,分别于注射后30 min,60 min 和120 min取尾静脉血测定血糖值,记为BG30、BG60 及BG120。根据四个时间点的血糖值计算糖耐量曲线下面积(area under the curve,AUC),糖耐量曲线下面积公式为:AUC=0.5×BG0 + BG30)/2 + 0.5×(BG30 + BG60)/2 + 1×(BG60 + BG120)/2[7]。
1.2.3 子代胰岛素测定和HOMA-IR值
小鼠血清胰岛素测定采用小鼠超敏酶联免疫吸附试验(ELISA)试剂盒购于美国ALPCO公司,试剂盒编号为:80-INSMSU-E01,Salem,NH,批间差异为4.2%。所有操作均严格按照试剂操作说明书进行,并且所有样本均进行双孔重复。另外,采用胰岛素抵抗指数稳态模型(HOMA-IR)来评估子代小鼠胰岛素抵抗的情况。HOMA-IR 的计算公式为:HOMA-IR值=空腹胰岛素 (μU/mL) × 空腹血糖(mmol/L)/22.5[8]。
1.2.4 子代甘油三酯和胆固醇的测定
小鼠血清甘油三酯和胆固醇的测定采用比色法,试剂盒分别购于美国BioVision公司,试剂盒编号分别为甘油三酯(K603-100 ,Mountain View,CA),胆固醇(K622-100,Mountain View,CA)。所有操作均严格按照试剂操作说明书进行,并且所有样本均进行双孔重复。
1.2.5 子代肝脏组织HE染色
3周龄子代小鼠处死后,剪开腹部,取肝脏,放入4% 多聚甲醛固定,24 h 后放入梯度酒精常规脱水包埋切片,切片后进行苏木精-伊红(HE)染色,观察不同组别之间肝脏的病理改变。
1.2.6 统计学分析
采用SPSS 15.0 统计软件进行统计学分析,计量资料数据用均数±标准差表示,子鼠的出生体重,3周龄体重、糖耐量曲线下面积,胰岛素,HOMA-IR值,总胆固醇、甘油三酯采用独立样本t检验实现,子鼠3周龄糖耐量实验各个时间点血糖采用方差分析,P< 0.05 认为差异有显著性。
2 结果
2.1 母鼠孕期体重、血糖变化情况
正常饮食组母鼠与高脂饮食组母鼠在孕前体重和血糖均无明显统计学差异(19.2±1.61 vs.19.6±1.23,P> 0.05)。孕后第0.5天,较正常饮食组母鼠相比,高脂饮食组母鼠体重稍重(22.63±2.31 vs.26.43±2.32,P=0.043),而两组之间血糖差异无显著性(P> 0.05)(表1)。

表1 高脂饮食组和正常组母鼠体重和血糖情况
2.2 子代小鼠体重增长情况
较正常饮食组子鼠相比,高脂饮食组子鼠出生体重稍轻(1.67±0.17 vs.1.51±0.14,P<0.05)。然而出生后第17天和出生后第21天,高脂饮食子鼠较正常组体重较重(图2),其中雄鼠在两组之间具有统计学意义(8.74±1.14 vs.9.73±0.79,P=0.038),而雌鼠未见明显差异(表2)。
2.3 子代小鼠3周龄糖耐量情况和曲线下面积
由图2 可知,高脂饮食组3周龄雄性子鼠腹腔糖耐量实验30 min和60 min血糖明显高于正常组(P<0.001和P<0.01),雌性小鼠在30 min(P<0.01)血糖高于正常组,差异均具有显著性(图3)。糖耐量曲线下面积比较,雄性子鼠高脂饮食组明显大于正常组,具有统计学意义(8.08±1.49 vs.16.45±5.95,P=0.0016)。而雌性子鼠糖耐量曲线下面积在两组之间差异无显著性(表2)。
2.4 子代小鼠3周龄血清胰岛素和胰岛素抵抗指标的评价
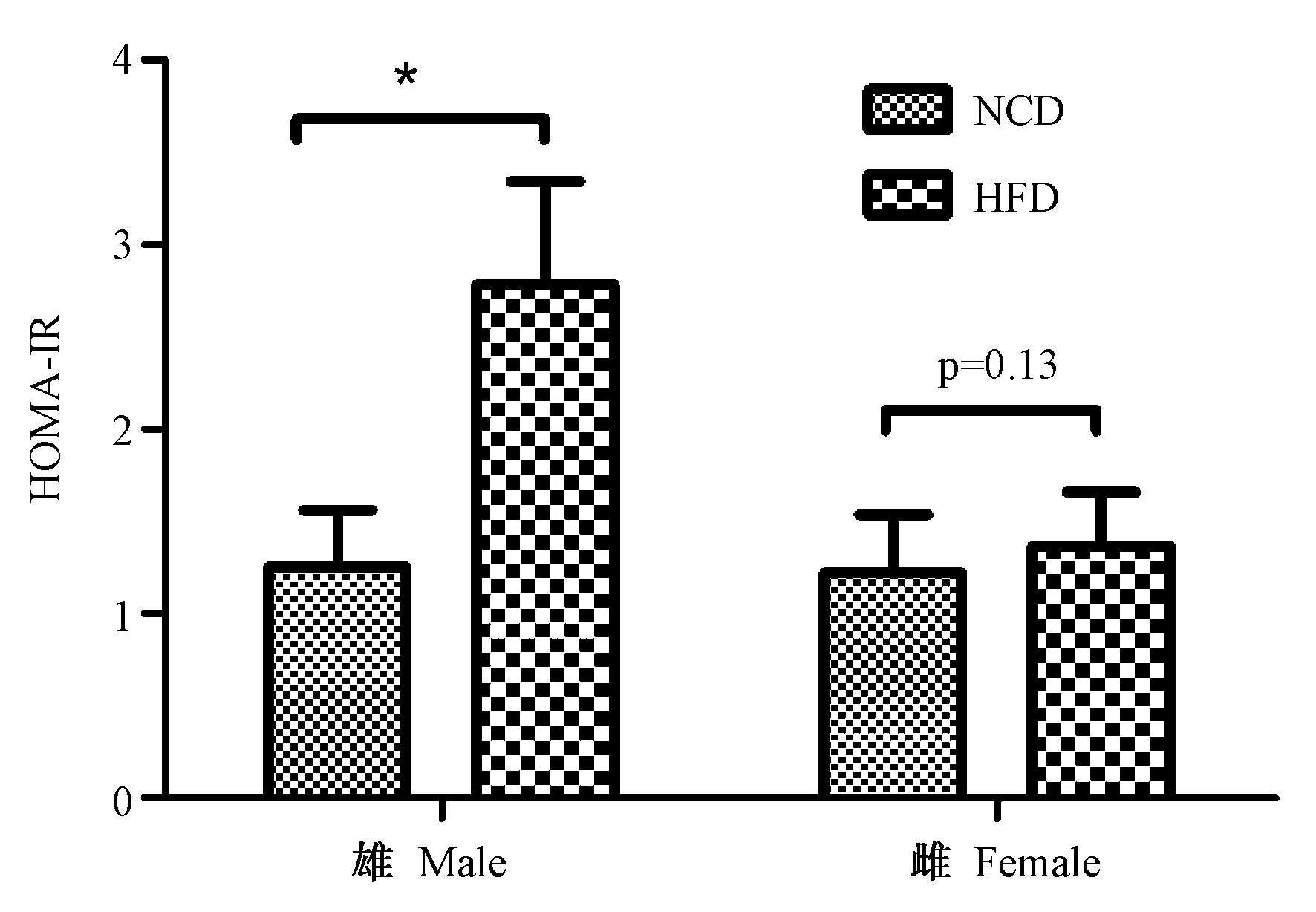
3周龄时,两组雄性和雌性子代小鼠空腹胰岛素水平的差异均无统计学意义(P均>0.05)。在评估胰岛素抵抗的指标方面,雄性小鼠HOMA-IR值高脂饮食组明显高于正常饮食组(P<0.05),而雌性小鼠HOMA-IR值在两组之间差异无显著性(P=0.13) (图4)。

注:*P<0.05 vs.NCD组,各组n =8,NCD:正常饮食,HFD:高脂饮食。
2.5 子代小鼠3周龄血脂情况
3周龄时,两组雄性和雌性子代小鼠空腹甘油三酯水平的差异均无显著性(P均> 0.05)。而雄性和雌性子代小鼠空腹胆固醇水平高脂饮食组均高于正常饮食组,差异均具有显著性(P值分别为<0.0001和0.0004)(表2)。
2.6 子代小鼠3周龄肝脏病理情况
由肝脏HE染色可知,高脂饮食组子鼠在3周龄时肝细胞就已经出现明显气球样变,伴有大量脂肪空泡形成,多为小泡型。而在正常饮食组子鼠的肝脏组织中没有发现这一改变(图5,见彩插1)。
3 讨论
近年来,糖尿病的发病率急剧攀升。尽管人们普遍认为基因与生活方式是糖尿病等代谢性疾病增加的主要因素,但是糖尿病发病率的急剧上升很难仅仅从基因和生活方式上得到解释。随着Barker 等[1]提出“胎儿代谢编程假说”这一理论之后,越来越多的研究开始关注早期发育环境对成年期发生代谢性疾病的影响。大量的临床研究和动物模型显示早期营养不良者(包括营养缺乏与营养过剩)在成年期甚至老年期患肥胖、动脉硬化、胰岛素抵抗、糖尿病等代谢性疾病的风险明显升高[9-12]。

注:**P<0.01,***P<0.001vs NCD组,各组雌雄n=8,NCD:正常饮食,HFD:高脂饮食。
注:*P<0.05 vs.NCD组,各组雌雄n =8,NCD:正常饮食,HFD:高脂饮食。
本研究显示,较正常饮食组子鼠相比,高脂饮食子鼠虽然出生体重更低,然而3周以后,在断乳时,高脂饮食子鼠体重就高于正常饮食组,并且在雄性小鼠中差异更为明显。高脂饮食小鼠的生长率提示“追赶型生长”现象的存在。所谓追赶生长又叫补偿性生长,用来描述因不良因素导致生长迟缓的个体在去除这些因素后出现的生长加速现象。大量证据显示追赶生长能显著增加肥胖、胰岛素抵抗和2型糖尿病的易感性[13]。如果追赶生长发生在在生命早期即一出生就开始出现体重的急剧增加,那么追赶生长所带来的风险会更大[14]。通过监测母鼠摄食量从而评价母鼠和子鼠的摄氏情况,结果显示,在孕期和哺乳期两组母鼠摄食量明显差异,那么造成这一现象的存在可能与高脂饮食有关,与正常饮食相比,高脂饮食含有猪油、蛋黄粉、蔗糖、胆固醇 和酪蛋白等原料,因此能量较高。哺乳期的高脂饮食相对于正常饮食仍处于一种不良的宫内环境之下,因此可以解释高脂饮食组子鼠体重较低,而孕后期这一不良的宫内环境解除,伴随着高脂饮食的摄入,可能导致母乳能量较高,加之子鼠处于生长发育的高峰期,摄食量会较大,从而导致断乳后体重明显高于正常组。
另外,本研究发现,较正常饮食组子鼠相比,在断乳时,高脂饮食组子鼠体重较重,并且已经出现糖耐量异常,胰岛素抵抗,血清胆固醇水平升高和肝脏脂肪变性。既往有研究显示,母鼠在孕前,孕期和哺乳期持续高脂饮食能够导致子代在8周至36周龄出现代谢性疾病,如肥胖,血脂紊乱,胰岛素抵抗和糖尿病[5,15-17]。另一项研究显示,母鼠高脂饮食能够导致子代在15周龄出现非酒精性脂肪肝和非酒精性脂肪肝炎,继续饲养至30周龄,这种现象更为严重[18]。然而,这些实验都局限于只能观察到早期不良营养对子鼠成年期或者老年期的影响,并不清楚这种不良的影响是何时开始出现的。因此与以往研究不同的是,本研究关注的是早期营养不良对子代生命更早期(断乳时)的影响,而不是成年期或者老年期,结果提示,在断乳时这种不良的影响已经存在并且会持续影响。
本研究显示,在高脂饮食组,较雌性子鼠而言,雄性子鼠更易出现肥胖、糖耐量异常、胰岛素抵抗,这与之前的研究结果一致[19,20]。这可能与雄性小鼠摄食量更多相关,另一解释可能为雌性小鼠的糖脂代谢可能受到性激素水平的调节。
综上所述,母代高脂饮食可以在生命早期水平就能影响子代小鼠的代谢状态,使代谢相关器官功能受损,从而增加子代发生代谢性疾病的风险,推测可能是因为母代不良的营养状况引起宫内环境的改变,从而导致在胚胎发育期或新生儿期造成与代谢相关的一些基因功能发生改变,从而引起子代在生命早期水平出现代谢紊乱[21]。如今,表观遗传学已经成为众多领域的研究热点。越来越多的数据显示表观遗传学机制在糖脂代谢异常的发生发展的过程中起着十分关键的作用[22]。因此,表观遗传修饰是否与宫内环境改变从而造成子代在生命早期出现代谢性疾病有关,这也是我们即将要进一步深入研究和探讨的问题。
(本文图5见彩插1。)
[1] Barker DJ,Winter PD,Osmond C,et al.Weight in infancy and death from ischaemic heart disease [J].Lancet,1989,2(8663):577-580.
[2] Forsdahl A.Are poor living conditions in childhood and adolescence an important risk factor for arteriosclerotic heart disease? [J].Br J Prev Social Med,1977,31(2):91-95.
[3] Yokomizo H,Inoguchi T,Sonoda N,et al.Maternal high fat diet induces insulin resistance and deterioration of pancreatic beta cell function in adult offspring with gender differences in mice [J].Am J Physiol Endocr Metab,2014,306(10):E1163-75.
[4] Treesukosol Y,Sun B,Moghadama A,et al.Maternal high-fat diet during pregnancy and lactation reduces the appetitive behavioral component in female offspring tested in a brief-access taste procedure [J].Am J Physiol Regul Integr Comp Physiol,2014,306(7):R499-509.
[5] Zhang J,Zhang F,Didelot X,et al.Maternal high fat diet during pregnancy and lactation alters hepatic expression of insulin like growth factor-2 and key microRNAs in the adult offspring [J].BMC Genomics,2009,10:478.
[6] Winzell MS,Ahren B.The high-fat diet-fed mouse: a model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes [J].Diabetes,2004,53 Suppl 3:S215-219.
[7] Purves RD.Optimum numerical integration methods for estimation of area-under-the-curve (AUC) and area-under-the-moment-curve (AUMC) [J].J Pharmacokinet Biopharm,1992,20(3):211-226.
[8] Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man [J].Diabetologia,1985,28(7):412-419.
[9] Mckay JA,Xie L,Manus C,et al.Metabolic effects of a high-fat diet post-weaning after low maternal dietary folate during pregnancy and lactation [J].Mol Nutrit Food Res,2014,58(5):1087-1097.
[10] Watkins AJ,Sinclair KD.Paternal low protein diet affects adult offspring cardiovascular and metabolic function in mice [J].Am J Physiol Heart Circul Physiol,DOI: 10.1152/ajpheart.00981.2013
[11] Goyal R,Longo LD.Maternal protein deprivation: sexually dimorphic programming of hypertension in the mouse [J].Hypert Res,2013,36(1):29-35.
[12] Benatti RO,Melo AM,Borges FO,et al.Maternal high-fat diet consumption modulates hepatic lipid metabolism and microRNA-122 (miR-122) and microRNA-370 (miR-370) expression in offspring [J].Br J Nutr,2014,111(12):2112-122.
[13] Ong KK,Petry CJ,Emmett PM,et al.Insulin sensitivity and secretion in normal children related to size at birth,postnatal growth,and plasma insulin-like growth factor-I levels [J].Diabetologia,2004,47(6):1064-1070.
[14] Dulloo AG.A role for suppressed skeletal muscle thermogenesis in pathways from weight fluctuations to the insulin resistance syndrome [J].Acta Physiol Scand,2005,184(4):295-307.
[15] Elahi MM,Cagampang FR,Mukhtar D,et al.Long-term maternal high-fat feeding from weaning through pregnancy and lactation predisposes offspring to hypertension,raised plasma lipids and fatty liver in mice [J].Br J Nutr,2009,102(4):514-519.
[16] Borengasser SJ,Kang P,Faske J,et al.High fat diet and in utero exposure to maternal obesity disrupts circadian rhythm and leads to metabolic programming of liver in rat offspring [J].PloS One,2014,9(1):e84209.
[17] Masuyama H,Hiramatsu Y.Effects of a high-fat diet exposure in utero on the metabolic syndrome-like phenomenon in mouse offspring through epigenetic changes in adipocytokine gene expression [J].Endocrinology,2012,153(6):2823-2830.
[18] Bruce KD,Cagampang FR,Argenton M,et al.Maternal high-fat feeding primes steatohepatitis in adult mice offspring,involving mitochondrial dysfunction and altered lipogenesis gene expression [J].Hepatology,2009,50(6):1796-1808.
[19] tsuduki T,Kitano Y,Honma T,et al.High dietary fat intake during lactation promotes development of diet-induced obesity in male offspring of mice [J].J Nutrit Sci Vitaminol,2013,59(5):384-392.
[20] Van Straten EM,Bloks VW,Van Dijk TH,et al.Sex-dependent programming of glucose and fatty acid metabolism in mouse offspring by maternal protein restriction [J].Gender Med,2012,9(3):166-79 e13.
[21] Velloso LA.Maternal consumption of high-fat diet disturbs hypothalamic neuronal function in the offspring: implications for the genesis of obesity [J].Endocrinology,2012,153(2):543-545.
[22] Aguilera O,Fernandez A F,Munoz A,et al.Epigenetics and environment: a complex relationship [J].J Appl Physiol,2010,109(1):243-251.

