移植部位对小鼠睾丸移植效果的影响
张艺宝,李淼,郁丽丽,强苏静,刘丽均,徐 平,,芮荣
(1.南京农业大学动物医学院,南京 210095:2.中国科学院上海生命科学研究院,上海 201615;3.上海斯莱克实验动物有限责任公司,上海 201615)
自2002年Honaramooz[1]通过睾丸移植观察到成熟的精子以来,睾丸移植技术一直备受关注。研究睾丸移植具有较高的实用价值:睾丸移植可提供一个理想的体外模型,用于研究精子发生及其调控机制[2],研究睾丸功能及其调节[3]等;睾丸移植后的睾酮分泌与生精功能可为雄性不育和性功能障碍的治疗提供新途径;自体睾丸移植是治疗腹腔型隐睾患者的有效方法[4]。同时,睾丸冷冻移植也是保存青春期前肿瘤患者生育能力的研究热点[2],其可行性已得到相关实验的支持[5]。此外,睾丸移植在种质资源保存方面也具有特别的意义。许多珍稀动物和高价值动物品系的生存能力都比较弱,可能很多个体在性成熟之前就会死亡,致使很多传统的保种方式无法应用,可以通过睾丸移植实现保种[6],还可以通过跨物种的睾丸异种移植进行保种[7],减少受体对保种的限制。
虽然睾丸移植方面的研究众多,但是对移植部位的选择方面的研究却很少,而睾丸移植的部位会影响睾丸移植的效果[8],国内尚未见相关的研究报道。本文研究探讨了睾丸白膜内、肾包膜下和背部皮下3个不同植入部位对睾丸移植效果的影响以期为该技术的研究与应用奠定基础。
1 材料和方法
1.1 实验动物
SPF级C57BL/6J雄性小鼠共63只。其中29只为4周龄,体重13~14 g,34只为5日龄,体重约3 g,均来自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002],所有实验在屏障设施内开展[SYXK(沪)2012-0002]。
1.2 实验分组
将29只4周龄小鼠按睾丸移植部位的不同分为:A,B,C三组,其中A组为睾丸白膜内移植(6只)、B组为肾包膜下移植(10只)和C组为背部皮下移植(5只)。并设假移植对照组和阉割对照组两组对照。睾丸白膜内组6只小鼠,移植睾丸12个;肾包膜下组10只小鼠,移植睾丸15个;背部皮下组5只小鼠,移植睾丸40个;假移植对照组和阉割对照组每组各4只小鼠。
1.3 供体睾丸的收集
34只5日龄C57BL/6J雄鼠处死后,腹部喷洒酒精,打开腹腔,取出双侧睾丸,置于Leibovitz’s培养液(购自Gibco公司,美国)中。在解剖显微镜下小心剥除白膜,连同培养基一起置于冰袋上待用。
1.4 受体鼠的处理
所有的受体鼠均为4周龄C57BL/6J小鼠。按0.15 mL/10 g体重的剂量,腹腔注射0.5%戊巴比妥麻醉。睾丸白膜内移植组受体鼠只麻醉不做预处理。假移植对照组仅将睾丸白膜剪一刀后还纳。阉割对照组仅将睾丸摘除,不做移植。通过阴囊切口摘除背部皮下组和肾包膜下组雄性受体鼠的双侧睾丸,并用缝线闭合阴囊切口。
1.5 睾丸移植
受体鼠处理后,立刻将收集待用的睾丸移植到受体鼠的相应部位。
1.5.1 背部皮下移植
在受体鼠的背部沿脊柱的两侧每侧剪4个2~3 mm长的小切口,每个切口移入一个睾丸,切口不必缝合。
1.5.2 肾包膜下移植
通过背部切口,小心的将一侧肾脏牵引出体外,小心的滴1~2滴肾上腺素,防止出血过多。小心的将肾包膜剪一个小口,视肾包膜内的压力情况,用维纳斯镊子移入1~2个睾丸。将肾脏还纳,用缝线分别缝合肌肉和皮肤。
1.5.3 睾丸白膜内移植
通过腹白线切口打开腹腔,将睾丸牵引出体外,在白膜上滴1~2滴肾上腺素,防止过度出血。用维纳斯剪刀将白膜剪一个小口,剪掉一小部分曲细精管,移入1个睾丸后小心将其还纳腹腔,如法操作另一侧睾丸。常规闭合腹腔。
1.6 移植效果的判定
在移植8周后将受体鼠处死。根据受体精囊的重量,移植睾丸的成活率,移植睾丸的增重倍数和移植睾丸的分化率和曲细精管分化程度来评估移植的效果。统计受体精囊的重量,统计移植成活率和移植睾丸增重情况。所有移植回收物放在Bouin氏固定液(购自Sigma公司,美国)中固定,做石蜡切片,HE染色。分析回收睾丸的分化率和曲细精管的分化程度。
1.7 数据分析

2 结果
2.1 受体精囊的重量
阉割对照组的精囊完全吸收无法称量(图1a),背部皮下组(图1d)、肾包膜下组(图1e)、睾丸白膜内组(图1c)的精囊眼观与假移植对照组相差不大(图1b)。精囊的平均重量由高到低分别为假移植对照组(280.20±10.56 mg)、睾丸白膜内组(260.66±10.97 mg)、肾包膜下组(221.11±21.49 mg)和背部皮下组(216.32±46.19 mg)。经方差分析,假移植对照组与睾丸白膜内组差异不显著,与肾包膜下组差异显著(P<0.05),与背部皮下组差异显著(P<0.05),睾丸白膜内组与肾包膜下组差异显著(P<0.05),与背部皮下组差异显著(P<0.05)。肾包膜下组和背部皮下组差异不显著(图1见彩插7)。
2.2 移植物的存活率
移植物的存活率见表1,经x2检验各组间的差异无统计学意义(P>0.05),各组间差异不显著。

表1 不同移植部位移植物的存活率
2.3 移植物增重倍数
统计结果显示,不同部位移植物增重倍数(图2)由高到低分别为睾丸白膜内组(7.64±3.10)、肾包膜下组(6.87±1.80)和背部皮下组(4.19±2.11)。经单因素方差分析(ANOVA),各组间的差异有显著性(P<0.01)。睾丸白膜内组和背部皮下组差异有显著性(P<0.05),肾包膜下组与背部皮下组差异有显著性(P<0.05)。睾丸白膜内组和肾包膜下组差异无显著性(P>0.05)。
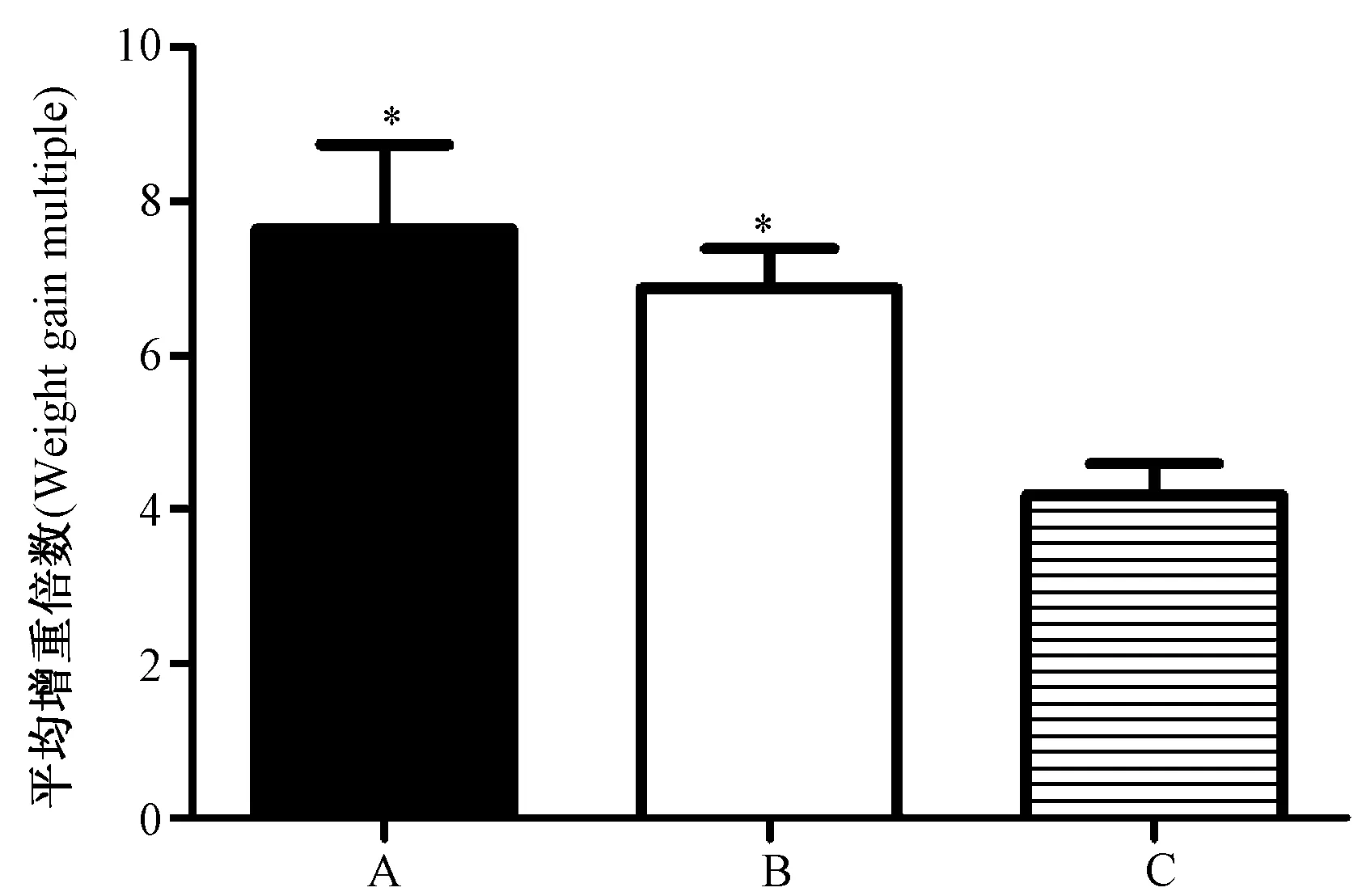
注:A.睾丸白膜内组;B.肾包膜下组;C.背部皮下组。与背部皮下组比较,*P<0.05。
2.4 移植物的分化情况
回收的移植物石蜡切片,HE染色,分析精原细胞的分化情况。肾包膜下组(图3d)所有睾丸的所有曲细精管均未见分化的精原细胞。睾丸白膜内组所有睾丸的曲细精管中都分化有成熟精子(图3b),与假移植对照组(图3a)相似。背部皮下组也有成熟的精子(图3c),但只有29.2%(7/24)的睾丸发生分化,分化的睾丸中有35.7%(129/361)的曲细精管中的精原细胞发生分化(图3见彩插8)。
3 讨论
睾丸是分泌雄性激素的主要内分泌器官。雄性血清中的睾酮95%以上都是由睾丸Leydig 细胞分泌的。精子的发生受FSH和LH的调节。支持细胞分泌的抑制素可以负反馈调节FSH和LH的分泌。精囊的重量对雄激素的水平有高度的依赖性。所以可以通过精囊的重量来评估受体内雄激素的水平。我们发现去势对照组雄鼠的精囊已经退化消失(图1a),而睾丸白膜内组、背部皮下组和假移植对照组的精囊眼观都较为明显(图1b,c,d)。说明移植的睾丸在受体中能够重新发挥分泌雄激素的功能。Schlatt[9]的研究也显示在去势的动物中缺乏睾酮,血清中FSH和LH显著增加。移植后小鼠血清FSH水平明显低于去势小鼠,且维持在去势小鼠和正常小鼠之间,血清中睾酮的含量可以达到正常水平。胡云飞[10]的研究也表明睾丸移植可以明显提高男性性功能减退患者血清中睾酮的水平,并改善其性功能和第二性征。肾包膜下移植组和背部皮下移植组的精囊重量均小于睾丸白膜内移植组和假移植对照组,且差异显著(P<0.05)。这可能是因为将睾丸移植到肾包膜下和背部皮下,虽然能够重新建立激素的调控分泌机制,但肾包膜下和背部皮下不是常规分泌激素的部位,激素的分泌调节和分泌的激素进入血液都受到了一定的影响。
未成熟睾丸有较低的免疫原性,睾丸组织大量表达FasL分子,可阻止移植器官免受受体淋巴细胞的攻击[11],这为移植睾丸的存活提供了重要的保障。本研究结果显示,各移植组睾丸的存活率都很高,最低的背部皮下组也有67.5%的存活率,比Schlatt[9]用大量样本得到的60%的存活率稍高,各组间的差异无统计学的意义,表明移植的睾丸容易存活,睾丸移植的可行性较高。睾丸移植回收后比移植前增重明显(大于4倍,图2)。睾丸白膜内移植组和肾包膜下组比背部皮下组的存活率高,而且睾丸白膜内组和肾包膜下组的增重倍数都显著高于背部皮下组,这可能是因为这几个部位的血管比背部皮下更丰富,供血更充分所致。
肾包膜下组的睾丸中未见精子发生的重建(图3d)。背部皮下组可以看到分化的精母细胞和成熟的精子(图3c),说明将睾丸移植到背部皮下可以恢复睾丸的精子发生功能。但背部皮下组分化率较低,只有29.2%的睾丸发生分化,分化的睾丸中也只有35.7%的曲细精管中的精原细胞发生分化,明显低于睾丸白膜内移植组和假移植对照组。这可能与不明原因的生殖细胞减少有关[12,13]。睾丸白膜内移植组的分率和分化程度与假移植对照组类似。这可能是因为精子的发生的最适温度略低于体温,肾包膜下移植,移植物处于腹腔内,温度偏高,不利于精子发生。而背部皮下移植,移植物处于皮下利于散热,利于精子的发生。阴囊处的皮肤结构有利于调节睾丸的温度,这也是睾丸白膜内移植,生殖细胞分化情况最好的原因之一。有研究表明移植部位的温度对精子的发生至关重要[14]。睾丸白膜内移植虽然会有较好的生殖细胞分化效果,但是不易区分受体的睾丸和移植的睾丸,不易明确得到精子的来源,在移植睾丸保种方面的应用受到一定的限制。睾丸背部皮下移植产生的精子来源清晰明确,一个受体可以移植入多个睾丸,可以通过增加移植的数量,一定程度上弥补生殖细胞分化率低的不足。而且睾丸背部皮下移植的操作难度远低于睾丸白膜内移植,综合这几个方面,背部皮下移植在保种方面的有较高的实用价值。
本实验结果显示,睾丸白膜内移植的效果最好,但不易区分移植的睾丸和受体自身的睾丸。背部皮下移植可以满足睾丸移植的需要,且每个受体可以接受较多数目的移植物。肾包膜下睾丸移植不适合用于小鼠雄性生殖器官的安全保存。
(本文图1见彩插7,图3见彩插8)。
[1] Honaramooz A,Snedaker A,Boiani M,et al.Sperm from neonatal mammalian testes grafted in mice [J].Nature,2002,6899(418):778-781.
[2] 于洁,张芳婷.睾丸组织移植与青春期前抗癌治疗儿童生育能力的保存 [J].中国男科学杂志,2010,01:67-69+72.
[3] Mitchell R T,Sharpe R M,Anderson R A,et al.Diethylstilboestrol exposure does not reduce testosterone production in human fetal testis xenografts [J].PLoS ONE,2013,4(8):e61726.
[4] Tackett L D,Wacksman J,Billmire D,et al.The high intra-abdominal testis: technique and long-term success of laparoscopic testicular autotransplantation [J].J Endourol,2002,6(16):359-361.
[5] Poels J,Van Langendonckt A,Many M C,et al.Vitrification preserves proliferation capacity in human spermatogonia [J].Hum Reprod,2013,3(28):578-589.
[6] Abbasi S and Honaramooz A.Feasibility of salvaging genetic potential of post-mortem fawns: production of sperm in testis tissue xenografts from immature donor white-tailed deer (Odocoileus virginianus) in recipient mice [J].Anim Reprod Sci,2012,1-4(135):47-52.
[7] Arregui L,Dobrinski I,Roldan ER.Germ cell survival and differentiation after xenotransplantation of testis tissue from three endangered species: Iberian lynx (Lynx pardinus),Cuvier’s gazella (Gazella cuvieri) and Mohor gazelle (G.dama mhorr)[J].Reprod Fertil Dev,2013,Jun 14.doi: 10.1071/RD12411.[Epub ahead of print].
[8] Nunes S I,Fernandes C B,Rezende D F,et al.Verification of the feasibility of autogenous testis implant in omentum and abdominal wall in mice [J].Rev Col Bras Cir,2013,1(40): 60-65.
[9] Schlatt S,Honaramooz A,Boiani M,et al.Progeny from sperm obtained after ectopic grafting of neonatal mouse testes [J].Biol Reprod,2003,6(68): 2331-2335.
[10] 胡云飞,王玲珑,杨嗣星,等.以胎儿睾丸为移植体的睾丸移植六例报告 [J].临床外科杂志,2002,05: 284-285.
[11] Bellgrau D,Gold D,Selawry H,et al.A role for CD95 ligand in preventing graft rejection [J].Nature,1995,6550(377): 630-632.
[12] Mota P C,Ehmcke J,Westernstroer B,et al.Effects of different storage protocols on cat testis tissue potential for xenografting and recovery of spermatogenesis [J].Theriogenology,2012,2(77): 299-310.
[13] Poels J,Van Langendonckt A,Dehoux J P,et al.Vitrification of non-human primate immature testicular tissue allows maintenance of proliferating spermatogonial cells after xenografting to recipient mice [J].Theriogenology,2012,5(77): 1008-1013.
[14] Ma P,Ge Y,Wang S,et al.Spermatogenesis following syngeneic testicular transplantation in Balb/c mice [J].Reproduction,2004,2(128): 163-170.

