C57小鼠LATl真核表达载体的构建及其对Neuro-2a细胞的影响
卫兵艳,刘田福,樊林花,刘茂林
(山西医科大学实验动物中心,太原 030001)
作为构成蛋白质的基本元件,氨基酸不仅是机体的营养物质还是肠黏膜代谢的能量来源,其参与细胞内很多重要的代谢途径。但氨基酸是小分子极性物质,不能自由通过细胞膜,其要发挥各种功能首先需要进行跨膜转运。而要实现氨基酸的跨膜转运就必须依赖细胞膜上特殊的转运载体( 氨基酸跨膜转运蛋白)来介导。目前发现的氨基酸转运载体约有15种以上[1],根据底物(氨基酸)的性质的不同,可以将氨基酸转运载体分为碱性、酸性和中性氨基转运载体,根据Na+依赖性分为Na+依赖性和Na+非依赖性转运系统。L氨基酸转运载体1( lamino acid transporter 1,LAT1)是中性氨基酸转运载体中的重要成员,属于Na+非依赖性氨基酸转运系统,主要负责转运大的、支链的、芳香族的中性氨基酸,包括一些必需氨基酸,如亮氨酸等[2]。其功能调控对机体细胞代谢,生命器官功能维护具有重要的生理意义。研究发现[3],在恶性肿瘤增殖中,LAT1呈过表达,可以促进肿瘤细胞的增殖、侵袭和迁移。LAT1在医学、营养等生命科学领域也有着重要的价值[4]。Neuro-2a细胞形似神经样干细胞,具有一定的神经内分泌功能,是来源于Albino A系小鼠的自发神经母细胞瘤。目前主要在实验室培养该细胞系作为体外病理研究的细胞模型[5]。本实验选用Neuro-2a作为细胞模型,通过构建LAT1基因的真核表达载体,转染Neuro-2a细胞,初步研究LAT1对Neuro-2a细胞增殖及凋亡的影响,旨在为更深入研究LAT1在肿瘤细胞中的作用及其生物学功能奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 8周龄SPF级雄性 C57BL/6J小鼠来自山西医科大学实验动物中心,生产许可证【SCXK(晋)2009-0001】,SPF级实验动物使用许可证【SYXK(晋)2009-0004】。
1.1.2 细胞及载体 Neuro-2a细胞,pcDNA3.1质粒等均由本实验室保存。
1.1.3 其他试剂 DNA maker,RNA提取试剂盒,质粒提取试剂盒,反转录试剂盒,限制性内切酶等均购于TaKaRa公司;脂质体LipfectamineTM2000转染试剂购自invitrogen 公司;LAT1单克隆抗体,β-actin单克隆抗体购于美国Santa Cruz公司;PCR引物及质粒测序由 TaKaRa公司完成;MTT购自美国sigma公司。
1.2 方法
1.2.1 C57小鼠LAT1全长基因片段的扩增
1.2.1.1 设计引物
利用primer premier5.0设计引物,根据 GenBank(GI: 6906726)中公布的C57小鼠LAT1基因序列,编码区全长共1539 bp,引入NotI和XhoI酶切位点,序列为(斜体为保护碱基,下划线为酶切位点)5′引物:TTGCGGCCGCAACCGAGAGCATGG CGGTCG3′引物:CCGCTCGAGCGGAGCACGGCA GCACCCAGG,由TaKaRa公司合成。
1.2.1.2 RT-PCR扩增LAT1全长基因序列
参照RNA提取试剂盒说明提取C57小鼠脑组织总RNA,以总RNA为模板进行RT-PCR扩增cDNA。然后以cDNA为模板,进行PCR,条件为:预变性94℃ 5 min,94℃ 30 s,52℃ 30 s,72℃ 1 min,共30个循环。最后72℃再延伸5 min,终止反应。PCR扩增产物1.2%琼脂糖凝胶电泳,紫外灯下观察电泳结果。
1.2.2 pcDNA3.1-LAT1真核表达载体的构建
胶回收纯化PCR的目标片段产物,加A后,先和pMD18-T载体链接,构建pMD18-T-LAT1克隆载体,NotI和XhoI双酶切鉴定。然后将pMD18-T-LAT1和pcDNA3.1载体分别用NotI和XhoI进行酶切,回收预定片段,进行连接。体系:LAT1目的片段2 uL,载体1 uL,反应液 5 uL,共计10 uL的连接体系于16℃过夜,然后转化DH5a感受态细胞,涂布于含氨苄的LB平板培养基上,37℃恒温过夜培养,挑取白色单克隆,按质粒提取试剂盒说明提质粒后,NotI和XhoI双酶切鉴定,酶切正确的质粒送TaKaRa公司进行测序。
1.2.3 pcDNA3.1-LAT1转染Neuro-2a细胞
1.2.3.1 pcDNA3.1-LAT1瞬时转染Neuro-2a细胞
先将Neuro-2a细胞从液氮罐中快速取出于37℃恒温进行复苏,然后传代。待细胞融合度达80%以上进行转染,按每孔分别加4.0 μg质粒(pcDNA3.1-LAT1或pcDNA3.1)及10 μL脂质体计算,取适量的质粒及脂质体进行混合,室温静置20 min。弃去各孔内旧培养液,然后用平衡DMEM/F12培养基冲洗两次,将质粒及脂质体混合液按组分别加入各孔内。具体分组:选取4孔作为阳性组(pcDNA3.1-LAT1质粒进行转染),标记为第①、②、③和④;另任选4孔为对照组(pcDNA3.1质粒进行转染),标记为第⑤,⑥,⑦和⑧;其余孔设为空白组(不含质粒,只含脂质体的培养基)并标记为*。于37℃,5% CO2无菌培养箱中培养6 h。吸弃旧培养基及混合物,加入1 mL新鲜完全培养基后,37℃,5% CO2培养箱中孵育24~48 h。
1.2.3.2 建立稳定转染的Neuro-2a细胞系
瞬转后48 h,实验组、对照组及空白组的每孔细胞分别加入500 ng/μL G418的完全培养基进行筛选。用胰蛋白酶消化Neuro-2a细胞,使细胞密度达1×103/mL,取2 mL细胞悬液置于无菌培养皿中,在倒置显微镜下,用自制的毛细吸管逐个吸出单细胞分别置于含适量新鲜完全培养基的96孔培养板中。37℃,5% CO2无菌培养箱内继续培养。等到细胞长到96孔培养板的孔底1/3~1/2面积时,每孔加入200 ng/μL的G418继续加压筛选6~7 d。倒置显微镜镜下观察,挑选生长良好的细胞转种于24孔板进行扩大培养。
1.2.4 LAT1在细胞中表达的检测
1.2.4.1 LAT1基因mRNA水平的检测
细胞计数后4℃,8000 r/min离心2 min,收集沉淀。按每1×107个细胞加入2 mL的TRIzol并参照试剂说明提取总RNA,并用紫外分光光度计对RNA纯度和浓度进行鉴定。然后参照TakaRa反转录试剂盒说明,用内参及LAT1引物做 RT-PCR,检测Neuro-2a细胞中LAT1基因在mRNA水平的表达。
1.2.4.2 LAT1蛋白表达水平的检测
细胞裂解液充分裂解Neuro-2a细胞,12000 r/min离心3 min,提取总蛋白,于紫外分光光度计上测OD值,计算蛋白含量。上样30 μg总蛋白、12%SDS-PAGE分离后电转移至硝酸纤维素膜上,蛋白干粉封闭液封闭1 h,弃TBST,加新鲜配制的一抗(LAT1一抗稀释度为1∶250;β-actin一抗稀释度为1:1000),4℃孵育过夜。TBST洗膜3次,每次5 min后,加入辣根过氧化物酶偶联的鼠抗兔二抗(1∶2000)室温孵育1 h。然后TBST再洗膜3次,每次5 min后,DAB显色。以β-actin蛋白作参照,分析LAT1蛋白的相对表达量。
1.2.5 LAT1蛋白表达对Neuro-2a细胞增殖的影响
各组细胞分别经EDTA-胰蛋白酶消化、离心、计数,以每孔1×103/孔的密度接种于96孔板,每组设6个重复孔,别于1t,2t,3t,4t,5t,6t(每天上午10时)进行MTT检测。具体方法:37℃,5%C02无菌培养箱中培养到各自时间点,于超净工作台内,将各实验孔内加入20 μL MTT溶液(5 mg/mL)(析出紫色结晶),继续孵育充分反应4 h。小心吸弃上清后各实验孔加入150 μL DMS0,可见紫色结晶溶解,孔板于摇床轻摇混匀后,继续孵育10 min。最后取出96孔板置于酶联检测仪测试台,于570 nm波长下检测各孔溶液的OD值。检测结果以空白孔调零,以时间为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.2.6 LAT1对Neuro-2a细胞周期的影响
各组细胞复苏后,等到达80%融合度以上,以1×103/孔的密度接种于24孔板,每组分别设4个重复孔。37℃,5%C02无菌培养箱中培养约48~72 h。37℃预平衡的胰蛋白酶消化,1000 r/min离心2 min,收集细胞沉淀,用1 mL PBS漂洗两次。再次离心收集细胞沉淀(每管约含2~3万个细胞),然后每管加入由200 μLPI染料和200 μL打孔剂组成的染色液0.5 mL,排序后室温避光孵育30 min以上。细胞染色后1 h内,借助流式细胞仪进行检测,分析细胞周期及凋亡的变化。
1.2.7 统计分析
实验数据结果采用SPSS13.0进行统计学分析,P< 0.05为差异有统计学意义;图表则采用SigmaPlot10.0软件进行绘制分析。
2 结果
2.1 瞬转后各组LAT1mRNA水平的检测结果
凝胶图像分析系统进行条带光密度扫描,发现转染48 h后细胞中LAT1表达量最多,以 GAPDH 为内参对LAT1相对表达量进行分析,转染后48 h与其他时间点LAT1的表达量以及与对照组LAT1表达量具有显著差异(P< 0.05),以对照组(空质粒转染)48 h细胞中LAT1表达量与空白组(未转染)表达量差异没有统计学意义(P> 0.1)(图1)。

注:1转染24 h;2转染48 h; 3转染72 h;4转染96 h;5 对照组;6 空白组。
2.2 稳转后LAT1 mRNA水平的检测结果
以GAPDH 为内参(250 bp),经RT-PCR 对实验组、对照组及空白组的LAT1(1550 bp)进行检测,通过凝胶图像分析软件对目的片段和内参进行灰度分析,比值见图2,实验组和后两者比差异有统计学意义(P< 0.05),对照组和空白组差异没有统计学意义。
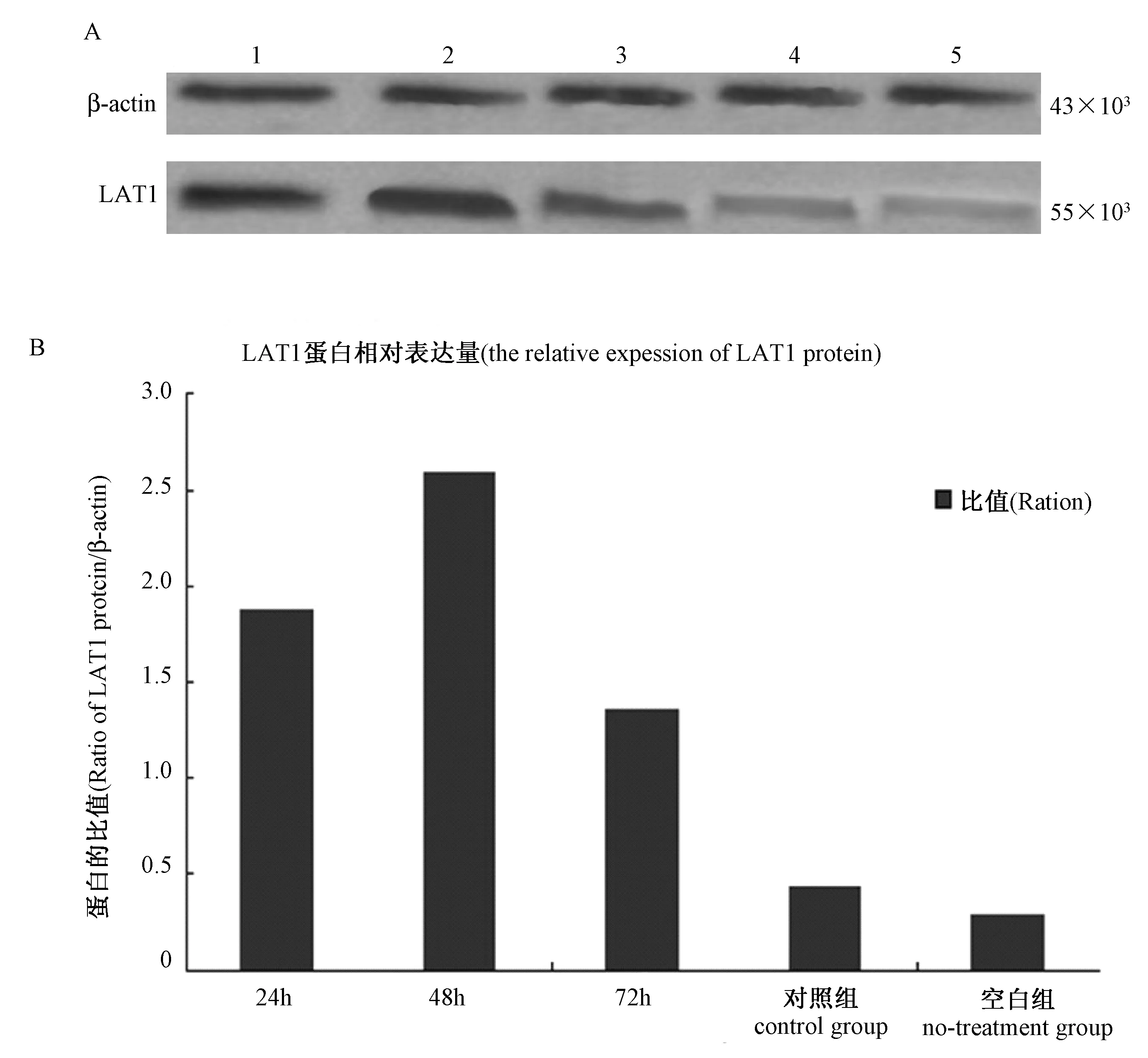
2.3 LAT1蛋白水平表达的检测结果
Western-blot检测结果显示:在转染的Neuro-2a细胞中表达的LAT1蛋白可以被LAT1单克隆抗体特异性识别,大小与预期相同,相对分子质量约为55×103。以β-actin为内参各组的相对表达量(图3),且实验组表达量高于对照组及空白组。
2.4 LAT1表达对Neuro-2a细胞的增殖影响
MTT法检测细胞的增殖,绘制细胞生长曲线,发现实验组Neuro-2a细胞增殖比对照组细胞增殖快,差异有统计学意义(P< 0.05)。
2.5 LAT1表达对Neuro-2a细胞周期分析
通过流式细胞仪检测各组Neuro-2a细胞周期,结果显示实验组GO/Gl期的细胞数明显低于对照组,而S和G2/M期的细胞数增加,说明LAT1有促进Neuro-2a细胞增殖的作用。
2.6 LAT1对Neuro-2a细胞的凋亡分析
从二维散点图结果可以看出,LAT1能抑制细胞的凋亡。

注:1对照组;3 空白组;5 实验组;2.4.6 内参。
注: 1.2.3 不同时间实验组;4对照组;5空白组。
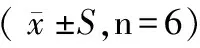


注:与对照组比较,*P < 0.05,**P < 0.01。
表2 各组细胞周期G1,G2和S的比例
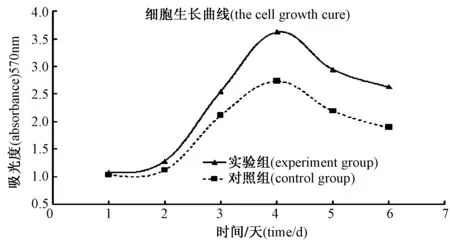
图4 各组细胞1-6d的生长曲线
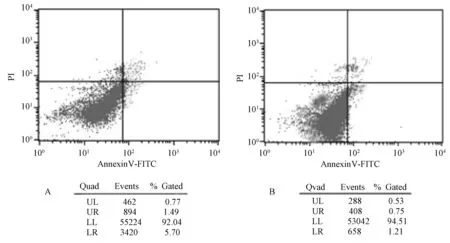
注:A,对照组;B,实验组。
3 讨论
氨基酸作为营养物质进出细胞,必须依赖于氨基酸转运载体来介导。如果氨基酸转运过程出现异常将会导致严重的氨基酸吸收和代谢障碍性疾病[6]。同时肿瘤细胞在增殖、迁移、侵袭的过程中也需要大量的氨基酸提供营养,氨基酸跨膜转运载体则为氨基酸进出肿瘤细胞提供了载体。可见氨基酸转运载体在氨基酸转运过程中具有重要的生理及病理意义[7-9]。L型氨基酸转运载l(LATl)是肠上皮细胞中非常重要的中性氨基酸转运载体,其除转运支链氨基酸、芳香族氨基酸、中性氨基酸还有一些必需氨基酸外,同时还参与转运如左旋溶肉瘤素等抗肿瘤药物、左旋多巴类抗帕金森药物以及多巴酚丁胺等抗癫痫药物[2,10-12]。LATl作为一种为氨基酸进出细胞提供中介的载体已经逐步被人们所认识。目前,对LATl的研究主要集中在载体的转运特性及生理特性、蛋白表达与结构等方面,而对转运体的调控机制方面还涉足很少,且其生物学功能调节的分子机制目前尚未完全阐明,尤其在肿瘤治疗方面的价值还需要进一步探索。本研究发现转染 pcDNA3.1- LAT1质粒的Neuro-2a 细胞具有LAT1的生物学转运活性,且LAT1蛋白的表达能促进Neuro-2a细胞增殖,同时抑制细胞凋亡的发生。提示可否通过抑制LAT1的功能来抑制肿瘤的增殖呢?为下一步的研究提供了新的思路。本实验从细胞水平研究了LATl在肿瘤细胞中的表达及对肿瘤细胞的影响,为研究LAT1在肿瘤中的作用奠定基础。这对于肿瘤的发生、发展及治疗方面都有着重要的意义。
参考文献:
[1] Chino M,Mikami T,Yoshida T,etal.High expression of L-type amino acid transporter l(LAT1)in gastric carcinomas:comparison with non-cancerous lesions[J].Pathol Int,201l,6l(5):281-289.
[2] 黄士隋.氨基酸转运载体LATl在肿瘤中的研究进展[J].临床肿瘤学杂志,2012,17(1):85-88.
[3] Youland RS,Kitange GJ,Peterson TE,etal. The role of LAT1 in (18)F-DOPA uptake in malignant gliomas[J].J Neurooncol,2013,111(1):11-8.
[4] Pinho MJ,Cabral JM,Silva E,etal. LAT1 overexpression and function compensates downregulation of ASCT2 in an in vitro model of renal proximal tubule cell ageing[J].Mol Cell Biochem,2011,349(1-2):107-16.
[5] 罗扬拓,朱承睿,武元,等.噬菌体展示技术发展.现代生物医学进展,2011,11(12):2389-2390.
[6] Fan X,Ross DD,Arakawa H,etal. Impact of system L amino acid transporter 1 (LAT1) on proliferation of human ovarian cancer cells: a possible target for combination therapy with anti-proliferative aminopeptidase inhibitors.[J].Biochem Pharmacol,2010,80(6):811-8.
[7] Kaira K,Sunose Y,Ohshima Y,etal. Clinical significance of L-type amino acid transporter 1 expression as a prognostic marker and potential of new targeting therapy in biliary tract cancer.BMC Cancer,2013,13(1):482.
[8] Kaira K,Oriuchi N,Takahashi T,etal. L-type amino acid transporter 1 (LAT1) expression in malignant pleural mesothelioma[J].Anticancer Res,2011,31(12):4075-82.
[9] Peura L,Malmioja K,Laine K,etal. Large amino acid transporter 1 (LAT1) prodrugs of valproic acid:new prodrug design ideas for central nervous system delivery[J].MolPharm,2011,8(5):1857-66.
[10] Peura L,Malmioja K,Huttunen K,etal. Design,synthesis and brain uptake of LAT1-targeted amino acid prodrugs of dopamine[J].Pharm Res,2013,30(10):2523-37.
[11] Ohkawa M,Ohno Y,Masuko K,etal. Oncogenicity of L-type amino-acid transporter 1 (LAT1) revealed by targeted gene disruption in chicken DT40 cells: LAT1 is a promising molecular target for human cancer therapy[J].Biochem Biophys Res Commun,2011,406(4):649-55.
[12] Ohtsuki S,Yamaguchi H,Kang YS,etal. Reduction of L-type amino acid transporter 1 mRNA expression in brain capillaries in a mouse model of Parkinson's disease[J].Biol Pharm Bull,2010,33(7):1250-2.

