佳助结扎血管夹对胆囊切除术后兔的安全性研究
陈献花,潘永明,包一红,胡 飞,庞秀炳,陈 亮,朱科燕,徐剑钦,陈民利
(1.浙江省医疗器械检验院,杭州 310018;2. 浙江中医药大学动物实验研究中心,杭州 310053;3. 浙江微度医疗器械有限公司,浙江 东阳 322118)
腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)已成为治疗胆囊良性疾病的金标准[1],其手术微创、恢复快,已在临床普及应用,但近来术后所致并发症亦有增多趋势,其中避免术后胆漏和出血是LC手术中的关键环节[2],故应用牢固可靠的结扎胆囊管和胆囊动脉的结扎夹对避免和预防术后并发症的发生显得尤其重要。目前在LC术中使用最多的为钛夹,钛夹虽价廉、操作简便快捷,但近来发现钛夹夹闭有可能因夹闭不全而脱落或移位进入胆管而引起胆管炎、梗阻或结石形成。该金属夹具有导电性,若电凝器接触时会引起组织烧伤,并对影像学检查亦有潜在的干扰等缺点[3-4]。近年来随着高分子医学生物材料研发力度的加大,可吸收性止血夹和聚合物止血夹产品的相应诞生,其在操作性、实用可靠性以及不受磁场作用等方面显示出较大的优势;但这些产品在当前腹腔镜胆囊切除术中仍以进口产品占主导地位,价格十分昂贵。佳助结扎血管夹是由浙江微度医疗器械有限公司自主研制的新产品,由人体不吸收的聚甲醛材料经一次注塑而成。本研究采用佳助结扎夹结扎胆囊管和胆囊动脉进行兔开腹胆囊切除术,观察佳助结扎血管夹结扎后对兔机体的影响及其安全性,并与同类产品Hem-o-lok结扎夹比较,为进一步的临床应用研究提供参考。
1 材料和方法
1.1 实验动物
普通级健康成年日本大耳白兔36只,体重为2.0~2.5 kg,雌雄各半,来源于新昌大市聚镇欣健兔场【SCXK(浙)2010-0042】,饲养于浙江中医药大学动物实验研究中心兔饲养室【SYXK(浙)2008- 0116】,室内温度为20~22℃,相对湿度为40%~70%,饲喂全价营养颗粒饲料,自由饮水,12 h/12 h明暗交替。
1.2 材料、试剂及仪器
佳助结扎血管夹(WD-JZM型,批号:JY1004-1108001),浙江微度医疗器械有限公司研制;Hem-o-lok结扎夹(L544240型,批号:01A1000481),美国威克公司生产;速眠新II注射液和鹿醒宁注射液,吉林省华牧动物保健有限公司生产;盐酸氯胺酮注射液,福建古田药业有限公司生产;谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、尿素氮(BUN)、肌酐(CREA)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)、血糖(GLU)等测定试剂盒,上海申能德赛诊断技术有限公司生产;血清钾(K)、钠(Na)、氯(Cl)等测定试剂盒,南京建成生物工程研究所生产;血常规试剂包,Sciemens Medical Solutions Diagnositics Inc 生产;组织型纤溶酶原激活剂(t-PA)和纤溶酶原激活剂抑制因子(PAI-1)ELISA试剂盒,购自杭州达文生物有限公司;7020全自动生化分析仪,日本日立公司;DU 800紫外分光光度计;拜耳五分类全自动血液分析仪,美国拜耳公司;VARIOSKAN FLASH连续光谱酶标仪,芬兰Thermo Fisher公司。
1.3 方法
1.3.1 动物分组和处理
经适应饲养1周后,空腹取耳中动脉血测定血液生化指标,经检测无异常后,按体重随机分成3组,即正常对照组(NC)、试验(佳助, Jiazhu)组和同类产品对照(Hem-o-lok)组,每组12只,雌雄各半,试验组和同类产品对照组均行胆囊切除术并分别使用佳助结扎血管夹和Hem-o-lok结扎夹夹闭胆囊管和胆囊动脉,正常对照组不做任何处理,在术后6个月、12个月时各组均处理6只。
1.3.2 兔胆囊切除术及结扎血管夹的使用
术前将兔禁食12 h后,用速眠新II注射液0.2 mL和氯胺酮注射液0.2 mL联合肌注麻醉,麻醉稳定后,仰卧位固定,消毒铺巾,无菌操作下取前正中切口4 cm入腹;轻轻地上拉肝脏显露胆囊和胆囊三角,解剖胆囊三角,分离出胆囊管及胆囊动脉,并在胆囊管及胆囊动脉的近心端和远心端使用结扎血管夹各1枚,切断后锐性剥离并切除胆囊,观察无出血和胆汁漏出后,缝合腹壁切口,消毒,肌注鹿醒宁注射液0.2 mL促苏醒,送回饲养室。期间肌注青霉素钠4万单位/只,连续3 d(图1)。
1.3.3 指标观察
1.3.3.1 一般情况观察:试验期间观察各组动物的精神、行为活动、饮食、粪便尿液和体重等一般情况,并在处死后观察结扎部位的大体病变情况。
1.3.3.2 对兔血液生化指标的影响:分别在术前、术后1周、2周、1个月、2个月、4个月、6个月、9个月和12个月时,空腹取耳中动脉肝素抗凝血2 mL,3000 r/min离心10 min,分离血浆,在7020全自动生化分析仪上测定血浆ALT、AST、TBIL、BUN、CREA、TP、ALB、TC、TG、GLU的变化;同时另取2 mL血,3000 r/min离心10 min,分离血清,在DU 800紫外分光光度计上测定血清K、Na、Cl和VARIOSKAN FLASH连续光谱酶标仪上采用ELISA法测定t-PA、PAI-1含量,并取1 mL全血置入EDTA-K2抗凝管中抗凝,用于血液学分析,观察白细胞(WBC)、中性粒细胞(NEUT)、淋巴细胞(LYM)、红细胞(RBC)、血小板(PLT)和网织红细胞百分率(%RETI)的变化。
1.3.3.3 对兔脏器重量及系数的影响:术后6个月和12个月时各组随机取6只实验兔,空腹称重,用3%戊巴比妥钠溶液耳缘静脉注射麻醉过量处死,剖腹并肉眼观察结扎血管夹和周围夹闭区域的病理变化,取心、肝、脾、肺、肾、胸腺、肾上腺、脑、卵巢、子宫、睾丸、附睾组织,用滤纸吸干后,在电子分析天平上称取湿重,计算其脏器系数(g/kg)=脏器湿重(g)/体重(kg)。
1.4 统计学处理
2 结果
2.1 对兔一般情况和结扎部位的观察
正常对照组兔精神行为、粪便尿液等一般情况均无异常;试验组和同类产品对照组均在术后3 d内食欲相对较差,部分兔粪便略有变细,但在术后1周开始食欲好转,精神行为、粪便尿液均与正常对照组无异,创面愈合良好;但试验组体重术后3 d时明显降低(P< 0.01),术后2周时恢复至术前;同类产品对照组术后3 d~1个月均低于正常对照组(P< 0.05,P< 0.01),之后恢复至术前;此后试验组和同类产品对照组均与正常对照组呈相同的增长趋势(P> 0.05)。另外,试验组体重与同类产品对照组比无明显差异(P> 0.05)(表1)。剖解观察显示,试验组兔的结扎血管夹和同类产品对照Hem-o-lok结扎夹表面均有外周纤维组织膜包裹,呈白色,无瘀血和胆漏发生,结扎部位牢固,未见移位或脱落(图2)。
2.2 对血液生化指标的影响
试验期间,正常对照组的各项血液生化指标在一定范围内呈现不规则的小幅波动。与正常对照组比,试验组ALT在术后1周时明显升高(P< 0.05),CREA和ALB水平均在术后1~2周时显著降低(P< 0.05,P< 0.01),TG含量在术后2周时明显升高(P< 0.05),而GLU浓度则在术后2周和1个月时明显降低(P< 0.01);同类产品对照组ALT在术后1周时亦明显升高(P< 0.05),ALB和GLU含量在术后2周时降低显著(P< 0.01),TC含量在术后1~2周时明显升高(P< 0.05),各组其余指标在整个试验期间与正常对照组比均无明显影响(P> 0.05);此外,试验组各指标与同类产品对照组比亦均差异不显著(P> 0.05),佳助结扎血管夹植入术后的反应与同类产品对照组类似(表2)。
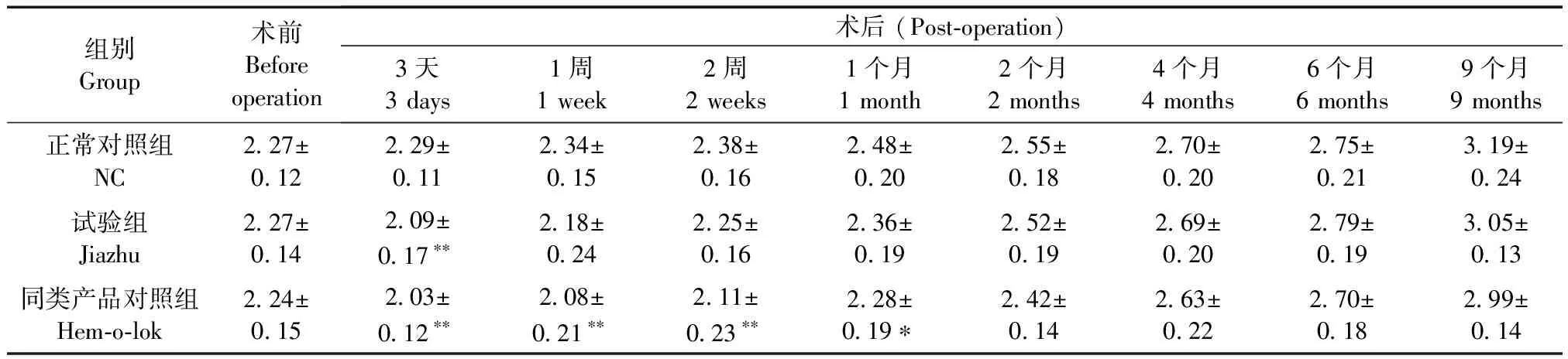
表1 各组兔体重的变化
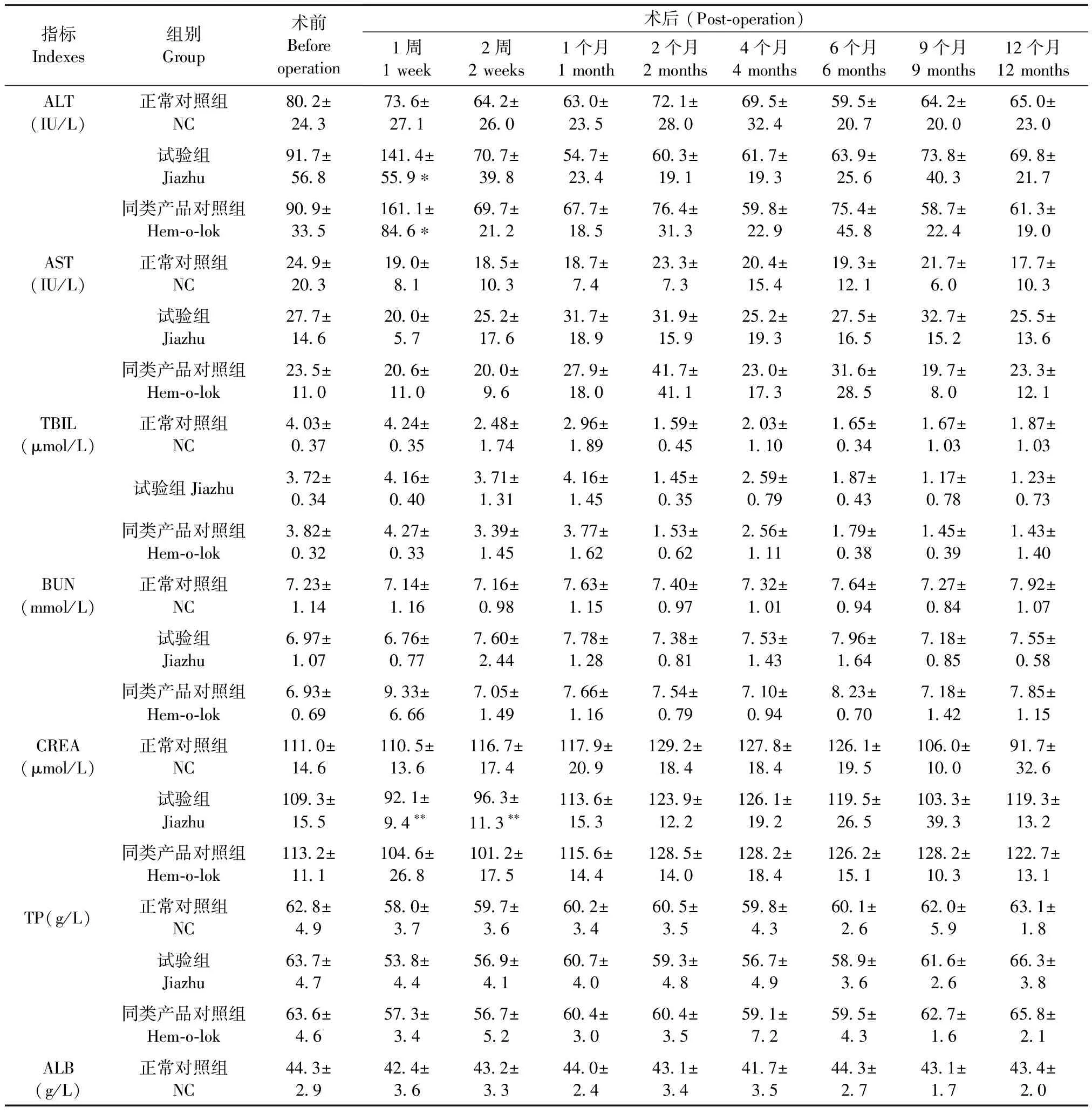
表2 各组兔血液生化指标的变化
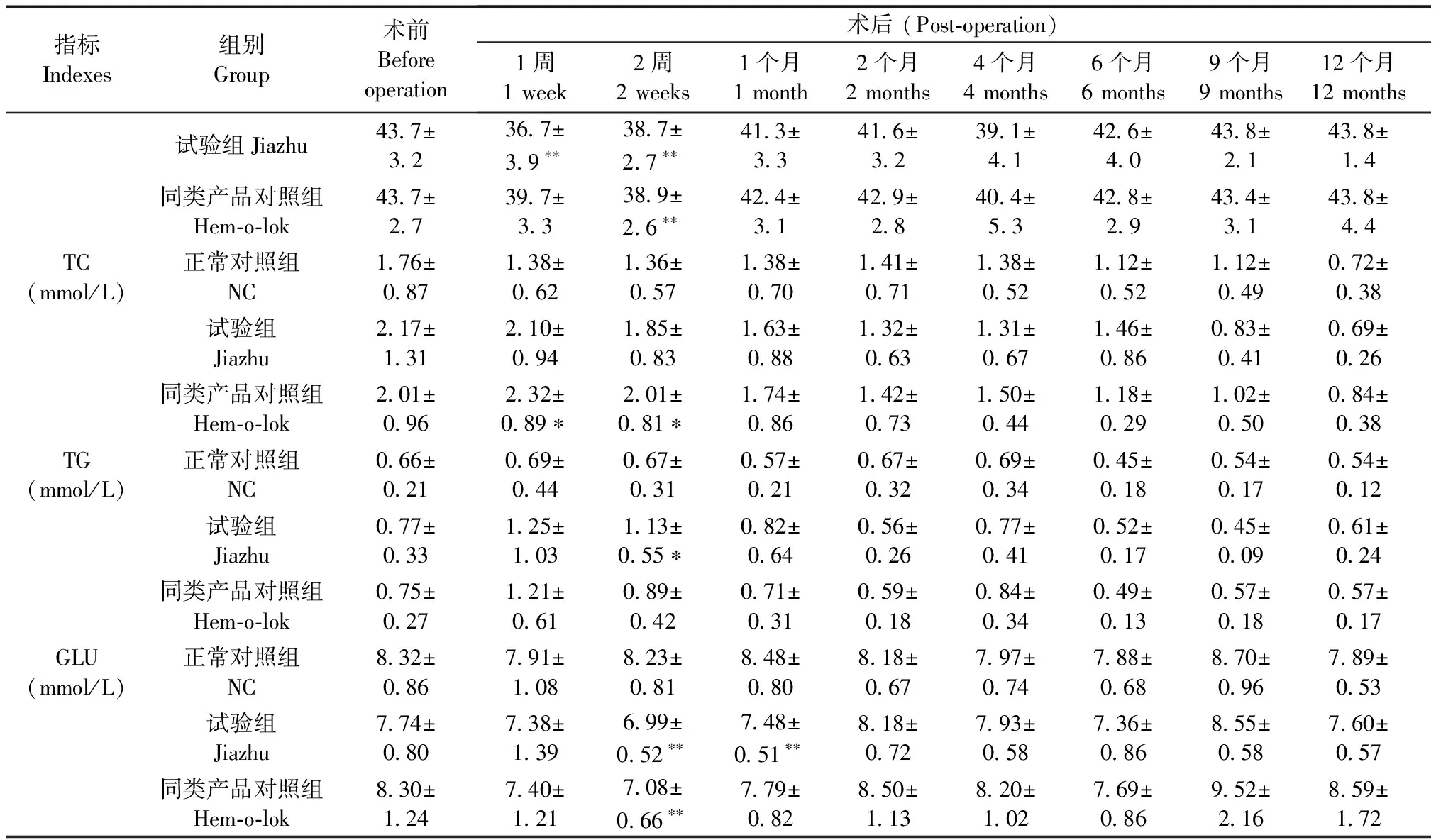
续表
2.3 对血液学指标的影响
试验期间,正常对照组各项血液学参数均在一定范围内呈现不规则的小幅波动;与正常对照组比,试验组NEUT数目在术后2周时明显升高(P< 0.05),LYM和RBC数目分别在术后1个月和1周时降低显著(P< 0.05),PLT数目在术后1~2周时明显升高(P< 0.01);同类产品对照组NEUT和PLT数目均在术后1周时升高显著(P< 0.01);各组其余各指标在其它时间点均无明显变化(P> 0.05);另外,试验组血液学指标与同类产品对照组比均无显著性差异(P> 0.05)(表3)。
2.4 对电解质和血凝指标的影响
试验组、同类产品对照组和正常对照组兔的血清Na、K、Cl、t-PA、PAI-1以及PAI-1/t-PA比值组间比较均无明显差异(P> 0.05)(表4)。
2.5 对兔脏器系数的影响
试验组、同类产品对照组和正常对照组兔术后6个月和12个月时的心、肝、脾、肺、肾、脑、胸腺、肾上腺、卵巢、子宫、睾丸和附睾等脏器系数组间比较均无明显差异(P> 0.05)(表5)。
3 讨论
当前LC术中因钛夹的导电性、对影像检查的干扰以及引起患者术后异物不适等缺点,使得目前对钛夹术后的风险性评估已受到广泛的关注。为寻找并克服钛夹的不足,临床和生物材料学者开展了多种方法的改进和材料的筛选,其中可吸收性止血夹和Hem-o-lok结扎夹产品的相应诞生,使得操作性、实用可靠性以及不受磁场作用等方面显示出较大的优势,为确保LC手术的安全性和可靠性提供了良好的保障;但是目前这些产品在当前LC术中仍以进口产品占主导地位,价格十分昂贵;另外,可吸收性止血夹由于是可降解材料,需低温冷藏,且不能夹闭10 mm以上的组织束,并对高血压患者的使用也受到限制,故在应用范围上受到一定的限制。故目前Hem-o-lok结扎夹在腹腔镜肾部分切除术、胆囊切除术等外科手术中被广泛的应用并受到临床认可[5-7]。本文研究的佳助结扎血管夹与Hem-o-lok结扎夹类似,均为人体不吸收的聚甲醛材料注塑而成,具有组织相容性好、非导电、可透X射线,对CT、MRI等检查不会产生伪影,具有安全锁扣和防滑齿、弓形钉腿、弹性合页等设计,结扎牢固且范围广,可承受800 mmHg的动脉压力,对高血压患者也可安全使用等优点。可见,该产品具有广泛的应用前景。本研究结果也证实,兔开腹行胆囊切除术后12个月佳助结扎血管夹和Hem-o-lok结扎夹均能牢固结扎胆囊管和胆囊动脉,未发生移位、胆漏和出血等发生,表明佳助结扎血管夹可用于LC术的应用是安全、可靠的。
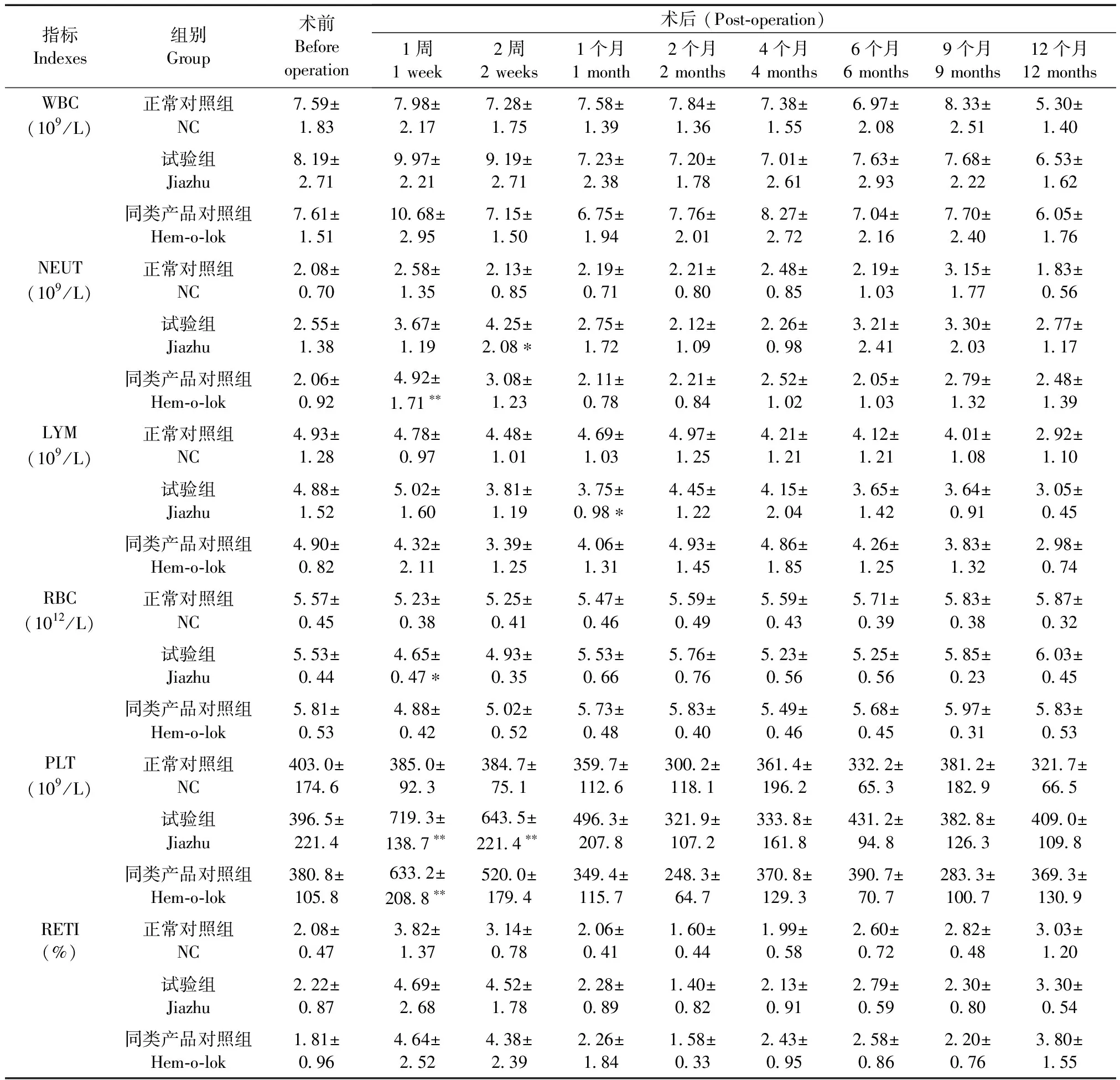
表3 各组兔血液学参数的变化
血液生化检测常用于评判肝、肾等重要脏器功能是否正常的客观而又灵敏的指标。研究表明,佳助结扎血管夹组和Hem-o-lok结扎夹组动物在术后前期1周内受手术影响出现ALT暂时性升高,食欲减少和体重降低的现象,这与临床腹腔镜手术后患者亦出现肝功能指标异常类似,其与术中肝脏的轻微损伤有一定的联系[8],此后动物食欲好转,体重也逐渐增加并呈正常增长模式,肝肾功能、电解质、糖脂代谢指标亦与正常动物无异,且术后均未见实验兔蜷缩疼痛、高度警惕、腹泻等不适反应。可见,佳助结扎血管夹对兔肝肾等脏器未造成明显的影响,其结果与Hem-o-lok结扎夹对兔肝、肾的安全性是基本一致的,预示佳助结扎血管夹对患者术后影响较少。
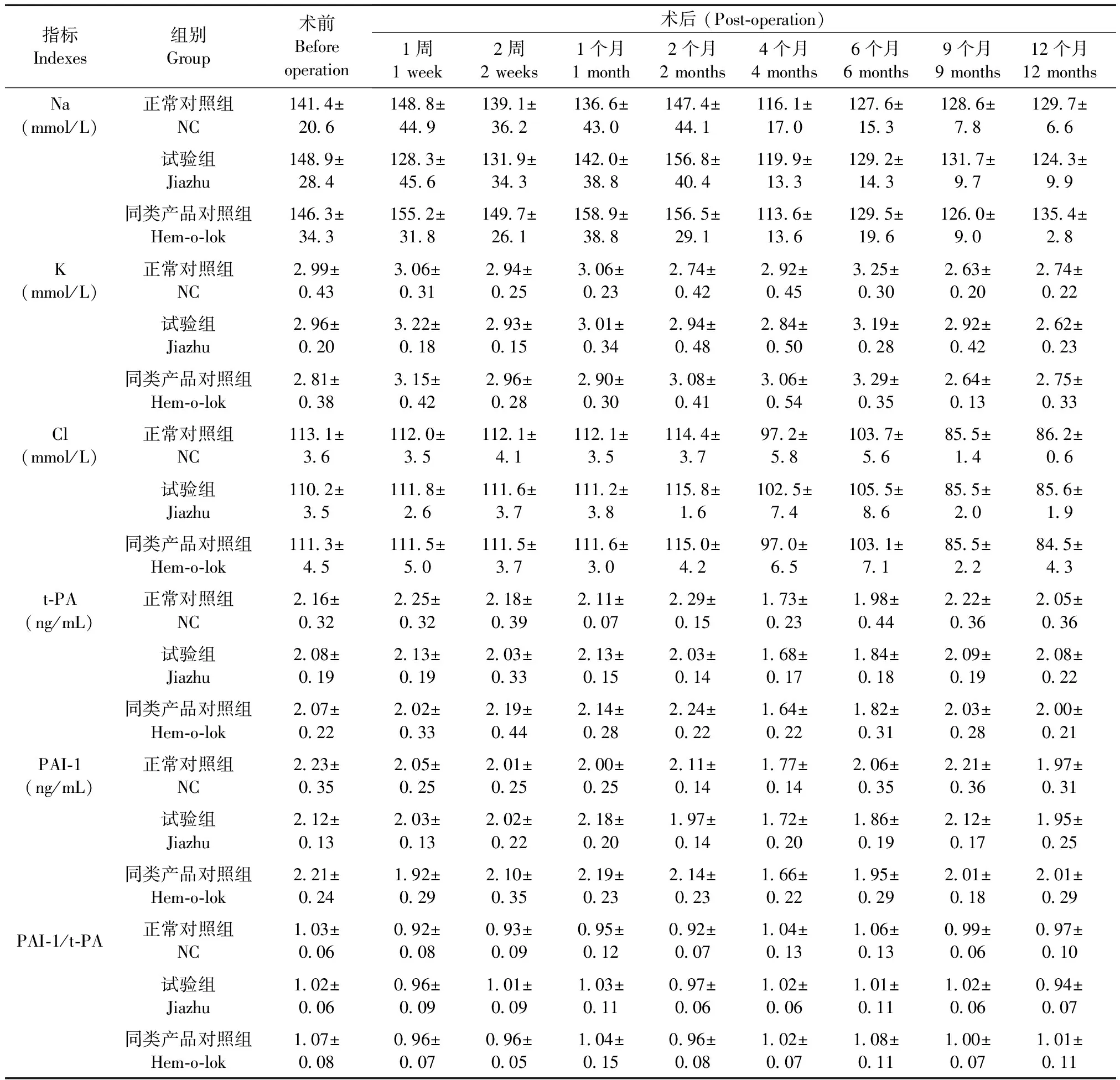
表4 各兔血清电解质和血凝指标的变化
众所周知,血液学指标不仅是病理生理和毒理评价以及探讨疾病发病机制等研究中重要的基础性评价指标,也是了解机体生理状态的重要依据。本研究结果显示,佳助结扎血管夹组和Hem-o-lok结扎夹组实验兔除术后1~2周出现轻微的中性粒细胞和血小板数目升高外,其它血液学参数均未见明显的变化并与正常动物无异,进一步表明佳助结扎血管夹具有较好的组织相容性、无血液毒性反应。纤溶系统是将血管内、外沉积的纤维蛋白溶解,保证血管通畅,防止血栓形成的一种重要防御机制。t-PA和PAI-1是体内调节纤溶系统功能的重要活性物质。生理情况下,t-PA与PAI-1之间的作用相互调节,维持了正常的血浆纤溶活性,对防止血液低凝、高凝状态至关重要[9]。一旦血液循环中PAI-1作用增强或t-PA作用减弱,则局部纤溶活性受抑,血液呈现高凝状态,容易诱发血栓形成[10-11]。本研究表明,佳助结扎血管夹组兔的t-PA、PAI-1含量及其PAI-1/t-PA比值与正常对照组和同类产品对照组均比无明显影响,表明佳助结扎血管夹对实验兔的纤溶系统无明显的影响。同时,肉眼组织大体观察和脏器系数测定分析亦显示,术后实验兔无伤口感染、未见脏器大小和病理性改变,夹闭区域亦未见结扎夹移位或滑脱发生,表明佳助结扎血管夹是安全和牢固可靠的。
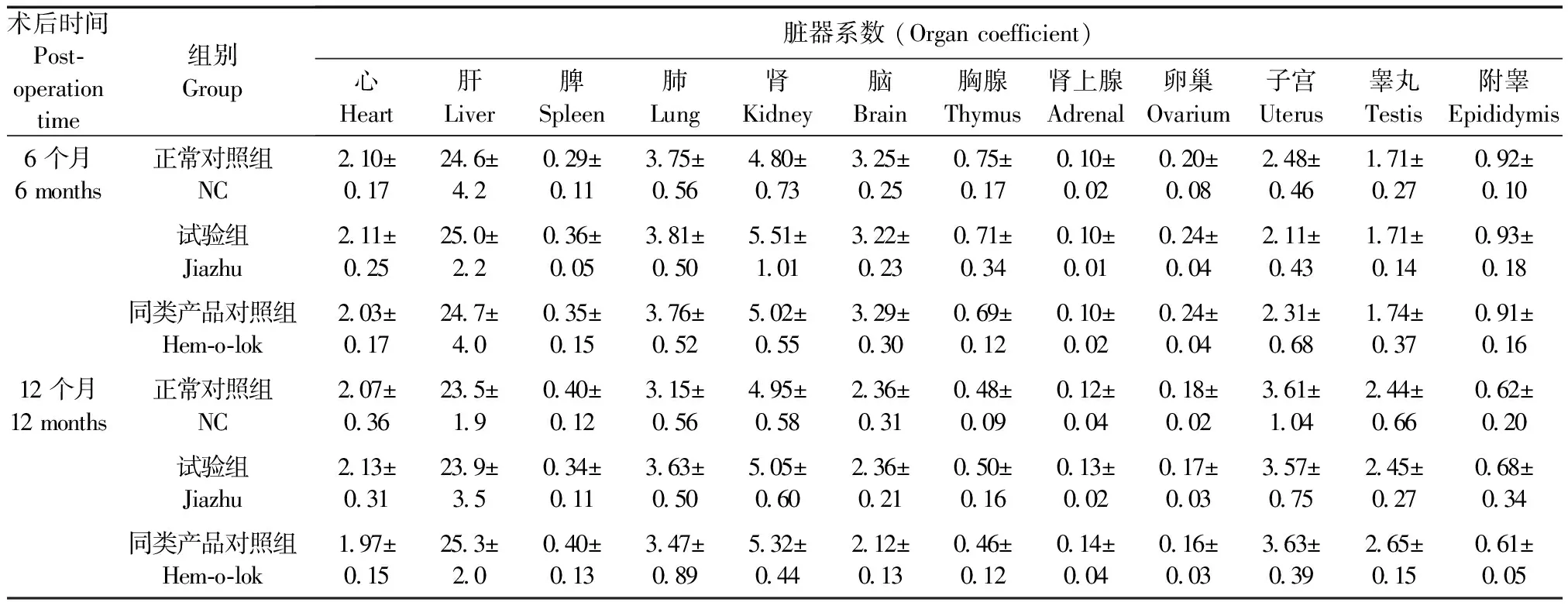
表5 术后6、12个月时兔脏器系数的变化
综上所述,佳助结扎血管夹可应用于夹闭胆囊管残端和血管是安全、可靠的,对肝肾功能等血液生化、凝血纤溶系统、脏器均未造成明显影响,其效果和安全性与Hem-o-lok结扎夹基本一致。
参考文献:
[1] 陈站斌,贾琪,刘金虎,等. 胆囊管结扎夹闭法在腹腔镜胆囊切除术中处理粗大胆囊管的应用体会(附104例报告)[J]. 中国微创外科杂志, 2012, 12(11):1051-1052.
[2] 刘国礼. 现代微创外科学[M]. 北京: 科学出版社, 2003, 133-135.
[3] 李和坤,钟复光,杨苏锦,等. 腹腔镜胆囊切除术后钦夹与可吸收夹留置体内影响的比较[J]. 中华普通外科志, 2000, 15(9):544-546.
[4] Aminian Ali, Khorgami Zhamak. Hem-O-Lok clip is safe in minimally invasive general surgery: a single center experience and review of data from food and drug administration [J]. J Minim Invasive Surg Sci, 2012, 1(2):52-57.
[5] Lee Z, Reilly CE, Moore BW,etal. Stone formation from nonabsorbable clip migration into the collecting system after robot-assisted partial nephrectomy [J]. Case Rep Urol, 2014, 1-3.
[6] Seyyedmajidi M, Hosseini SA, Hajiebrahimi S,etal. Hem-o-lok Clip in the first part of duodenum after laparoscopic cholecystectomy [J]. Case Rep Gastrointest Med, 2013, 1-3.
[7] 劳卫荣,邵子力,彭和平. Hem-o-lok结扎夹与钛夹在腹腔镜胆囊切除术中的比较[J]. 医学信息, 2009, 22(4):516-518.
[8] 周正东,陈训如,罗丁,等. 腹腔镜胆囊切除术后肝功能变化的原因[J]. 腹腔镜外科杂志,2001, 6(2): 83-84.
[9] Tsikouris JP, Suarez JA, Meyerrose GE. Plasminogen activator inhibitor-1: physiologic role, regulation and the influence of common pharmacologic agents [J]. J Clin Pharmacol, 2002, 42(11): 1187-1199.
[10] Binder BR,Christ G, Gruber F,etal. Plasminogen activator inhibitor 1: physiological and pathophysiological roles[J].News Physiol Sci, 2002,17:56-61.
[11] Buchwalter G, Gross C, Wasylyk B,etal. The ternary complex factor Net regulates cell migration through inhibition of PAI-1 expression[J]. Mol Cell Bio1,2005,25(24):10853-10862.

