艾塞那肽对新诊断2型糖尿病患者骨代谢的影响*
李任远, 邓洪容, 姚 麟, 林 硕, 童国玉, 曾龙驿, 朱大龙, 翁建平, 许 雯△
(中山大学附属第三医院 1内分泌与代谢病学科,广东省糖尿病防治重点实验室, 2医务科,广东 广州 510630; 3南京鼓楼医院内分泌科,江苏 南京 210000)
既往研究发现,2型糖尿病患者虽然骨密度不一定降低[1],但骨质量受损,导致脆性骨折风险增加以及骨折后骨质再生不充分[2]。同时,基础研究证实,成骨细胞内存在骨钙素(osteoclasin, OC)和胰岛素形成的正反馈调节环路[3-4]。血糖升高抑制成骨细胞的表达,减少OC的分泌[5];血糖控制后,血清OC水平升高,促进骨形成的发生。由此,2型糖尿病与骨质疏松症具相关性,但其中的机制尚不明确。
胰高糖素样肽1(glucagon-like peptide 1, GLP-1)受体激动剂是近年在临床应用的新一类降糖药物,在动物实验中发现GLP-1可促进骨合成[6-7],但这一结论尚未被临床研究所证实。因此,探讨艾塞那肽在改善血糖的同时,对2型糖尿病患者骨密度及骨转化标志物的影响有利于指导临床用药。
材 料 和 方 法
1 研究对象
2010年8月到2011年10月期间,中山大学附属第三医院和南京鼓楼医院(南京大学医学院附属医院),招募新诊断的2型糖尿病患者20名,均符合:(1)初次诊断的2型糖尿病患者(均符合1999年世界卫生组织的糖尿病诊断标准),既往从未接受降糖药物治疗;(2)年龄30~70岁;(3)糖化血红蛋白(hemoglobin A1c, HbA1c)7%~10%;(4)体重指数(body mass index, BMI)20~35 kg/m2,体重在接受筛选前至少3个月内稳定,波动≤10%;(5)育龄妇女在研究期内避孕;(6)已签署知情同意书。同时排除(1)急性或严重慢性糖尿病并发症;(2)存在骨质疏松病史,或既往病理性骨折病史,或目前正服用抗骨质疏松药物或可导致继发性骨质疏松的药物;(3)其它引起继发性骨质疏松的疾病;(4)既往有胰腺炎病史或甘油三酯≥5.0 mmol/L;(5)谷草转氨酶及谷丙转氨酶高于正常上限2.5倍和/或血清肌酐≥133 μmol/L(1.5 mg/dL);(6)使用影响体重、胃肠功能的药物、抗排斥药及其它试验药物;(7)嗜酒、妊娠。
2 方法
2.1给药方案 经知情同意后参与研究的患者完成基线检测后,予以患者GLP-1受体激动剂艾塞那肽注射液(百泌达®,Byetta®,Eli Lilly),初始用药5 μg bid 皮下注射;用药4周后加量为10 μg bid 皮下注射;每4周随访1次至24周,每次随访予以生活方式教育。若加量后患者出现低血糖事件,或出现频繁恶心、呕吐等胃肠道反应,可将剂量降至5 μg bid。完成24周治疗后重复基线检查。
2.2研究指标 患者隔夜空腹测量身高、体重、腰围和臀围,计算BMI;留取血清检测空腹血糖(fasting plasma glucose, FPG)、餐后2 h血糖(postprandial 2-hour blood glucose, PBG)、HbA1c、空腹胰岛素(fas-ting serum insulin, FINS)和主要生化指标,包括:甘油三酯、低密度脂蛋白、谷草转氨酶、谷丙转氨酶、肌酐、淀粉酶和脂肪酶水平,并计算HOMA胰岛素抵抗指数(homeostasis model assessment of insulin resis-tance,HOMA-IR)及HOMA胰岛功能指数(homeostasis model assessment of β cell function,HOMA-β);同时留取空腹血清检测OC以及骨吸收标志物Ⅰ型胶原交联羧基末端肽(C-telopeptide of type I collagen, CTX)和抗酒石酸酸性磷酸酶5b(tartrate-resistant alkaline phosphatase 5b,TRAcP5b);并行双能X线骨密度仪检测腰椎骨密度(bone mineral density, BMD)和体脂分布。
2.3研究指标检测方法 血糖采用葡萄糖氧化法检测,HbA1c采用HPLC高压液相检测,胰岛素采用电化学发光法检测,骨形成标志物及骨吸收标志物采用酶联免疫吸附法(IDS, UK)检测,骨密度和体脂分布采用双能X线骨密度仪测定。HOMA-IR=(FPG×FINS)/22.5, HOMA-β=(20×FINS)/(FPG-3.5)。
3 统计学处理
用SPSS 13.0软件分析。数据以均数±标准误(mean±SEM)表示。HOMA-IR及HOMA-β经对数转换后进行统计;各指标治疗前后差异比较使用配对样本t检验。以P<0.05为差异有统计学意义。
结 果
1 基线资料
20名新诊断2型糖尿病患者有13名男性及7名女性,入组时平均年龄(45.7±10.5)岁,平均糖化血红蛋白(8.4±1.0)%,20名患者基线指标均符合纳入及排除标准,见表1。
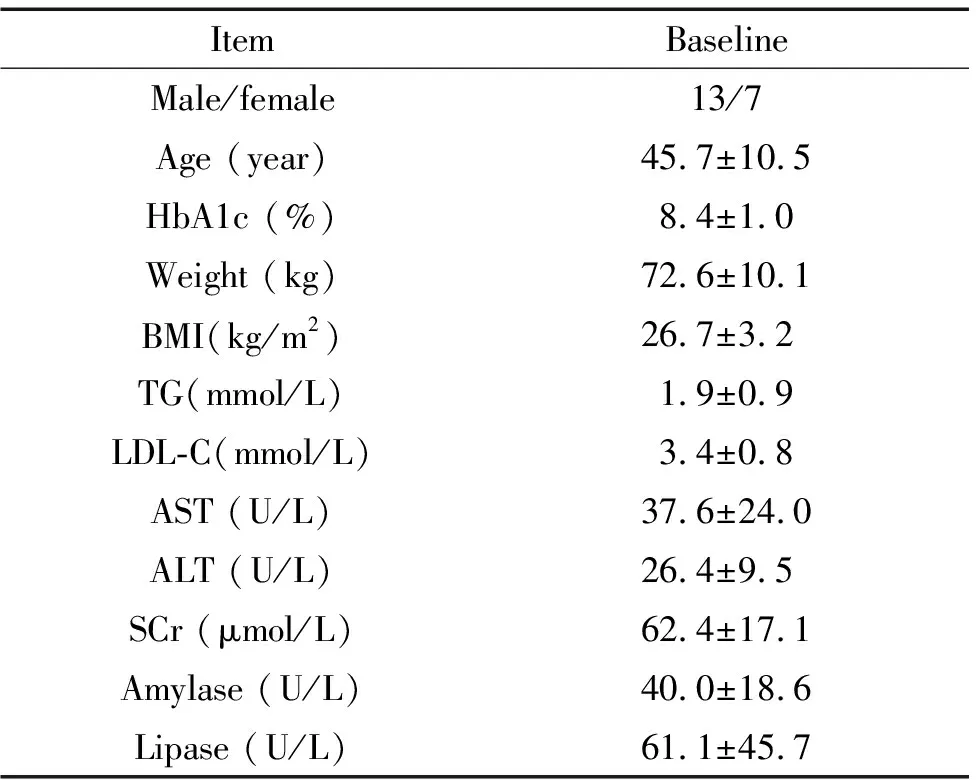
表1 患者基线资料
2 治疗前后血糖及胰岛功能的变化
艾塞那肽治疗24周后,患者FPG、PBG和HbA1c均明显改善(P<0.01),HOMA-IR较治疗前明显改善(P<0.05), HOMA-β变化无明显差异,见表2。
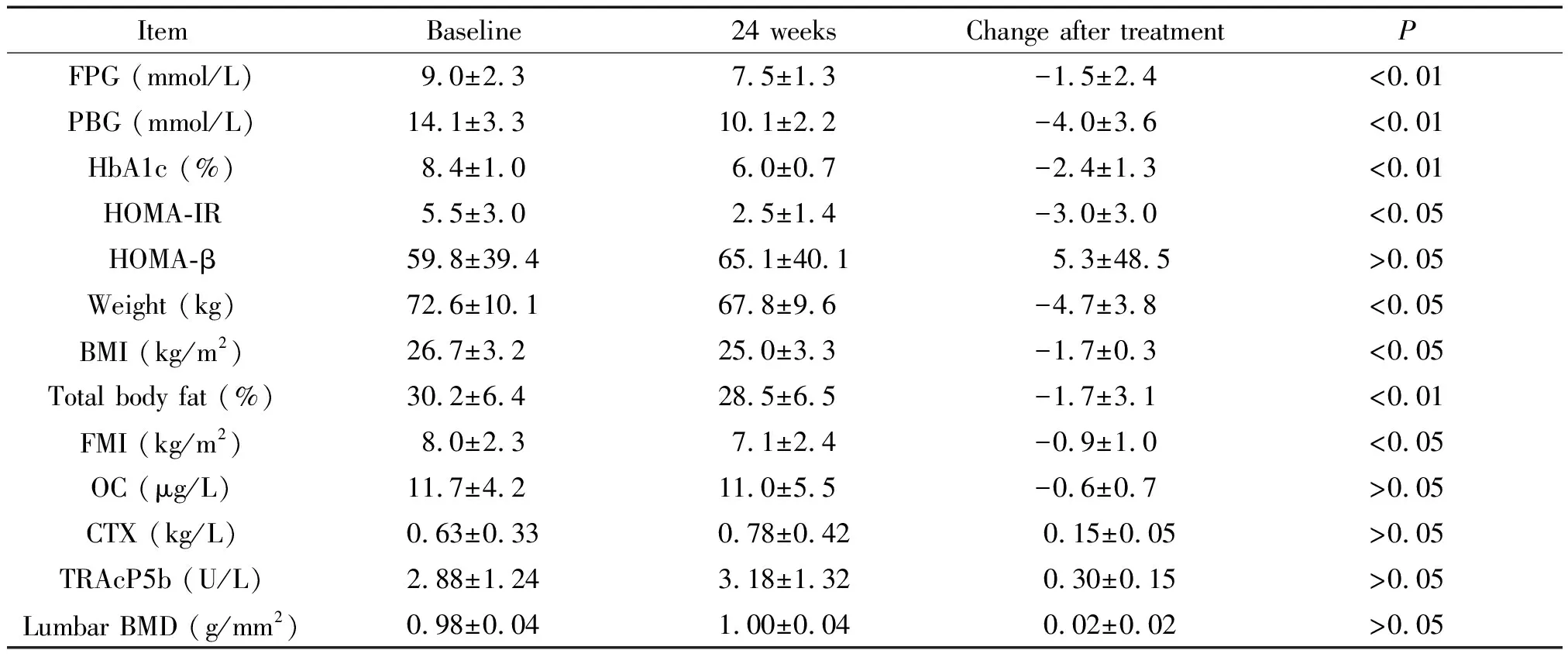
表2 基线及24周患者情况比较
3 治疗前后体重及体脂分布的变化
艾塞那肽治疗24周后,患者体重和BMI均明显下降(P<0.05);体脂分布结果显示,患者全身脂肪比和脂肪指数(fat mass index,FMI)均明显下降(P<0.05),见表2。
4 治疗前后骨转化标志物及骨密度的变化
艾塞那肽治疗24周后,患者OC呈下降趋势,CTX和TRAcP5b呈上升趋势,但是治疗前后的变化均未达统计学意义,骨密度的变化也未达统计学意义,见表2。
讨 论
2型糖尿病患者外周血GLP-1浓度明显下降[8]。而基础研究提示,GLP-1是促进骨合成的物质。GLP-1受体敲除的纯合子小鼠骨皮质减少,骨折脆性增加,骨破坏增多[9]。2型糖尿病大鼠模型的骨形成标志物OC较正常大鼠降低。GLP-1治疗3 d,OC表达增多,同时护骨素/核因子κB受体活化因子配基表达比例升高,提示GLP-1促进骨形成;应用显微CT (micro-CT)分析大鼠股骨骨小梁结构,发现2型糖尿病大鼠骨小梁结构受损,予以GLP-1可改善其结构[6]。艾塞那肽是GLP-1受体激动剂,通过多种作用机制发挥降糖作用[10],并具有改善胰岛素敏感性、保护胰岛β细胞功能、减轻体重和减少内脏脂肪的作用[11]。因此推测,艾塞那肽治疗2型糖尿病患者,可能在降糖的同时对骨代谢有改善作用。
本研究对新诊断2型糖尿病患者使用艾塞那肽治疗24周,采用了特异性代表骨转化情况的OC、CTX和TRAcP5b,并监测患者骨密度变化。研究结果显示,24周的艾塞那肽治疗后,OC、CTX、TRAcP5b及骨密度的变化未达到统计学意义的变化,但可见患者OC呈下降趋势,CTX和TRAcP5b呈上升趋势。我们知道,虽然骨转化标志物的改变仅需要3个月[12],但骨密度的变化一般需要6~12个月。因此,本研究未能证实艾塞那肽治疗24周具有促进骨合成的作用可能与治疗观察的时间较短有关。这与Bunck等[13]的一项临床研究结果相一致。在这项研究中,对2型糖尿病患者使用艾塞那肽联合二甲双胍治疗44周后,患者的血清碱性磷酸酶、血清钙、血清磷水平及骨密度在治疗后也未发生改变。
本研究与基础研究结果的不一致,可能与临床研究中存在其它导致骨形成减少的因素相关。体重及脂肪分布的改变可以导致骨形成减少,因此它们可能是重要的影响因素。既往文献证实,体重下降5~10%与骨密度降低、骨吸收增加相关,尤其在绝经后肥胖女性中更常见[14-15]。行胃缩减手术的肥胖患者,体重和全身脂肪下降伴随骨密度、骨转化标志物减少,维生素D代谢异常[16- 17]。加拿大骨质疏松指南也提出,体重明显下降是导致骨质疏松的危险因素[18]。与很多降糖药物不同,艾塞那肽在降糖同时可以减轻体重。但是在基础研究中,由于动物模型治疗时间短,体重未发生明显改变,而在本研究中,24周时患者体重平均下降4.7 kg,同时全身脂肪百分比及脂肪指数下降;在Bunck等[13]研究中,患者体重也平均下降3.5 kg。这提示,长期使用GLP-1受体激动剂或类似物,导致患者体重持续下降,可能对骨代谢产生负面影响。此外,既往研究提示正常啮齿目动物的甲状腺C细胞表达GLP-1受体[19],其通过促进降钙素分泌,抑制破骨细胞,减少骨吸收[20],从而改善骨代谢。而新近的研究发现,仅33%的正常人甲状腺C细胞表达GLP-1受体[21]。因此,GLP-1受体激动剂或类似物类药物对人类骨代谢的影响不仅与体重及脂肪分布改变相关,可能同时与患者甲状腺C细胞是否表达GLP-1受体相关。其长期效果仍需更多的临床研究进一步证实。
综上所述,本研究提示24周艾塞那肽治疗改善新诊断2型糖尿病患者的血糖和胰岛素抵抗,使体重及体脂含量下降,但未对胰岛β细胞功能产生影响。同时,24周艾塞那肽治疗未对OC、CTX、TRAcP5b和骨密度产生影响。与基础研究结果的不一致提示有必要进一步研究艾塞那肽对骨代谢的长期影响。鉴于本研究随访时间相对较短,我们将在后续的研究中,继续关注长期使用GLP-1受体激动剂对骨代谢的影响,进一步为2型糖尿病合并骨质疏松患者选择降糖药物及抗骨质疏松治疗提供依据。
[参 考 文 献]
[1] Isidro ML, Ruano B. Bone disease in diabetes[J]. Curr Diabetes Rev, 2010, 6(3):144-155.
[2] Achemlal L, Tellal S, Rkiouak F, et al. Bone metabolism in male patients with type 2 diabetes[J]. Clin Rheumatol, 2005, 24(5):493-496.
[3] Ferron M, Wei J, Yoshizawa T, et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism[J]. Cell, 2010, 142(2):296-308.
[4] Ng KW. Regulation of glucose metabolism and the skeleton[J]. Clin Endocrinol (Oxf), 2011, 75(2):147-155.
[5] Inaba M, Terada M, Koyama H, et al. Influence of high glucose on 1,25-dihydroxyvitamin D3-induced effect on human osteoblast-like MG-63 cells[J]. J Bone Miner Res, 1995, 10(7):1050-1056.
[6] Nuche-Berenguer B, Moreno P, Esbrit P, et al. Effect of GLP-1 treatment on bone turnover in normal, type 2 diabetic, and insulin-resistant states[J]. Calcif Tissue Int, 2009, 84(6):453-461.
[7] Nuche-Berenguer B, Moreno P, Portal-Nunez S, et al. Exendin-4 exerts osteogenic actions in insulin-resistant and type 2 diabetic states[J]. Regul Pept, 2010, 159(1-3):61-66.
[8] Vilsboll T, Krarup T, Deacon CF, et al. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients[J]. Diabetes, 2001, 50(3):609-613.
[9] Yamada C, Yamada Y, Tsukiyama K, et al. The murine glucagon-like peptide-1 receptor is essential for control of bone resorption[J]. Endocrinology, 2008, 149(2):574-579.
[10] Kolterman OG, Buse JB, Fineman MS, et al. Synthetic exendin-4 (exenatide) significantly reduces postprandial and fasting plasma glucose in subjects with type 2 diabetes[J]. J Clin Endocrinol Metab, 2003, 88(7):3082-3089.
[11] Nauck M, Frid A, Hermansen K, et al.Efficacy and safety comparison of liraglutide,glimepiride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study[J]. Diabetes Care, 2009, 32(1):84-90.
[12] 滕晓英,王连唐. 破骨细胞功能调控与骨质疏松症[J]. 中国病理生理杂志, 2002,18(8): 1012-1015.
[13] Bunck MC, Eliasson B, Corner A, et al. Exenatide treatment did not affect bone mineral density despite body weight reduction in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2011, 13(4):374-377.
[14] Jensen LB, Kollerup G, Quaade F, et al. Bone minerals changes in obese women during a moderate weight loss with and without calcium supplementation[J]. J Bone Miner Res, 2001, 16(1):141-147.
[15] Riedt CS, Cifuentes M, Stahl T, et al. Overweight postmenopausal women lose bone with moderate weight reduction and 1 g/day calcium intake[J]. J Bone Miner Res, 2005, 20(3):455-463.
[16] Carrasco F, Ruz M, Rojas P, et al. Changes in bone mineral density, body composition and adiponectin levels in morbidly obese patients after bariatric surgery[J]. Obes Surg, 2009, 19(1):41-46.
[17] Holecki M, Zahorska-Markiewicz B, Chudek J, et al. Changes in bone mineral density and bone turnover markers in obese women after short-term weight loss therapy during a 5-year follow-up[J]. Pol Arch Med Wewn, 2010, 120(7-8):248-254.
[18] Papaioannou A, Morin S, Cheung AM, et al. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary[J]. CMAJ, 2010, 182(17):1864-1873.
[19] Waser B, Beetschen K, Pellegata NS, et al. Incretin receptors in non-neoplastic and neoplastic thyroid C cells in rodents and humans: relevance for incretin-based diabetes therapy[J]. Neuroendocrinology, 2011, 94(4):291-301.
[20] Bollag RJ, Zhong Q, Phillips P, et al. Osteoblast-derived cells express functional glucose-dependent insulinotropic peptide receptors[J]. Endocrinology, 2000, 141(3):1228-1235.
[21] Gier B, Butler PC, Lai CK, et al. Glucagon like peptide-1 receptor expression in the human thyroid gland[J]. J Clin Endocrinol Metab, 2012, 97(1):121-131.

