siArid2重组腺病毒载体的构建及其对肝癌细胞增殖的影响*
段玉洁, 聂丽珠, 田 玲, 李 治, 陈 震, 唐 霓
(重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400016)
Arid2 是近年来新发现的一个抑癌基因,定位于第12对染色体的长臂上,包含21个外显子[1],其编码的蛋白是PBAF(polybromo-associated BRG1-associated factor)复合物的一种特有亚基,而PBAF是一种依赖ATP酶的染色质重塑复合物,可以通过水解ATP获得的能量, 改变组蛋白与核小体之间的相互作用,调控细胞的增殖和分化过程。
Arid2蛋白结构分为N端富含保守AT的结构域,RFX型翼状螺旋DNA结合域,富含脯氨酸、甘氨酸的结构域以及C端2个保守锌指结构域[2]。人类Arid家族包含15个成员,可分为7个亚家族:Arid1~5、JArid1和JArid2[3]。研究表明Arid家族的突变失活与人类多种肿瘤如肝细胞癌(hepatocellular carcinoma, HCC)、黑色素瘤、非小细胞型肺癌以及头颈部癌等的发生发展密切相关[4]。据统计,在丙型肝炎病毒(HCV)感染相关的HCC中,约18.2%的HCC组织标本存在Arid2 的失活突变。
研究表明Arid2等组成的蛋白复合物SWI/SNF具有肿瘤抑制作用,被认为是一类肿瘤抑制因子或抑癌基因,可能通过以下途径发挥作用:(1)调控IFN信号通路,调节宿主的免疫应答;(2)调控pRb信号通路下游靶基因,抑制细胞增殖;(3)调控细胞骨架蛋白、跨膜糖蛋白CD44等参与调控细胞的迁移与侵袭力[5]。Arid2的生物学功能尚不明确,其在肿瘤发生发展特别是肝细胞肝癌中的作用目前知之甚少。
小干扰RNA(small interfering RNA,siRNA)是含有21~23个碱基的单链或双链RNA,能够高效、特异地与目标mRNA位点结合,促使同源mRNA降解,从而特异地下调甚至沉默目标基因的表达[6]。本研究运用小干扰RNA技术构建沉默Arid2 的重组质粒,并将质粒包装成腺病毒[7],通过体外实验初步分析该基因的功能,为今后的实验研究奠定基础。
材 料 和 方 法
1 材料
1.1质粒、细胞 pSES-1穿梭质粒载体、BJ5183菌株及其衍生物AdEasy-1细胞、腺病毒骨架质粒pAdEasy-1和含有无关序列(scrambled)的siRNA腺病毒Adsicontrol均由美国芝加哥大学分子肿瘤实验室HE Tong-chuan教授惠赠;人肾上皮细胞HEK293和人肝癌细胞SMMC-7721为本实验室保存;HEK293细胞培养在含10%胎牛血清和1%双抗(青霉素+链霉素)的DMEM培养基,SMMC-7721细胞培养在含有10%胎牛血清和1%双抗(青霉素+链霉素)的1640培养基中。
1.2主要试剂 限制性内切酶HindIII、KpnI和SfiI购于New England Biolabs;T4 DNA连接酶和质粒小量提取试剂盒购于Promega;DNA marker购于TaKaRa;转染试剂Lipofectamine 2000购于Invitrogen;蛋白定量试剂盒购于碧云天公司;Arid2单克隆抗体(兔)购于Santa Cruz;鼠抗IgG-HRP、山羊抗兔多克隆Ⅱ抗IgG购于Abcam;ECL发光试剂购于Millipore;胎牛血清购自Gibco;双抗(青霉素+链霉素)、DMEM和1640培养基购自Hyclone。
2 方法
2.1siArid2腺病毒穿梭质粒的构建 根据PubMed公布的Arid2基因序列设计3对siRNA,见表1,将3对正、反义链引物按照1:3稀释,分别等比例混匀后,沸水煮沸10 min,自然冷却至室温以便形成发夹式结构的双链DNA。用限制性内切酶SfiⅠ酶切载体pSES-1使其线性化,用T4 DNA连接酶将上述引物与线性化的载体连接,电转入感受态菌DH5α中,铺板后置于37 ℃孵箱中过夜。挑取阳性单克隆菌落,提取质粒后送华大基因进行测序分析,测序结果成功获得重组质粒psiArid2-1、psiArid2-2和psiArid2-3。
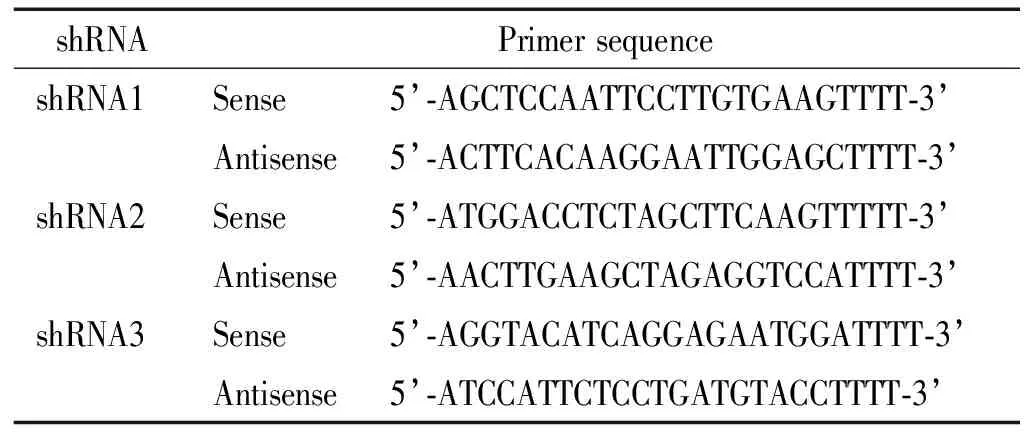
表1 引物序列
2.2siArid2腺病毒的构建 将重组质粒psiArid2-1、psiArid2-2和psiArid2-3分别用限制性内切酶PmeI酶切,使其线性化,再电转入腺病毒同源穿梭质粒BJ-AdEasy中,电转产物涂于含100 mg/L卡那霉素的LB平板上,于37 ℃孵箱中孵育过夜,在LB平板上挑取约20个偏小的单克隆菌,接种于 4 mL 含100 mg/L卡那霉素的LB培养液中,37 ℃摇床过夜培养。用碱裂解法小量抽提质粒,将提取的质粒在0.8%琼脂糖凝胶电泳,根据质粒大小筛选出阳性克隆质粒pAdsiArid2-1~3。将上述质粒电转入感受态菌E.coliDH5ɑ中扩大培养,将提取的重组腺病毒质粒进一步用限制性内切酶PacⅠ进行酶切鉴定。
2.3重组腺病毒的包装扩增 用小量抽提试剂盒提取pAdsiArid2-1~3质粒,PacⅠ酶切后无水乙醇沉淀法纯化。用3 mL无血清培养基轻轻洗涤HEK293细胞,吸去培养基,再加入2.5 mL无血清的DMEM培养基,置于37℃、5%CO2湿度孵箱中。将13 μL脂质体,3 μg AdEasy-siArid2质粒和250 μL无血清的DMEM培养基混匀,室温静置15~17min后加入到培养基中,轻轻混匀,于37 ℃、5%CO2湿度孵箱中孵育4 h。吸去转染液,加入7 mL含10%胎牛血清的完全培养基继续培养。48 h后在荧光显微镜下观察荧光情况。转染成功后约10~15 d,收取含病毒的上清,用约1/2的量继续感染293细胞,进行新的一轮病毒扩增,重复扩增4~5次后获得滴度较高的重组腺病毒,保存至-80℃。
2.4siArid2腺病毒的鉴定和效率测定 将SMMC-7721细胞以每孔40%的密度接种于24孔培养板中,设置6个复孔。将3种重组腺病毒以10 μL为初始量按1/2等比减量后依次加入6个孔中,即相应的6个孔中所加入的腺病毒量为10μL、5μL、2.5μL、1.25μL、0.75μL和0.37μL)。显微镜下观察细胞生长状态以及荧光强弱,选择细胞状态良好、荧光强度适中的孔所对应的病毒量作为重组腺病毒的最适滴度。将4×105SMMC-7721细胞接种于10 cm培养皿中,待细胞贴壁后分别感染最适滴度的重组腺病毒AdsiArid2-1、AdsiArid2-2、AdsiArid2-3以及对照腺病毒Adsicontrol。病毒感染后48 h分别提取总蛋白,并用BCA法测定其蛋白浓度。取50 μg蛋白,经10% SDS-PAGE分离后,转移到PVDF膜上。5%脱脂奶粉室温封闭1 h。按照抗体说明书将膜孵以最适稀释度的Arid2抗体,4 ℃ 孵育过夜。TBST洗膜40 min后,加入1∶5 000稀释的羊抗兔Ⅱ抗室温孵育1 h。TBST洗膜后,加入ECL发光试剂,用ImageJ 2X灰度比对软件分析各组Arid2的表达情况。实验重复5次。
2.5MTS法检测SMMC-7721细胞的生长 将4×105SMMC-7721细胞接种于10 cm培养皿中,待细胞贴壁后分别感染最适滴度的重组腺病毒Adsicontrol和AdsiArid2,同时设置空白对照组。病毒感染后12 h,将上述细胞以4×103/well密度重铺于96孔培养板中,每组设3个复孔,分别于铺板后24 h、48 h、72 h、96 h和120 h向每孔加入20 μL MTS反应液,轻轻混匀,于37 ℃、5%CO2孵箱中避光静置2 h,检测各时点的吸光度(A490)。实验重复3次。
2.6流式细胞仪检测细胞周期 将2×104SMMC-7721细胞接种于6 cm培养皿中,待细胞贴壁后分别感染最适滴度的重组腺病毒Adsicontrol和AdsiArid2,同时设置空白处理组作为对照。病毒感染后12 h,更换新鲜的细胞培养基,72 h后弃去培养基,并用预冷的PBS洗涤细胞2次,加入75%的乙醇轻轻重悬收集细胞。-20 ℃固定细胞24 h,取等体积的碘化丙啶染液与细胞悬液混合后,4 ℃静置30 min,通过流式细胞仪检测细胞周期。实验重复3次。
3 统计学处理
每种实验均进行至少3次独立重复实验。用SPSS 19.0统计软件分析实验结果。数据均采用均数±标准差(mean±SD)表示,各组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 siArid2腺病毒重组质粒的构建和鉴定
将构建好的3个重组质粒psiArid2-1~3电转入BJ-AdEasy感受态细胞,挑取转化菌落进行摇菌,提取质粒DNA。由于腺病毒的同源重组可以发生在穿梭质粒AdEasy-1的ori区域之间或者其左臂上,这2种重组方式导致限制性内切酶PacI酶切后会产生3.0 kb或4.5 kb的片段。用PacI 酶切后2号、5号和8号重组菌落出现约4.5 kb DNA条带,表明腺病毒重组质粒构建成功,见图1。
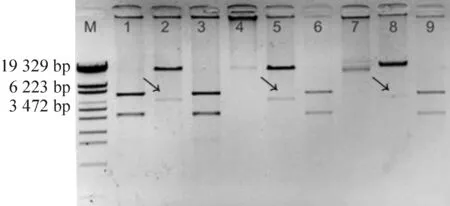
Figure 1. Identification of recombinant adenoviruses by Pac I digestion.Three of the 9 potential clones released a 4.5-kb fragment after Pac I digestion(Lane 2,Lane 5 and Lane 8).M: DNA marker 2000.
2 siArid2重组腺病毒的构建
将已构建好的pAdsiArid2-1~3重组质粒用脂质体法分别转染HEK293细胞,48 h后在荧光显微镜下观察细胞的感染情况。在转染后7 d,上述细胞中均可见明显的红色荧光,且呈现腺病毒包装过程中出现的典型“彗星状”荧光,随着转染天数的增加,荧光强度增强,约转染后10 d,部分细胞由贴壁转为漂浮,大约14 d后,收集含病毒颗粒的上清,见图2。
3 鉴定重组干扰腺病毒的抑制效率
将SMCC-7721细胞分别感染重组腺病毒AdsiArid2-1~3,并设置空白对照组和Adsicontrol组,细胞感染后48 h收集总蛋白,行Western blotting实验检测Arid2蛋白的表达水平,实验重复5次。结果显示:以GAPDH为内参照,AdsiArid2-1组的灰度比值为0.749±0.020,AdsiArid2-2的灰度比值为0.473±0.028,AdsiArid2-3的灰度比值为0.415±0.017,空细胞(mock)和Adsicontrol组的灰度比对值分别为0.772±0.031、0.783±0.018。统计分析显示,mock组与Adsicontrol组的Arid2表达量无明显差异,与Adsicontrol组相比,AdsiArid2-2和AdsiArid2-3对Arid2的表达均有明显抑制作用(P<0.05),其中以AdsiArid2-3的抑制作用更强,而AdsiArid2-1的抑制作用不明显(P>0.05)。以上结果表明AdsiArid2-3沉默Arid2表达的效果最好。因此,在后续MTS和细胞周期实验中选择AdsiArid2-3作为实验组,见图3。
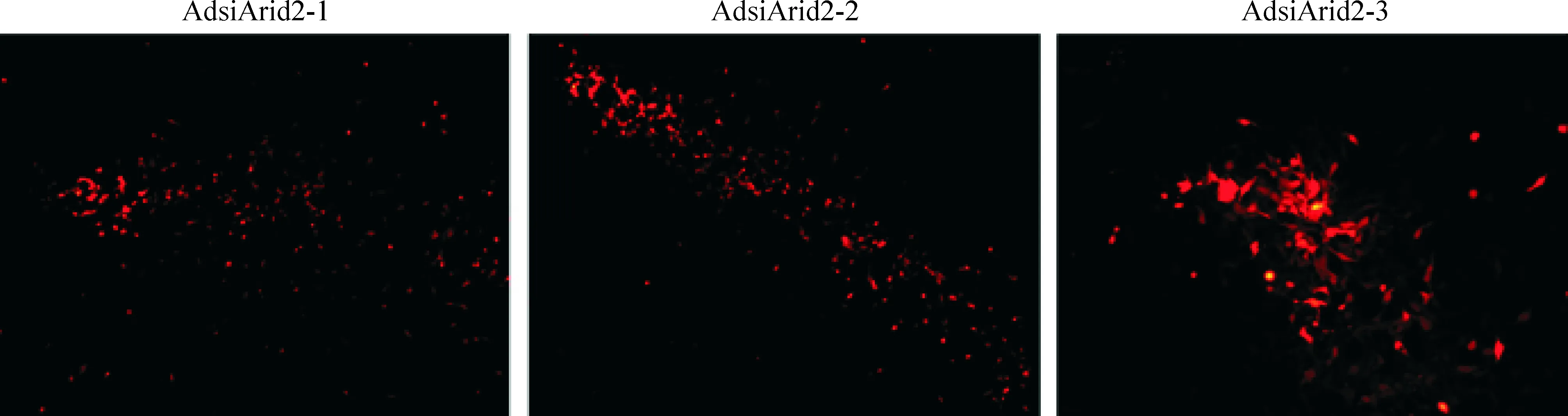
Figure 2. Package of recombinant adenoviruses in HEK293 cells.Transfected HEK293 cells were observed under fluorescence field at 10 d(×400).

Figure 3. Arid2 protein expression in SMCC-7721 cells transfe-cted with Adsicontrol,AdsiArid2-1, AdsiArid2-2 and AdsiArid2-3.Mean±SD.n=5.*P<0.05 vs Adsicontrol group; #P<0.05 vs mock group.
4 siArid2对于SMCC-7721细胞增殖活性的影响
MTS结果显示,AdsiArid2组在72 h和96 h的吸光度值分别为1.13±0.05和1.23±0.04,mock组72 h和96 h的吸光度值分别为0.92±0.03和1.07±0.08,Adsicontrol组72 h和96 h的吸光度值分别为0.91±0.01、1.03±0.02。通过以上数值可以看出AdsiArid2组在72 h和96 h的吸光度值与对照组相比明显增高,差异有统计学意义(P<0.05),说明沉默Arid2基因的表达可以促进肝癌细胞的增殖,见图4。
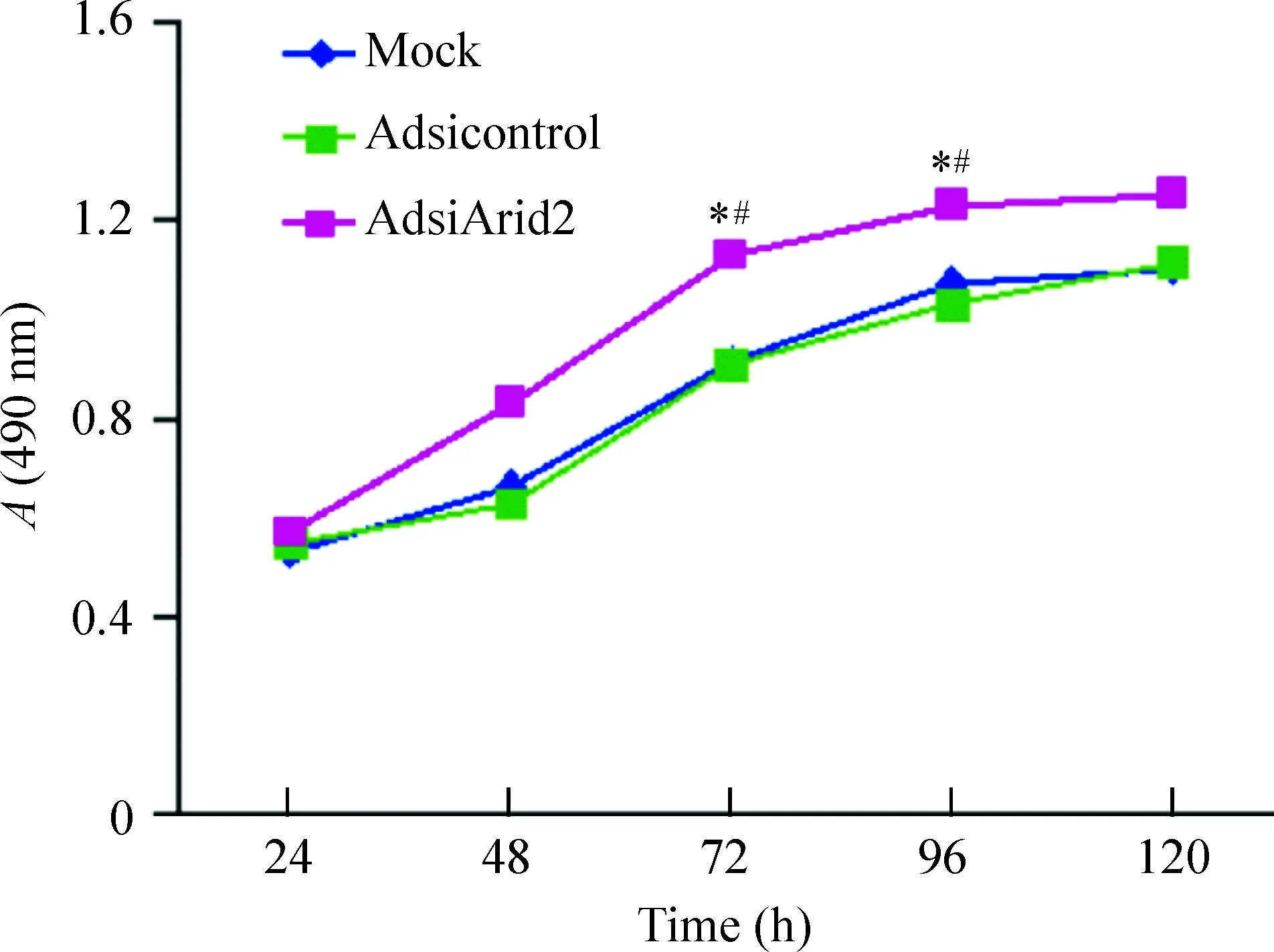
Figure 4. The effects of recombinant adenovirus on the proliferation of SMMC-7721 cells.Mean±SD.n=3. *P<0.05 vs Adsicontrol group;#P<0.05 vs mock group.
5 siArid2对于细胞周期的影响
流式细胞术的分析结果显示,感染腺病毒72 h后,AdsiArid2组SMMC-7721细胞处于G1期和S期的百分比分别为55.67%±0.38%和31.93%±0.38%;mock组处于G1期和S期细胞百分比分别为63.57%±2.90%和24.75%±2.53%;而Adsicontrol组处于G1期和S期细胞百分比分别为66.02%-2.13%和24.37%±1.91%。从以上数值可以看出,感染AdsiArid2腺病毒组,SMMC-7721细胞G1期缩短,S期延长,细胞处于活跃增殖状态,细胞周期进程加快,见图5。
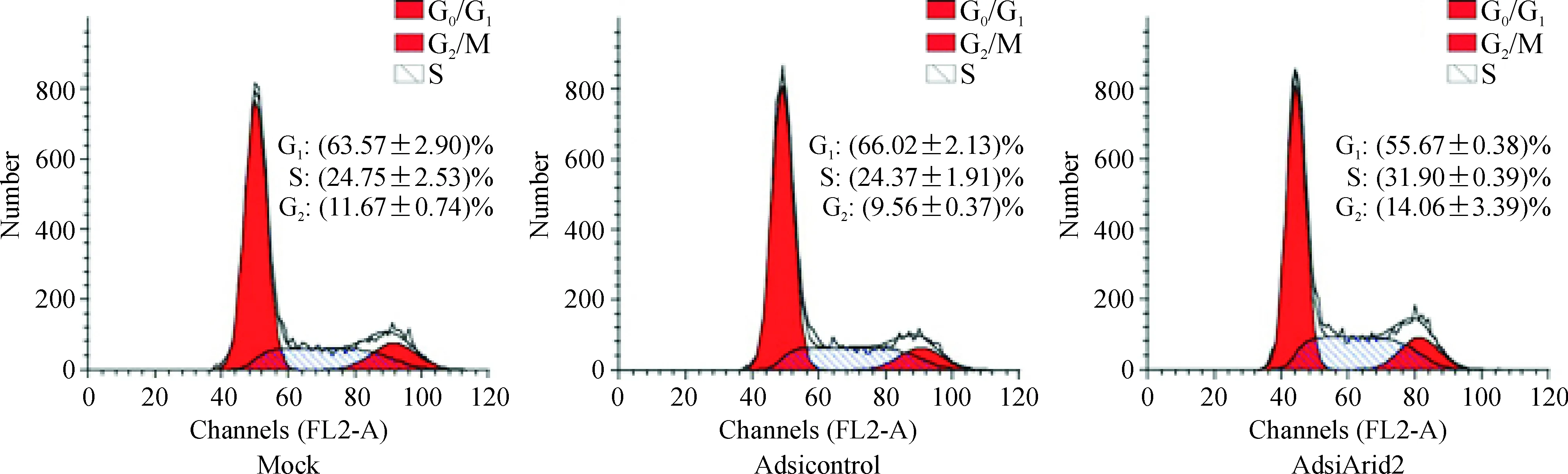
Figure 5. The percentage of cell phase.Mean±SD.n=3. *P<0.05 vs Adsicontrol group.
讨 论
HCC是全球最常见的十大恶性肿瘤之一,在我国,肝癌死亡率已居癌症死亡率的第二位[1]。癌症的发生发展是一个多因素作用的过程,包括细胞分子信号转导通路的激活、原癌基因与抑癌基因的失衡以及肿瘤干细胞的分化等。其中抑癌基因的失活一直在癌症研究中受到重视[8]。
Arid2,存在于PBAF复合物中,而PBAF复合物是SWI/SNF复合物的一种类型。SWI/SNF复合物是一种ATP依赖的染色质重塑复合物,它可以利用催化ATP水解释放的能量改变组蛋白与DNA之间的相互作用来调整染色质的结构,这对于转录活动的顺利进行具有重要意义[9]。功能学研究显示,Arid2是PBAF复合物中唯一的短半衰期转录因子,通过小干扰RNA抑制Arid2的表达可以降低PBAF复合物中其它蛋白的表达[10]。Arid2被发现在肝细胞癌、黑色素瘤、多发性骨髓瘤、非小细胞肺癌和乳腺癌中均存在不同程度的突变[11-13],其中在丙型肝炎病毒相关的HCC中存在3种形式的突变:移码突变、无义突变和剪接位点突变[1]。Arid2的突变失活能否影响肝癌的发生和发展过程,可能发挥作用的机制,目前的认识与研究都知之甚少。因此本研究旨在通过小干扰RNA技术构建siArid2的重组腺病毒,初步观察其对于细胞生长及细胞周期的影响,为之后更加深入地研究Arid2的抑癌机制提供重要的前期工作基础。
通过分析Arid2编码区序列,我们设计了3段编码区的siRNA片段,分别构建3个siArid2的重组质粒,并进一步构建了其重组腺病毒,且通过Western blotting我们筛选出了抑制效果最明显的重组腺病毒AdsiArid2-3。将该腺病毒感染体外培养的SMMC-7721细胞后,在72 h和96 h时细胞的吸光光度值(A值)较对照组显著增加,说明沉默Arid2的表达可以促进肝癌细胞的生长。Arid2参与调控细胞增殖的具体机制尚不明确。有研究表明,Arid家族其它成员如Arid1A、Arid1B可以通过与E2F-Rb信号通路相关分子相互作用调控细胞周期进程,从而参与调节细胞的生长与增殖[14]。细胞周期分为G0/G1、G2、S和M四个周期,各期都存在关键的检测点,例如G1/S和G2/M检测点。各检测点功能正常可以保证细胞周期顺利进行。其中,G1/S检测点在细胞周期进程中起关键作用,决定细胞周期能否启动进行细胞增殖[15-17]。通过流式细胞学分析,SMCC-7721细胞在感染重组腺病毒AdsiArid2后,G0/G1期细胞百分比减少,S期细胞百分比增加,与对照组相比有统计学差异,提示Arid2有可能通过调控肝癌细胞的细胞周期,从而抑制肝癌细胞的增殖。
综上所述,本实验成功构建了沉默Arid2表达的重组腺病毒,初步观察了Arid2对肝癌细胞生物学功能的影响,对于Arid2是如何调控肝癌细胞的生物学功能及其相关的分子机制,还需进一步深入研究。
[参 考 文 献]
[1] Zhao H, Wang J, Han Y, et al.ARID2: a new tumor suppressor gene in hepatocellular carcinoma[J]. Oncotarget, 2011, 2(11):886-891.
[2] Shain AH, Pollack JR. The spectrum of SWI/SNF mutations, ubiquitous in human cancers[J].PLoS One, 2013, 8(1):e55119.
[3] Cajuso T, Hänninen UA, Kondelin J, et al. Exome sequencing reveals frequent inactivating mutations inARID1A,ARID1B,ARID2 andARID4Ain microsatellite unstable colorectal cancer[J]. Int J Cancer, 2014, 135(3):611-623.
[4] Manceau G, Letouzé E, Guichard C,et al. Recurrent inactivating mutations ofARID2 in non-small cell lung carcinoma[J]. Int J Cancer, 2013, 132(9):2217-2222.
[5] Oike T, Ogiwara H, Nakano T, et al. Inactivating mutations in SWI/SNF chromatin remodeling genes in human cancer[J]. Jpn J Clin Oncol, 2013, 43(9):849-855.
[6] Wilkins C, Dishongh R, Moore SC, et al. RNA interference is an antiviral defence mechanism inCaenorhabditiselegans[J]. Nature, 2005, 436(7053):1044-1047.
[7] Luo J, Deng ZL, Luo X, et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J]. Nat Protoc, 2007, 2(5):1236-1247.
[8] Hodis E, Watson IR, Kryukov GV,et al.A landscape of driver mutations in melanoma[J]. Cell,2012, 150(2):251-263.
[9] Gangaraju VK, Bartholomew B. Mechanisms of ATP dependent chromatin remodeling[J]. Mutat Res, 2007, 618(1-2):3-17.
[10]Wu JI. Diverse functions of ATP-dependent chromatin remodeling complexes in development and cancer[J]. ActaBiochim Biophys Sin (Shanghai), 2012, 44(1):54-69.
[11]Shain AH, Giacomini CP, Matsukuma K, et al. Convergent structural alterations define SWItch/Sucrose NonFermentable (SWI/SNF) chromatin remodeler as a central tumor suppressive complex in pancreatic cancer[J]. Proc Natl Acad Sci U S A, 2012, 109(5):E252-E259.
[12]Ho L, Ronan JL, Wu J, et al. An embryonic stem cell chromatin remodeling complex, esBAF, is essential for embryonic stem cell self-renewal and pluripotency[J]. Proc Natl Acad Sci U S A, 2009, 106(13):5181-5186.
[13]Biankin AV, Waddell N, Kassahn KS,et al.Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes[J]. Nature, 2012, 491(7424):399-405.
[14]Blais A, Dynlacht BD. E2F-associated chromatin modifiers and cell cycle control[J]. Curr Opin Cell Biol, 2007, 19(6):658-662.
[15]秦瑞英,夏永华,任艳芳. AEG-1表达下调对人宫颈癌细胞细胞周期和侵袭能力的影响及其机制[J]. 中国病理生理杂志,2013, 29(6):1020-1024.
[16]杨 英,付士波,鞠桂芝. siRNA沉默P21表达对细胞周期解偶联和细胞凋亡的影响[J]. 中国病理生理杂志, 2007, 23(2):209-212.
[17]廖 刚,王子卫,张 能,等. 人表皮生长因子受体显性负性突变体诱导胃癌细胞发生G0/G1期阻滞[J]. 中国病理生理杂志, 2013, 29(3):430-435.

