NOD8对H2O2诱导的人肝细胞凋亡的影响*
郑媛媛, 杨文欣, 周 晗, 胡巢凤
(暨南大学医学院病理生理学系,国家中医药管理局病理生理实验室,广东 广州 510632)
细胞凋亡是一系列信号分子精密调控的程序性死亡过程,由特定基因控制的细胞自主、有序的死亡。研究证实,氧化应激通过影响相关酶类的功能,破坏细胞膜完整性,干扰细胞的稳态,从而引起细胞的凋亡,甚至坏死。H2O2作为一种氧化剂,干扰细胞信号转导,诱导细胞凋亡[1]。
近年研究发现NOD样受体(NOD-like receptors, NLRs)为胞浆内的模式识别受体,目前在人类已发现20多个NLRs家族成员,主要含有3个结构域,分别为一个C末端富含亮氨酸的重复序列、位于中央的核苷酸结合位点和N末端的效应结构域。而NOD8 (也称为PYNOD) 与之不同的是C末端缺乏作为配体识别区域的富含亮氨酸的重复序列,N末端为PYD结构域以及位于中央的核苷酸结合位点[2-5]。Imamura等[6]研究发现NOD8可抑制凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)介导的NF-κB的活化和细胞凋亡,但其抗凋亡机制尚不清楚。Caspase-3作为凋亡效应蛋白在凋亡信号转导通路中具有重要作用。为进一步探讨NOD8在细胞凋亡中的作用, 本研究主要观察NOD8对H2O2诱导人肝细胞L02凋亡的影响及可能机制。
材 料 和 方 法
1 细胞、质粒与主要试剂
人肝细胞L02由中山大学惠赠;pEGFP-C2为本室保存;pEGFP-NOD8真核表达质粒由本课题组构建。
DMEM细胞培养基、PBS、含0.25% EDTA的胰酶为Gibco产品;胎牛血清购自BI;细胞转染所用的阳离子聚合物JetPRIME为Polyplus产品; Annexin V-PE/7-AAD和caspase-3活性检测试剂盒购自Biovision;BCA蛋白定量试剂盒为上海申能博彩生物公司产品;NOD8多克隆抗体购自Santa Cruz;HRP标记的兔Ⅱ抗购自CST;Hoechst 33342、硝酸纤维素膜(Millipore)、滤纸、考马斯蓝R-250、Tween-20、牛血清白蛋白、脱脂奶粉和SDA-PAGE试剂盒均购自碧云天公司;其它生化试剂均为分析纯产品。
2 主要实验方法
2.1MTT法检测不同浓度H2O2对细胞活性的影响 将L02细胞以1×104cells/well 铺于96孔板,每组设6个复孔,并设与实验平行的本底对照孔,分别加入0.2、 0.4、 0.6、0.8、1和2 mmol/L 浓度的H2O2。6 h后每孔加入20 μL质量浓度为5 g/L的MTT溶液,置于37 ℃、5%CO2培养箱继续孵育4 h后,弃孔内液体,每孔加入150 μL DMSO振荡10 min,待蓝色颗粒完全溶解后,酶标仪 (Thermo Scientific) 检测波长为570 nm的吸光度值(Avalue)。
2.2L02细胞培养及重组质粒转染细胞 采用10%胎牛血清的DMEM高糖培养液培养,并加入1×105U/L 青霉素和 100 mg/L 链霉素,在37 ℃、5% CO2条件下进行细胞培养及传代。L02细胞按1×108/L分别接种于24孔板内,待细胞生长至75%融合时进行转染,分为3组:pEGFP-C2组(pEGFP-C2空质粒转染细胞);pEGFP-C2+H2O2组(pEGFP-C2转染细胞24 h后,加1 mmol/L H2O2继续培养6 h);pEGFP-NOD8+H2O2组(pEGFP-NOD8转染细胞24 h后,加1 mmol/L H2O2继续培养6 h)。将JetPRIME/DNA复合物加入培养板,上下轻摇混匀,然后放置于37 ℃、5 % CO2培养箱培养。24 h后相应组加1 mmol/L H2O2继续培养6 h。
2.3Western blotting检测NOD8蛋白表达 收集(1~5)×106L02细胞,用预冷的PBS洗涤3次,加60 μL的细胞裂解液,冰上孵育30 min,离心15 min,收集上清。Bradford法检测蛋白浓度,加入5×loading buffer 加热变性,用SDS凝胶电泳,5% 浓缩胶、10%分离胶分离蛋白后,将蛋白通过电转移方式转移至硝酸纤维薄膜上,用特异性抗体检测NOD8蛋白表达,以GAPDH作为标准蛋白内参照。
2.4Hoechst 33342染色法检测细胞凋亡 细胞接种于24孔板内,细胞培养24 h, 弃上清,用PBS洗涤细胞2次,用4%的多聚甲醛固定30 min之后,用PBS洗涤2次,吸尽液体,加入0.5 mL Hoechst 33342染色液,染色15 min后于荧光显微镜下观察。激发波长为350 nm,发射波长为460 nm左右。
2.5流式细胞术检测细胞凋亡 收集细胞在(1~5)×106个以内。PBS洗涤细胞2次,加200 μL 1× binding buffer重悬细胞,用Annexin V-PE/7-AAD染色后流式细胞仪检测。加5 μL Annexin V-PE ,室温孵育15 min;再用1×binding buffer洗涤细胞2次,200 μL 1×binging buffer重悬细胞,加5 μL 7-AAD viability staining solution,4 h内用流式细胞仪分析。
2.6比色法测定caspase-3活性 按照2.2法分组,L02肝细胞培养6 h后,消化、离心、收集各组细胞。用50 μL的细胞裂解液重悬细胞,冰上孵育10 min, 再加入96孔板中, 每孔依次加入含10 mmol/L DTT的2×reaction buffer 50 μL,及1 mmol/L YVAD-AFC substrate 5 μL,随后放置于37 ℃温箱孵育1~2 h,酶标仪400 nm激发波长,505 nm发射波长下测定各孔的A值。计算每一种样品蛋白含量标准化校正后的A值;将该值与对照组(pEGFP-C2组)A值相比,计算出各组细胞样品中caspase-3的相对活性。
3 统计学处理
所有实验数据使用SPSS 13.0 统计软件进行分析和处理。计数资料数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),各组方差齐时,组间两两比较采用最小显著性差异法(LSD法);各组方差不齐时,两两比较采用Tamhane’s T2法。以P<0.05为差异有统计学意义。
结 果
1 不同浓度H2O2对细胞活性的影响
采取MTT法分析不同浓度的H2O2对L02细胞细胞活性的影响。与对照组相比较,0.2、0.4、0.6和0.8 mmol/L H2O2对细胞活性无明显影响,(P>0.05);1~2 mmol/L H2O2可使细胞活力明显降低,差异有统计学意义(P<0.05)。因此,选择1 mmol/L H2O2作为诱导细胞凋亡的浓度(图1)。

Figure 1. The effect of H2O2 on activity of L02 cells. Mean±SD. n=6. *P<0.05, **P<0.01 vs control.
2 重组质粒转染人L02肝细胞后绿色荧光蛋白的表达情况
pEGFP-C2和pEGFP-NOD8质粒带有绿色荧光蛋白基因,质粒转染入细胞后,在倒置荧光显微镜下可观察到细胞内绿色荧光,高倍镜下计数转染率约40%。Western bloting 检测结果显示,转染pEGFP-C2 空质粒细胞有少量NOD8 蛋白表达,而转染pEGFP-NOD8细胞NOD8 蛋白表达明显增加,见图2。
3 Hoechst 33342染色观察细胞的凋亡情况
Hoechst 33342染色后,在倒置荧光显微镜下观察L02细胞凋亡情况,pEGFP-C2组仅有少量细胞出现细胞核强蓝色荧光现象;pEGFP-C2+H2O2组较多细胞出现强蓝色荧光细胞核,染色质高度凝聚或呈碎块状,细胞凋亡增加;而pEGFP-NOD8+ H2O2组上述现象明显减少,说明NOD8抑制细胞凋亡,见图3。
4 流式细胞术检测L02细胞的凋亡率
Annexin V-PE/7-AAD染色后,用流式细胞仪检测分析L02细胞凋亡率,结果显示,与pEGFP-C2组比较,pEGFP-C2+H2O2组细胞凋亡率明显升高(P<0.01);而与pEGFP-C2+H2O2组相比,pEGFP-NOD8+ H2O2组细胞凋亡率显著下降(P<0.05),见图4。
5 过表达NOD8抑制H2O2诱导的L02细胞caspase-3活性
如图5所示,与pEGFP-C2组比较,pEGFP-C2+H2O2组caspase-3活性明显升高(P<0.01);而与pEGFP-C2+H2O2组相比,pEGFP-NOD8+ H2O2组caspase-3活性显著下降(P<0.05)。

Figure 2. The protein expression of EGFP and NOD8 after the plasmids transfected into L02 cells for 24 h. A: pEGFP-C2 (×200); B: pEGFP-NOD8 (×200); C: pEGFP-C2 (×400); D: pEGFP-NOD8 (×400); E: the protein expression of NOD8 detected by Western blotting.
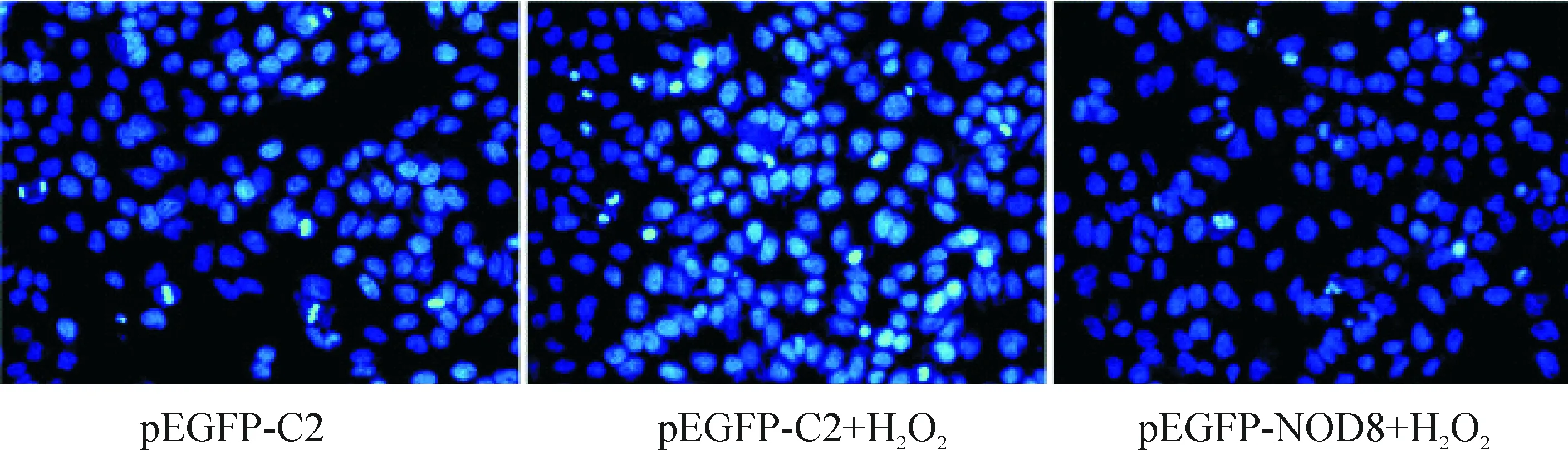
Figure 3. The effect of NOD8 on the apoptosis of L02 cells induced by H2O2 (Hoechst 33342 staining,×400).

Figure 4. The effect of NOD8 on the apoptotic rate in L02 cells induced by H2O2. Mean±SD. n=3. *P<0.05 vs pEGFP-C2; ## P<0.01 vs pEGFP-NOD8+H2O2.
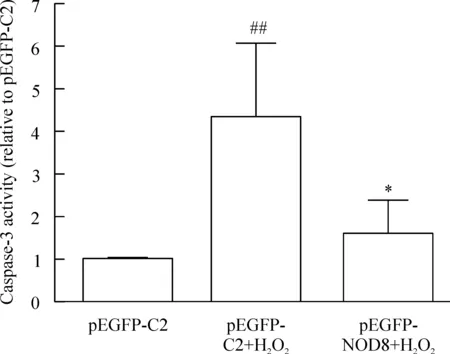
Figure 5. The effect of NOD8 on the caspase-3 activity in L02 cells induced by H2O2 . Mean±SD. n=4. ## P<0.01 vs pEGFP-C2; *P<0.05 vs pEGFP-NOD8+ H2O2.
讨 论
细胞周期作为一个有序进行的过程,当细胞在有序的生命活动过程中出现无法被修复的严重DNA损伤、信号通路的紊乱及细胞内环境的失态时,细胞周期被不可逆的阻滞,进而促使细胞凋亡[7]。细胞凋亡是在个体发育生长过程中为维护机体内环境的稳态、调控机体发育、具有基因编码的细胞死亡过程,是机体对外界刺激进行的主动应答,贯穿于机体的整个生命过程中[8]。由于内源性和(或)外源性刺激使机体代谢异常而产生的活性氧增多, 常使机体处于氧化应激状态,导致细胞凋亡。而细胞凋亡功能亢进与组织损伤和器官功能衰竭的发病密切相关[9-10]。
NLRs在天然免疫反应中发挥了重要的作用,我们前期研究证实, NOD8可抑制LPS诱导巨噬细胞释放炎症因子[11]。国外有研究发现, 将ASC转染HEK293T-Y细胞可导致细胞凋亡;但同时转染ASC及NOD8则HEK293T-Y细胞凋亡明显减少,NOD8可以抑制ASC介导的细胞凋亡[5], 但其抗凋亡机制尚不清楚。本研究用H2O2损伤L02 细胞作为诱导肝细胞凋亡的模型, 进一步探讨NOD8在细胞凋亡中的作用及可能机制。本实验用MTT法检测细胞活性,确定1 mmol/L H2O2为诱导细胞凋亡的剂量。选择转染效果高、细胞毒性小的转染试剂阳离子聚合物瞬时转染质粒,结果发现,重组质粒pEGFP-NOD8转染细胞后绿色荧光蛋白及NOD8蛋白表达明显增加,证实质粒瞬时转染成功。Hoechst 33342染色显示,H2O2诱导的细胞多数发生了细胞核呈强蓝色,染色质高度凝聚、浓缩边缘化或碎块,说明细胞凋亡增多;而转染重组质粒pEGFP-NOD8后上述现象明显改善,结果证明NOD8能抑制细胞凋亡。进一步用流式细胞术检测细胞凋亡率,结果发现,与pEGFP-C2组比较,pEGFP-NOD8组细胞凋亡率明显增加;而重组质粒pEGFP-NOD8转染细胞后能显著抑制由H2O2诱导的细胞凋亡,说明NOD8在细胞凋亡方面发挥负性调节作用。另外,caspases家族是一组存在于胞质溶胶中结构上相关的半胱氨酸蛋白酶,都含有半胱氨酸活性位点,并特异断开天冬氨酸残基后的肽键。Caspase-3是caspases家族成员之一,具有相近的底物和抑制剂特异性,可导致DNA修复的抑制并启动DNA的降解,从而导致核纤层和细胞骨架的崩解,促使细胞凋亡;caspase-3被认为是细胞凋亡执行阶段的关键蛋白酶[12]。本研究结果发现,H2O2可明显增加caspase-3活性,NOD8则显著抑制caspase-3活性。本研究从定性和定量方面说明NOD8对细胞凋亡具有抑制功效。
综上所述,NOD8能够抑制由H2O2诱导L02细胞的凋亡,其作用机制可能是通过抑制caspase-3活化。随着对NOD8抗凋亡作用的深入研究,将为临床治疗多种肝脏疾病及神经元退行性疾病提供新的思路。
[参 考 文 献]
[1] Xu Q, Ma P, Yu W, et al. Chitooligosaccharides protect human embryonic hepatocytes against oxidative stress induced by hydrogen peroxide[J]. Mar Biotechnol, 2010, 12(3):292-298.
[2] Inohara N, Chamaillard M, Mcdonald C, et al. NOD-LRR proteins: role in host-microbial interactions and inflammatory disease[J]. Annu Rev Biochem, 2005, 74:355-383.
[3] Fritz JH, Ferrero RL, Philpott DJ, et al. Nod-like proteins in immunity, inflammation and disease[J]. Nat Immunol, 2006, 7(12):1250-1257.
[4] Kanneganti TD, Lamkanfi M, Nunez G. Intracellular NOD-like receptors in host defense and disease[J]. Immunity, 2007, 27(4):549-559.
[5] Wang Y, Hasegawa M, Imamura R, et al. PYNOD, a novel Apaf-1/CED4-like protein is an inhibitor of ASC and caspase-1[J]. Int Immunol, 2004, 16(6):777-786.
[6] Imamura R, Wang Y, Kinoshita T, et al. Anti-inflammatory activity of PYNOD and its mechanism in humans and mice[J]. J Immunol, 2010, 184(10):5874-5884.
[7] Malumbres M, Barbacid M. Cell cycle kinases in cancer[J]. Curr Opin Genet Dev, 2007, 17(1):60-65.
[8] 高绍莹,罗军敏,秦 欢. Toll样受体信号介导细胞凋亡的研究进展[J].细胞与分子免疫学杂志, 2014,30(4):440-443.
[9] Coyle JT, Puttfarcken P. Oxidative stress, glutamate, and neurodegenerative disorders[J].Science,1993, 262(5134): 689-695.
[10]Ding X, Wang MY, Yao YX, et al. Protective effect of 5-hydroxymethylfurfural derived from processedFructusCornion human hepatocyte LO2 injured by hydrogen peroxide and its mechanism[J]. J Ethnopharmacol ,2010,128(2): 373-376.
[11]田 莉,郑媛媛,胡巢凤,等. NOD8对LPS诱导巨噬细胞释放NO、TNF-α和IL-1β的影响[J]. 中国病理生理杂志, 2013, 29(5):889-894.
[12]赵瑞杰,李引乾,王 会,等. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志, 2010, 46(17):73-78.

