Ag85B慢病毒抑制人支气管上皮细胞TSLP及其受体的表达*
房祥峰, 钱 江, 孟锦绣, 李东风, 吴 健
(1南方医科大学研究生学院,广东 广州 510515; 广东省人民医院,广东省医学科学院 2呼吸内科,3医学研究中心,广东 广州 510080)
支气管哮喘是常见病、多发病,在世界范围内发病率逐年上升,具体发病机制尚未完全阐明[1]。气道上皮参与调控哮喘发生和发展过程,影响哮喘炎症程度[2-3]。哮喘个体气道上皮完整性被破坏,气道敏感性显著增加,更容易被激活[4]。近年发现气道上皮细胞产生的胞腺基质淋巴细胞生成素(thymic stromal lymphopoietin, TSLP)是哮喘发生发展过程中至关重要的上皮源性细胞因子[5],气道内应用抗体中和TSLP或阻断气道上皮细胞TSLP受体(TSLP receptor, TSLPR)均可上调辅助性T细胞(helper T cell,Th)1/Th2比例,抑制哮喘气道炎症[6-7]。如何稳定气道上皮微环境是控制哮喘气道炎症的关键环节。卫生学说和Th1/Th2平衡至今仍被认为是哮喘的重要发病机制之一,本课题组前期及一些研究证实结核分枝杆菌抗原85B(antigen 85B,Ag85B)能增强Th1免疫反应,抑制Th2免疫反应和降低哮喘气道炎症[8-10],但Ag85B如何调控哮喘的作用机制仍未被阐明,推测Ag85B可能通过靶向抑制气道上皮产生TSLP-TSLPR途径,稳定并修饰气道上皮的微环境,从而调控哮喘气道炎症和免疫反应。
慢病毒载体具有无复制性、低细胞毒性等优点,本研究构建携带Ag85B以及增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)报告基因的Ag85B慢病毒载体,试图从改变启动哮喘炎症的微环境为切入点,以具有重要黏膜屏障及免疫调控哮喘气道炎症双重功能的气道上皮细胞为研究靶细胞,建立Ag85B慢病毒感染体外培养的正常人支气管上皮细胞(normal human bronchial epithelial cells,NHBEC)体系,观察Ag85B对NHBEC TSLP和TSLPR表达的影响,探索Ag85B在哮喘气道炎症发生发展中可能的调控机制。
材 料 和 方 法
1 材料
重组慢病毒系统、HEK 293细胞购自广州莱德尔公司;载体主要由GV慢病毒载体系列、pHelper 1.0载体和pHelper 2.0载体3种质粒组成;结核分枝杆菌Ag85B真核表达质粒由本课题组构建[9-10];人支气管上皮细胞株NHBEC细胞由广东省人民医院中心实验室提供。
2 试剂
Trizol试剂、SYBR Green PCR SuperMix和Lipofectamine 2000购自Invitrogen;T4 DNA Ligase购于TaKaRa;兔抗人Ag85B抗体、TSLP抗体及TSLPR抗体购自Abcam;胎牛血清和LM/DMEM/HIGH培养基购自Hyclone;KOD Plus Neo DNA Polymerase购于ToYoBo;PCR引物由上海生工合成。
3 方法
3.1目的基因的扩增及慢病毒载体的构建Ag85B基因的上游引物为5′-ctagtctagaATGACAGACGTGAGCCGAAAGATTC-3′,引入XbaI位点,下游引物为 5′-cgcggatccTCAGCCGGCGCCTAACGAAC-3′,引入BamH I位点。以真核表达质粒pMG-Ag85B为模板[9-10],PCR扩增Ag85B基因,扩增条件:94 ℃5 min;然后98 ℃ 30 s、58 ℃ 30 s、68 ℃ 50 s,共30个循环;68 ℃5 min。PCR产物以XbaI及BamH I双酶切,37 ℃反应3 h,T4 DNA连接酶16 ℃连接2 h。将PCR产物插入pLVX-IRES-Neo-EGFP载体,转化感受态细胞DH5α,提取质粒,用PCR、酶切和测序的方法鉴定重组慢病毒载体。
3.2慢病毒的包装与生物学滴度测定 将冻存的293T细胞水浴快速融化接种于培养瓶中,加入DMEM,37 ℃、5% CO2培养。细胞密度达70%~80%时即可用于感染。将Lipofectamine® 2000和完全培养基加入到A管,完全培养基、重组质粒及包装质粒加入B管。将B管中的DNA沉淀液缓缓地逐滴加入到A管中,轻轻混匀。将沉淀混合物逐滴均匀加入到10 cm细胞培养皿中,轻轻晃动,放入37 ℃、5% CO2培养箱中培养。收集感染48 h的含病毒培养上清,1 000 r/min离心5 min,上清用0.45 μm针头滤器过滤,4 ℃条件下50 000 ×g高速离心2 h,弃上清,病毒沉淀用1 mL PBS充分溶解,再用0.22 μm滤器过滤,-80 ℃冰箱保存。50%组织培养感染剂量法(TCID50)计算病毒滴度:取24孔板,HEK293细胞按3×104cells/well加入。24 h后,用DMEM完全培养基10倍梯度稀释病毒,吸10 μL病毒混合液加入到相对应的48孔板中。经48 h感染,荧光显微镜观察荧光细胞感染后生长情况。
3.3重组慢病毒感染NHBEC 待传代细胞贴壁生长至60%~70%融合时,吸去培养液,用PBS洗1次,加无血清DMEM培养液,置37 ℃、5% CO2孵育箱孵育20 min,按感染复数(MOI)=300时加入病毒液,孵育45 min后,补加完全DMEM培养液使体系中血清浓度为5%,孵育4 h后全量换为完全DMEM培养液,48 h后检测鉴定。
3.4Real-time PCR检测Ag85B、TSLP和TSLPR的mRNA表达 收集病毒感染后48 h细胞,按说明书步骤提取RNA,逆转录后进行real-time PCR检测。Ag85B的上游引物为5′-CAAGCTGGTCGCAAACAACA-3′,下游引物为5′-AGGTTGCTGCTACGAACGAA-3′;TSLP的上游引物为5′-TTTGGAGATAGGCAGCTTCA-3′,下游引物为5′-TCTAGCTTGCAGCGGGAAT-3′;TSLPR的上游引物为5′-TTCTCCAGGAAGGTCACACT-3′,下游引物为5′-CTGATGCCACGAAAATCTC-3′;18S rRNA的上游引物为5′-CCTGGATACCGCAGCTAGGA-3′,下游引物为5′-GCGGCGCAATACGAATGCCCC-3′。Real-time PCR 的反应条件:50 ℃ 2 min; 95 ℃ 2 min; 95 ℃ 15 s、60 ℃ 32 s ,40个循环;融解曲线分析取60 ℃~95 ℃,采用2-ΔΔCt描述所得数据。
3.5Western blotting检测Ag85B、TSLP和TSLPR蛋白的表达 收集病毒感染后48 h细胞,按说明书步骤提取总蛋白,用BCA法蛋白定量,蛋白样品上样进行SDS-PAGE后转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜后,分别加入抗Ag85B、TSLP和TSLPR抗体,抗体用含1%脱脂奶粉的TBST稀释,相应浓度分别为1∶500、1∶1 000和1∶100, 4 ℃孵育过夜。TBST洗膜后,加入HRP标记的Ⅱ抗,37 ℃孵育1 h。TBST洗膜后,ECL发光试剂检测蛋白印迹条带,光密度扫描仪扫描胶片,Gelpro32软件分析结果。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 Ag85B慢病毒载体的构建
PCR扩增的Ag85B基因片段的长度为978 bp,与预计的大小相符,测序正确后将其插入pLVX-IRES-Neo-EGFP载体,转化感受态细胞DH5α,提取慢病毒载体pLVX-IRES-Neo-EGFP-Ag85B重组质粒,经XbaI和BamH I双酶切,得到978 bp的目的基因片段和9 036 bp的载体片段,见图1。
2 Ag85B慢病毒的滴度与感染效率鉴定
Ag85B慢病毒感染293T细胞,扩增、纯化后,测定滴度为:2×1011TU/L。HEK293细胞被感染后,细胞形态未见明显改变,在荧光显微镜下观察有EGFP表达的细胞达90%以上,见图2。
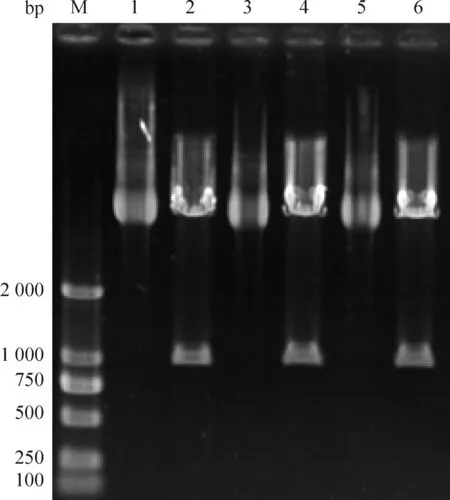
Figure 1. The enzyme cleavage result of pLVX-IRES-Neo-EGFP-Ag85B. M: DL2000 DNA ladder marker; Lane 1, 3, 5: recombinant lentivirus; Lane 2, 4, 6: products of enzyme digestion.

Figure 2. The HEK293 cells transfected with the Ag85B lentivi-rus (×100).
3 Ag85B在NHBEC中的表达
以气道上皮细胞为靶细胞,将Ag85B慢病毒感染NHBEC并鉴定Ag85B mRNA及蛋白表达,探索Ag85B慢病毒可能的作用机制。Real-time PCR结果显示,Ag85B慢病毒感染组出现单峰,而对照组和空病毒感染组在相应位置未见明显起峰,见图3、表1。Western blotting实验结果表明,Ag85B慢病毒感染组可见Ag85B蛋白高表达,对照组和空病毒感染组未见阳性结果,说明Ag85B慢病毒成功感染体外培养的人气道上皮细胞,见图6、表2。
4 Ag85B对NHBEC中TSLP和TSLPR表达的影响
慢病毒感染48 h后,Ag85B慢病毒感染组TSLP mRNA表达水平较对照组和空病毒感染组有下降趋势,但无显著差异(P>0.05);Ag85B慢病毒感染组TSLPR mRNA水平显著降低,分别是对照组和空病毒感染组的39%和47%,差异显著(P<0.05),见图4、5及表1。

Figure 3. Performance of real-time PCR in quantification with Ag85B primers (amplification plot and melting curve).

Figure 4. Performance of real-time PCR in quantification with TSLP primers (amplification plot and meltting curve).

Figure 5. Performance of real-time PCR in quantification with TSLPR primers (amplification plot and melting curve).
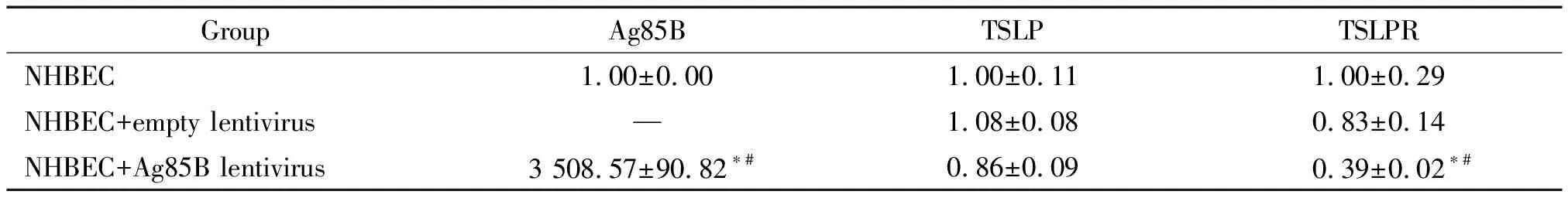
表1 各组Ag85B、TSLP和TSLPR mRNA表达水平
Ag85B慢病毒感染NHBEC组的 TSLP和TSLPR蛋白表达水平均较对照组和空病毒感染组显著降低,其TSLP蛋白表达分别是对照组和空病毒感染组的59%和49%,TSLPR蛋白表达水平分别是对照组和空病毒感染组的37%和44%(P<0.05)。对照组和空病毒感染组的TSLP和TSLPR蛋白表达无显著差异(P>0.05),见图6、表2。
讨 论
气道上皮细胞位于内外环境交界处,既起重要的物理屏障作用,又是参与调控损伤、抗原暴露后气道炎症和免疫反应的重要炎症细胞[11-12]。气道上皮细胞微环境的稳定是控制哮喘气道炎症的关键环节,气道上皮分泌的TSLP及其受体TSLPR是哮喘气道炎症的重要启动因素,外界刺激物(抗原、病毒等)可刺激气道上皮细胞产生TSLP[13]。TSLP最先于小鼠胸腺细胞系Z210R.1上清液中被发现,它可以维持前B细胞系的长期生存,促进非分化淋巴细胞增殖,促进树突状细胞成熟和naïve Th0 细胞向Th2方向极化[14]。TSLPR是螺旋结构的受体复合体,包括了TSLPR和IL-7α TSLPR链,属于造血细胞受体家族,TSLPR和IL-7αR结合可使亲和力增强。TSLPR分布广泛,几乎所有的参与哮喘炎症过程的炎症细胞上均有表达[15]。

Figure 6. The results of Western blotting for determining protein levels of Ag85B, TSLP and TSLPR in NHBEC with different treatments.
研究证明,TSLP可诱导Th0细胞向Th2极化,导致Th1/Th2比例失衡、气道高反应性、黏液高分泌[16-17]。气道内应用TSLP抗体或TSLPR抗体可以抑制哮喘小鼠支气管炎症程度、降低气道高反应性、降低肺泡灌洗液中Th2型细胞因子(IL-4等)、上调Th1/Th2细胞比例[6-7]。流行病Meta分析证明早期接种BCG疫苗可以预防哮喘等过敏性疾病的发生,其机制可能与早期细菌等暴露促进免疫系统的成熟有关[18]。Ag85B是结核分枝杆菌的主要胞外分泌蛋白,是其在体外和体内发挥生物学作用的主要成分。Ag85B可以诱导人或鼠产生较强的Thl型免疫反应[19]。研究发现,卡介苗对动物实验性哮喘具有预防性治疗作用[20],而Ag85B DNA疫苗接种则可抑制OVA致敏哮喘鼠气道炎症程度,表现为血清和肺泡灌洗液中IgE水平下降、嗜酸性粒细胞浸润程度降低、Th2细胞因子降低、Th1和调节性T细胞因子增高以及Th1/Th2比例恢复[9, 21]。

表2 各组Ag85B、TSLP和TSLPR的蛋白水平
应用TSLP抗体或TSLPR抗体和Ag85B疫苗接种对哮喘炎症的影响有相似之处,早期结核暴露可以减少哮喘发生的风险,我们推测Ag85B可能通过修饰气道上皮的微环境,通过靶向抑制TSLP-TSLPR途径,在源头上改变哮喘启动及炎症发生的过程,从而发挥抑制哮喘气道炎症的作用。为此,本研究应用Ag85B慢病毒载体感染正常人气道上皮细胞,探究Ag85B过表达的慢病毒对体外培养的NHBEC产生TSLP、TSLPR的调控作用。选择慢病毒作为载体是基于以下优点:(1)含目的基因的慢病毒载体整合入宿主基因组,对转录沉默作用具有较强的抵抗能力,并在体外培养细胞实验中能够长期而稳定的表达;(2)慢病毒载体可以兼容多个转录启动子,包括细胞特异性启动子和在基因组中普遍存在的管家基因的启动子;(3)经过改建后的慢病毒载体可以容纳约10 kb左右的外源基因, 因此大多数的cDNA都能被克隆入慢病毒载体[22]。
本课题组用real-time PCR以及Western blotting等实验方法证明构建的慢病毒载体将Ag85B基因成功导入人支气管上皮细胞并且过表达Ag85B mRNA及蛋白。与对照组和空病毒感染组比较,Ag85B慢病毒感染组TSLPmRNA表达有下降趋势;而Ag85B慢病毒感染组的TSLP蛋白表达较其它两组明显下降,而蛋白质是生物效能的执行者,说明Ag85B慢病毒可以抑制TSLP的蛋白表达,并可能对后续炎症瀑布产生影响。组间比较,TSLP mRNA的表达无显著差异而蛋白水平差异显著,我们认为造成两者的差异表达可能有以下几种原因:(1)Ag85B调控气道上皮细胞TSLP mRNA的转录水平程度较弱,而主要调控其转录后水平;(2)理论上转录水平差异的出现早于翻译水平,本实验于感染48 h后检测mRNA和蛋白表达,可能是因为检测时间不够早而未捕捉到mRNA转录水平的差异;(3)用来分析的Ag85B慢病毒感染气道上皮细胞的病毒株样本数偏少。Ag85B慢病毒感染后,TSLPR mRNA和蛋白表达水平均显著降低,说明Ag85B慢病毒可以抑制气道上皮TSLPR基因的信使RNA的转录和蛋白水平的表达,我们认为下调表达的TSLPR可导致其对TSLP的亲和力下降、敏感性降低,从而使炎症状态下气道上皮细胞的激活阈值升高,从源头上抑制气道上皮分泌的炎症因子TSLP和下游炎症细胞上的TSLPR的结合,从而保护机体避免产生瀑布样级联效应的哮喘气道炎症。
本课题组前期研究发现Ag85B质粒可以抑制哮喘小鼠气道炎症,降低气道高反应性,增加肺部及脾脏的Th1/Th2细胞因子的比例,但是具体机制未明[9]。而TSLP-TSLPR通路在哮喘炎症发生发展过程中起关键作用,气道内应用抗体中和TSLP或者阻断TSLPR可以抑制哮喘炎症,降低Th2免疫反应[6-7]。本研究成功建立Ag85B慢病毒感染气道上皮细胞体系,证实Ag85B慢病毒能抑制气道上皮细胞分泌TSLP和TSLPR,首次证实Ag85B可能通过靶向阻滞TSLP-TSLPR通路而抑制哮喘气道炎症的产生。本实验不足之处在于未进一步分析在过敏原、炎症因子刺激状态下,气道上皮细胞是否存在与基础状态不同的TSLP和TSLPR的差异表达。本课题组已成功构建气道滴入TSLP中和抗体抑制哮喘小鼠气道炎症的模型,观察到TSLP中和抗体对哮喘小鼠气道高反应性和气道炎症的抑制作用(结果另文发表)。
[参 考 文 献]
[1] Sears MR. Trends in the prevalence of asthma[J]. Chest, 2014, 145(2):219-225.
[2] Proud D, Leigh R. Epithelial cells and airway diseases[J]. Immunol Rev, 2011, 242(1):186-204.
[3] Holgate ST. The sentinel role of the airway epithelium in asthma pathogenesis[J]. Immunol Rev, 2011, 242(1):205-219.
[4] Barbato A, Turato G, Baraldo S, et al. Epithelial damage and angiogenesis in the airways of children with asthma[J]. Am J Respir Crit Care Med, 2006, 174(9):975-981.
[5] Liu YJ. Thymic stromal lymphopoietin: master switch for allergic inflammation[J]. J Exp Med, 2006, 203(2):269-273.
[6] Chen Z, Zhang T, Li H, et al. Neutralization of TSLP inhibits airway remodeling in a murine model of allergic asthma induced by chronic exposure to house dust mite[J]. PLoS One, 2013, 8(1):e51268.
[7] Shi L, Leu S, Xu F, et al. Local blockade of TSLP receptor alleviated allergic disease by regulating airway dendritic cells[J]. Clin Immunol, 2008, 129(2):202-210.
[8] 吴 健,徐 军,钟南山. 结核分支杆菌抗原85B DNA疫苗转染人气道上皮细胞对哮喘患者Th1/Th2平衡的调节作用[J]. 中华结核和呼吸杂志, 2003, 26(8):20-24.
[9] Wu J, Xu J, Cai C, et al. Ag85B DNA vaccine suppresses airway inflammation in a murine model of asthma[J]. Respir Res, 2009, 10:51.
[10]吴 健,徐 军,钟南山. BCG30主要分泌蛋白对尘螨变应性患者TH1/TH2平衡调节作用的观察[J]. 中华微生物学和免疫学杂志, 2003, 23(7):553-556.
[11]Kato A, Schleimer RP. Beyond inflammation: airway epi-thelial cells are at the interface of innate and adaptive immunity[J]. Curr Opin Immunol, 2007, 19(6):711-720.
[12]何 丽,梅 丽,马经平,等. pDC315-SPA-mCLCA3载体的构建及其在气道上皮细胞系的靶向表达分析[J]. 中国病理生理杂志, 2011, 27(6):1240-1244.
[13]Holgate ST. The epithelium takes centre stage in asthma and atopic dermatitis[J]. Trends Immunol, 2007, 28(6):248-251.
[14]Licona-Limón P, Kim LK, Palm NW, et al. TH2, allergy and group 2 innate lymphoid cells[J]. Nature Immunol, 2013, 14(6):536-542.
[15]Redhu NS, Gounni AS. Function and mechanisms of TSLP/TSLPR complex in asthma and COPD[J]. Clin Exp Allergy, 2012, 42(7):994-1005.
[16]Kaur D, Brightling C. OX40/OX40 ligand interactions in T-cell regulation and asthma[J]. Chest, 2012,141(2):494-499.
[17]黄立锋,姚咏明,盛志勇. 树突状细胞与调节性T细胞相互作用研究进展[J]. 中国病理生理杂志, 2008, 24(03):610-616.
[18]El-Zein M, Parent ME, Benedetti A, et al. Does BCG vaccination protect against the development of childhood asthma? A systematic review and meta-analysis of epidemiological studies[J]. Int J Epidemiol, 2010, 39(2):469-486.
[19]Tamura T, Shimohakamada Y, Makino M. Towards novel tuberculosis and leprosy vaccine development: the role of Th1-inducing peptide in cytotoxic T cell differentiation[J]. Nihon Hansenbyo Gakkai Zasshi, 2013, 82(3):111-117.
[20]刘金保,钟南山,李树浓,等. 卡介苗对豚鼠实验性哮喘的预防性治疗作用[J]. 中国病理生理杂志, 2003, 19(4):464-467.
[21]Karamatsu K, Matsuo K, Inada H, et al. Single systemic administration of Ag85B of mycobacteria DNA inhibits allergic airway inflammation in a mouse model of asthma[J]. J Asthma Allergy, 2012, 5:71-79.
[22]Gill DR, Bazzani RP, Hyde SC. Strategies for long-term expression of transgenes in the respiratory epithelium[J]. Curr Opin Mol Ther, 2010, 12(4):386-393.

