急性缺氧肺动脉平滑肌细胞线粒体活性氧变化的观察*
杨 朝, 耑 冰, 张丽萍, 赵 霞, 张建银, 葛利军, 吴昌归
(宁夏人民医院 1总院呼吸内科, 2心血管内科,宁夏 银川 750011; 3第四军医大学西京医院呼吸内科,陕西 西安 710000)
缺氧时选择性收缩肺动脉对于调节动脉氧合作用非常重要,然而,在机体整个处于缺氧状态下,如呼吸系统疾病或高原缺氧等,缺氧肺血管收缩(hypoxic pulmonary vasoconstriction,HPV)导致肺动脉压力异常增高,长期反复发生可以形成或加剧肺动脉高压(pulmonary hypertension)的发生发展[1]。目前HPV发病的分子机制,如肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs) 哪个部位感知缺氧、缺氧信息如何转导最后导致肺动脉收缩还不十分清楚。多数研究认为PASMCs线粒体感知缺氧并始动了HPV的发生[2-3],线粒体产生的活性氧(reactive oxygen species,ROS),主要是过氧化氢(hydrogen peroxide,H2O2)在传递缺氧信息中起着重要的作用,但线粒体在缺氧时产生ROS的位点还不很清楚。Michelakis等[4]研究认为缺氧可以引起线粒体电子传递链(electron transport chain,ETC)复合物I及III位点产生ROS减少从而导致HPV,而更多研究认为线粒体ETC复合物I、II、III和IV均与HPV有关[5-6]。因此,本研究通过激光扫描共聚焦显微镜观察缺氧时PASMCs 产生ROS的变化,同时直接分离线粒体,用荧光分光光度法检测其生成量及生成的具体位点。
材 料 和 方 法
1 动物和试剂
健康成年雄性SD 大鼠体重(200±15) g,购自北京维通利华实验动物技术有限公司,自由进食饮水;DMEM、胎牛血清 (fetal bovine serum,FBS)青、链霉素均为Gibco产品;二硫苏糖醇 和4-(2-羟乙基)-1-哌嗪乙烷磺酸 [4-(2-hydroxyethyl)-1-piperazine-ethanesulfonic acid, HEPES] 购自Roche;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体购自Abcam;生物素化山羊抗小鼠IgG购自Santa Cruz;SABC试剂与DAB显色剂购自Pierce;胶原酶I、分子探针chloromethyl dichlorodihydrofluorescein diacetate(CM-H2DCF/DA)和RedoxSensor Red CC-1、线粒体ETC复合物I抑制剂1-methyl-4-phenylpyridinium iodide (MPP,5 μmol/L)、复合物II抑制剂3-nitroproprionic acid (NPA,5 mmol/L) 及2-tenoyltrifluoroacetone (TTFA, 10 μmol/L)、复合物III前泛半醌位点抑制剂myxothiazol (10 μmol/L)、复合物III后泛半醌位点抑制剂antimycin A (5.7 μmol/L)和复合物IV抑制剂sodium azide (NaN3,1 mmol/L)、呼吸缓冲液[包括5 mmol/L丙酮酸(pyruvate)、2.5 mmol/L苹果酸(malate)、10 μmol/L dichlorodihydrofluorescein diacetate (H2DCF/DA; 分子探针) 和5 μmol/L辣根过氧化物酶(horseradish peroxidase,HRP)] 均购自Sigma;细胞线粒体分离试剂盒购自碧云天公司;其余试剂为国产分析纯。
2 大鼠PASMCs分离、培养、鉴定和分组
参照我实验室既往方法[7]分离及培养PASMCs,经平滑肌α-actin单克隆抗体免疫细胞化学染色鉴定为平滑肌细胞。
实验分8组:(1) 常氧组;(2)急性缺氧组;(3)急性缺氧+线粒体ETC复合物I抑制剂MPP组;(4)急性缺氧+线粒体ETC复合物II抑制剂NPA组;(5)急性缺氧+线粒体ETC复合物II抑制剂TTFA组;(6)急性缺氧+线粒体ETC复合物III前泛半醌位点抑制剂myxothiazol组;(7)急性缺氧+线粒体ETC复合物III后泛半醌位点抑制剂antimycin A组;(8)急性缺氧+线粒体ETC复合物IV抑制剂NaN3组。
常氧的实验条件为:35 ℃,21% O2,5% CO2,74% N2;急性缺氧的实验条件为:35 ℃, 1% O2,5% CO2,94% N2,持续5 min[8]。
3 细胞内ROS的检测
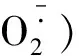
4 线粒体的分离
参照Korde等[3]的方法分离线粒体,取生长良好的PASMCs,胰酶消化并收集细胞后用预冷的PBS重悬细胞沉淀,取少量细胞计数,剩余细胞500×g、4 ℃离心5 min,弃上清。每(2~5)×107细胞中加入1~2.5 mL线粒体分离试剂(根据细胞样品数量,在线粒体分离试剂加入到细胞样品中前2~3 min内加入蛋白酶抑制剂PMSF,使PMSF的终浓度为1 mmol/L),重悬细胞,冰浴10~15 min。把细胞悬液转移至玻璃匀浆器中匀浆30下,然后将细胞匀浆在1 300×g、4 ℃离心3 min,取上清,沉淀用同样方法再进行1次,再取上清。将获得的上清液在13 000×g、4 ℃离心10 min, 弃上清,沉淀用线粒体分离试剂(已加入PMSF)重悬,再在10 000×g、4 ℃离心10 min,弃上清,得到沉淀即为线粒体,用150~200 μL 线粒体储存液重悬线粒体待用。所有步骤均在冰上或4 ℃进行,所用溶液均冰浴或4 ℃预冷。
5 线粒体ROS的检测
参照Korde等[3]的方法测定线粒体ROS。取线粒体悬液加入96孔板,每孔线粒体蛋白浓度测定约为50 μg ,加入呼吸缓冲液(5 mmol/L 丙酮酸,2.5 mmol/L 苹果酸,10 μmol/L H2DCF/DA及5 μmol/L HRP),室温孵育30 min,用FlexStation-III分光光度计(Molecular Devices)检测荧光强度,激发波长485 nm,发射波长532 nm. 在每一实验中,ROS的量根据测定量减去背景荧光强度(只加入呼吸缓冲液而无线粒体样本时测得的荧光强度)。
6 统计学处理
数据以均数±标准差(mean±SD)表示,成组资料的比较用t检验,多组资料的比较采用F检验,组间差异采用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。用SPSS 13.0软件包处理。
结 果
1 肺动脉平滑肌细胞的鉴定
生长中的PASMCs见图1A。经α-SMA免疫细胞化学染色,在高倍镜下可见α-SMA在胞质内均匀分布,呈棕色平行纤维丝状结构,见图1B。

Figure 1. The growth of PASMCs (A, ×300) and the positive expression of α-smooth muscle actin in PASMCs(B,×300).
2 常氧及急性缺氧肺动脉平滑肌细胞 ROS的生成量

3 常氧及急性缺氧PASMCs 中ROS 的生成量及生成位点
(1) 与常氧组比较,急性缺氧PASMCs ROS(主要是H2O2)的生成量增加了3.44倍(P<0.01)。(2) 与缺氧组比较,使用线粒体ETC复合物I抑制剂MPP(5 μmol/L)、复合物II抑制剂NPA(5 mmol/L) 和TTFA(10 μmol/L)及复合物III前泛半醌位点抑制剂myxothiazol (10 μmol/L),都能显著降低缺氧时PASMCs胞内ROS的生成量 (分别降低60%、73%、75%和61%,P<0.01);而复合物III后泛半醌位点抑制剂antimycin A (5.7 μmol/L) 及复合物IV 抑制剂NaN3(1 mmol/L) 对胞内ROS的生成量无明显影响(升高13%和9.1%,P>0.05),见图3。这提示急性缺氧时PASMCs线粒体复合物Ⅰ、Ⅱ以及III前泛半醌位点生成ROS增加,而III后泛半醌位点和IV与此无明显关系。

Figure 2. ROS production in the rat PASMCs under the conditions of normoxia and hypoxia. A: H2O2 concentration-dependently increased DCF fluorescence intensity in the rat PASMCs 5 min after hypoxia (×300); B: H2O2 and concentration-dependently increased Red CC-1 fluorescence intensity in rat PASMCs 5 min after hypoxia (×300). Mean±SD. n=4.**P<0.01 vs normoxia.

Figure 3. Treatment with the inhibitors of mitochondrial ETC complexes, MPP, NPA, TTFA and myxothiazol, all prevented hypoxia-induced increase in ROS production.Mean±SD. n=4.**P<0.01 vs hypoxia.
4 常氧及急性缺氧PASMCs线粒体ROS的生成量及生成位点
(1) 与常氧组相比,急性缺氧PASMCs 线粒体ROS(主要是H2O2)的生成量明显增加(P<0.01)。(2) 用线粒体ETC复合物Ⅰ抑制剂MPP (5 μmol/L)、Ⅱ抑制剂NPA (5 mmol/L)和 TTFA(10 μmol/L)及III前泛半醌位点抑制剂myxothiazol (10 μmol/L)都能显著降低缺氧时线粒体ROS的产生(P<0.01),而III后泛半醌位点抑制剂antimycin A (5.7 μmol/L)和IV抑制剂NaN3(1 mmol/L)对线粒体缺氧ROS的产生无明显影响(P>0.05),见表1。提示,PASMCs线粒体可以感知缺氧,急性缺氧时线粒体复合物Ⅰ、Ⅱ以及III前泛半醌位点生成ROS增加,而III后泛半醌位点和IV与此无明显关系。

表1 急性缺氧线粒体ETC复合物抑制剂对PASMCs线粒体ROS生成量的影响
讨 论
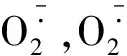


众所周知,PASMCs细胞浆内游离钙离子浓度(cytoplasmic free Ca2+concentration,[Ca2+]i)升高是HPV发生、发展乃至导致HPV的效应途径。我们既往的研究也证实急性缺氧可引起细胞外Ca2+内流及内质网ryanodine receptor-seneitive钙库的Ca2+释放,二者均可使 [Ca2+]i升高,肺动脉收缩增强[7],然而PASMCs哪个部位感知缺氧,缺氧信息如何传递引起 [Ca2+]i升高的分子机制还不十分清楚。由于线粒体是细胞内耗氧量最活跃且对缺氧最敏感的细胞器,因此推测线粒体可能就是PASMCs感受缺氧的主要部位。而本研究也证实:线粒体可以直接感知缺氧,在急性缺氧情况下线粒体复合物Ⅰ、Ⅱ以及III前泛半醌位点ROS生成增加,而新近的研究又证实ROS可以引起 [Ca2+]i增加[12],由此推测HPV的发病机制可能是:急性缺氧触发PASMCs线粒体ETC复合物Ⅰ、Ⅱ以及III前泛半醌位点生成ROS增多,而ROS 本身也可以诱导线粒体产生更多的 ROS,即 ROS 诱导的 ROS 释放(ROS-induced ROS release,RIRR)[13];而生成增多的ROS(主要H2O2)可作为第二信使自由透过细胞器膜引起 [Ca2+]i的升高,从而导致HPV。
本研究显示,线粒体ETC复合物能够感知缺氧,其产生增多的ROS可能在耦联缺氧信息与肺动脉的机械收缩过程中起关键作用。深入研究PASMCs感知缺氧,缺氧信息的转导机制,有利于阐明HPV的发病机制,并最终为缺氧PH提供新的治疗策略。
[参 考 文 献]
[1] Shimoda LA, Laurie SS. HIF and pulmonary vascular responses to hypoxia[J]. J Appl Physiol, 2014, 116(7):867-874.
[2] Desireddi JR, Farrow KN, Marks JD, et al. Hypoxia increases ROS signaling and cytosolic Ca2+in pulmonary artery smooth muscle cells of mouse lungs slices[J]. Antioxid Redox Signal, 2010, 12(5):595-602.
[3] Korde AS, Yadav VR, Zheng YM, et al. Primary role of mitochondrial Rieske iron-sulfur protein in hypoxic ROS production in pulmonary artery myocytes[J]. Free Radic Biol Med, 2011, 50(8):945-952.
[4] Michelakis ED, Hampl V, Nsair A, et al. Diversity in mitochondrial function explains differences in vascular oxygen sensing[J]. Circ Res, 2002, 90(12):1307-1315.
[5] Weissmann N, Zeller S, Schäfer RU, et al. Impact of mitochondria and NADPH oxidases on acute and sustained hypoxic pulmonary vasoconstriction[J]. Am J Respir Cell Mol Biol, 2006, 34(4):505-513.
[6] Sommer N, Pak O, Schörner S, et al. Mitochondrial cytochrome redox states and respiration in acute pulmonary oxygen sensing[J]. Eur Respir J, 2010, 36(5):1056-1066.
[7] 杨 朝, 张珍祥, 徐永健, 等. 急性缺氧大鼠肺动脉平滑肌内质网钙信号的变化及意义[J]. 中国病理生理杂志, 2008, 24(10):2016-2019.
[8] Chen CS, Gee KR. Redox-dependent trafficking of 2,3,4,5,6-pentafluorodihydrotetramethylrosamine, a novel fluorogenic indicator of cellular oxidative activity[J]. Free Radic Biol Med, 2000, 28(8):1266-1278.
[9] 熊 燕, 张 梅, 陈 菲, 等. 线粒体功能障碍与心血管疾病[J]. 中国病理生理杂志, 2013, 29(2):364-370.
[10] Chuang DY, Chan MH, Zong Y, et al. Magnolia polyphenols attenuate oxidative and inflammatory responses in neurons and microglial cells [J]. J Neuroinflammation, 2013, 10:15.
[11] Al-Mehdi AB, Zhao G, Dodia C, et al. Endothelial NADPH oxidase as the source of oxidants in lungs exposed to ischemia or high K+[J]. Circ Res, 1998, 83(7):730-737.
[12] Yadav VR, Song T, Joseph L, et al. Important role of PLC-γ1 in hypoxic increase in intracellular calcium in pulmonary arterial smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304(3):L143-L151.
[13] Biary N, Xie C, Kauffman J, et al. Biophysical properties and functional consequences of reactive oxygen species (ROS)-induced ROS release in intact myocardium[J]. J Physiol, 2011, 589(Pt 21):5167-5179.

