厚朴酚延缓幼年自发性高血压大鼠的高血压进程及其机制*
梁向艳, 邢文娟, 何金孝, 季乐乐, 李 榕, 张海锋△
(第四军医大学 1基础医学院教学实验中心, 2基础医学院生理学教研室,3西京医院儿科, 4西京医院老年病科,陕西 西安 710032)
高血压前期是指收缩压处于120~139 mmHg或舒张压处于80~89 mmHg的血压阶段,我国高血压防治指南称之为“正常高值”血压。美国和我国的流行病学调查均显示,高血压前期人群较血压正常人群更易发展为高血压[1-2],即使没有发展为高血压,高血压前期人群也增加了其它心血管疾病尤其是中风的危险[3]。已报道在高血压前期应用坎地沙坦可减少高血压的发病率[2],我们最近证实在高血压前期长期运动锻炼可以延缓高血压进程[4]。因此在高血压前期进行干预处理来延缓血压升高是确实可行的。然而高血压前期发展为高血压的潜在机制仍不清楚,在高血压前期抗高血压治疗的药物仍然缺乏。
厚朴酚(magnolol, MAG)是中药厚朴的活性成分,具有活血化瘀的功效,在心血管系统的作用主要包括减轻缺血/再灌注损伤和抗动脉粥样硬化作用等[5-8],但其对血压的影响仍不清楚。我们前期研究证实,幼年血压正常的自发性高血压大鼠(spontaneous hypertensive rats, SHR)对胰岛素诱导的血管舒张效应降低[9-10],而运动锻炼可通过改善血管胰岛素抵抗来降低血压[4]。有研究证实Tribbles 同源蛋白3 (Tribbles homologue 3, TRB3)可通过抑制Akt磷酸化来减弱胰岛素信号通路[11]。此外,过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptor γ, PPARγ)激活可增强胰岛素信号通路[12],且自发性高血压大鼠血管组织表达降低,收缩压升高[13]。厚朴酚在体外能激活PPARγ[14],然而其在体内能否影响PPARγ和TRB3的表达仍不清楚。因此,本实验拟研究厚朴酚对高血压前期大鼠血压和胰岛素诱导的血管舒张效应的影响,并进一步探讨其可能的机制。
材 料 和 方 法
1 主要试剂和仪器
厚朴酚(陕西旭煌植物科技发展有限公司);wortmannin(Santa Cruz);PPARγ、TRB3、Akt、p-Akt、内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)和p-eNOS抗体(Cell Signaling);其它试剂均购自Sigma;罗氏活力型血糖仪及血糖试纸(Roche);大鼠胰岛素ELISA试剂盒(R&D);一氧化氮(nitric oxide, NO)检测试剂盒(南京建成);生物信号采集与处理系统、无创血压分析仪(成都泰盟公司);电泳仪(Bio -Rad)。
2 动物实验
采用4周龄的雄性SHR及年龄、性别匹配的正常血压Wistar-Kyoto(WKY)大鼠。共分为4组:① WKY对照组:每日灌胃蒸馏水;② WKY+MAG处理组:每日灌胃MAG(100 mg/kg);③ SHR对照组:每日灌胃蒸馏水;④ SHR+ MAG处理组:每日灌胃MAG(100 mg/kg)。3周后,大鼠禁食12 h,测量尾动脉收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure ,DBP),检测胰岛素水平和血糖水平。
3 主要实验方法
3.1血压、血液指标的测定 大鼠血压检测采用无创尾套法测量尾动脉收缩压和舒张压。3周后取腔静脉血离心,测量血浆胰岛素水平和空腹血糖水平。血糖浓度使用血糖分析仪检测,血浆胰岛素浓度采用放射免疫法检测。
3.2血管环实验 大鼠麻醉后取降主动脉于冰冷的Kreb’s液中。剔除结缔组织将其剪成约3 mm的血管环并垂直悬挂于含37 ℃的Kreb’s液的浴槽中,通含95% O2和5% CO2的混合气。基础张力为1×g,平衡90 min,每15 min换液。血管稳定后以10-6mol/L的苯肾上腺素(phenylephrine,PE)收缩血管,收缩达峰值后加入10-5mol/L 乙酰胆碱(acetylcholine, ACh)。若加入ACh后使血管舒张70%~90%可认为内皮完整,否则弃用。冲洗稳定30 min后重复给予PE,待血管收缩达到稳定值后逐步加入胰岛素(10-10~10-6mol/L)。以PE诱发的收缩幅度为100%,舒张率(%)=药物引起舒张的张力/PE引起的收缩张力×100%。
3.3Western blotting检测PPARγ、TRB3、Akt和eNOS的表达水平 常规方法提血管组织或细胞蛋白,BCA法进行蛋白定量。将蛋白样品行SDS-PAGE后转移至PVDF膜。加入Ⅰ抗4 ℃孵育过夜,洗膜后加入相应Ⅱ抗,37 ℃孵育1 h,使用ECL-Plus试剂盒进行化学发光检测,β-actin为各组内参照。用Quantity One 4.0成像软件系统进行条带光密度值分析。
3.4细胞培养 培养细胞经Ⅷ因子相关抗原免疫组化鉴定为阳性;实验要求细胞纯度在90%以上。传代培养至2~4代后,以1×108/L的密度接种于24孔培养板中培养。随机分为正常对照组:直接给予低糖DMEM培养液(5.6 mmol/L);高糖高脂组:DMEM培养液中高糖浓度为25 mmol/L,棕榈酸钠浓度为500 μmol/L。每组8孔,培养48 h,光学显微镜下观察细胞形态学变化,MTT法测定细胞活性。
3.5NO含量检测 培养基上清取100 μL,严格按南京建成NO检测试剂盒操作,每组重复测量3次。
4 统计学处理
数据采用均数±标准误(mean±SEM)表示,运用Prism 5.0统计软件分析,组间差异采用单因素方差分析(One-way ANOVA)或组间t检验,以P<0.05为差异有统计学意义。
结 果
1 厚朴酚对SHR/WKY大鼠血压及其它生理参数的影响
大鼠饲养3周后,SHR的体重、血糖、血浆胰岛素、舒张压和收缩压开始升高,且显著高于WKY组。SHR组给予厚朴酚干预后,其血糖、血浆胰岛素、舒张压和收缩压与对照组SHR相比显著降低,见表1,图1。
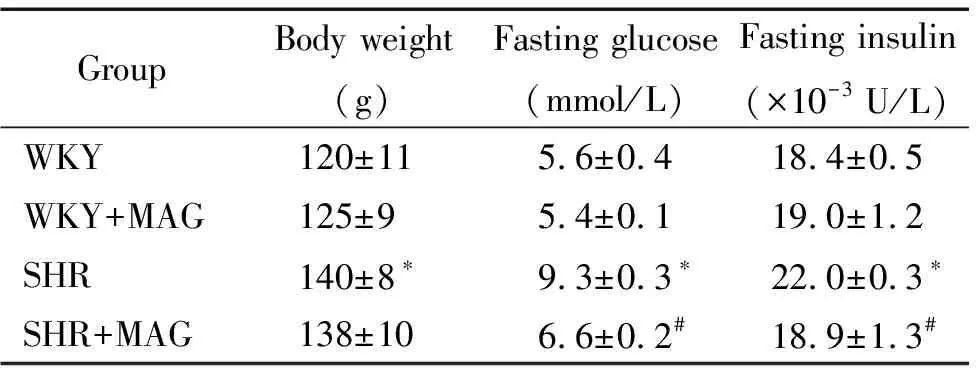
表1 WKY大鼠和SHR的生理参数
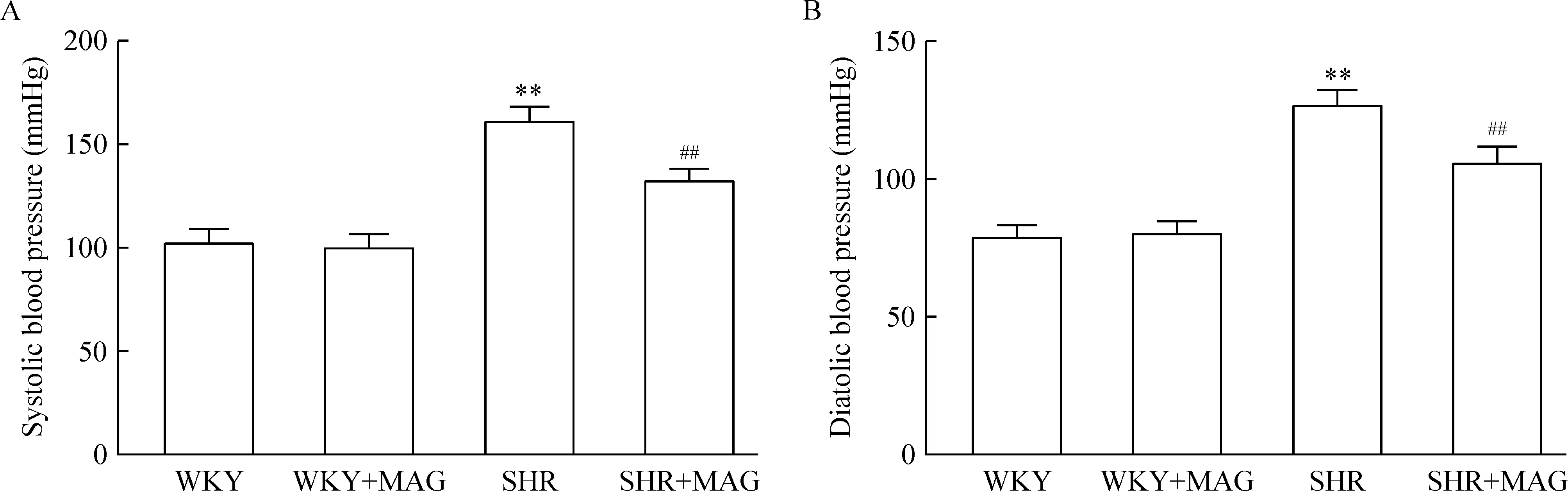
Figure 1. The effect of magnolol (MAG) on systolic blood pressure (A) and diastolic blood pressure (B) in the rats. Mean±SEM. n=8. **P<0.01 vs WKY; ##P<0.01 vs SHR.
2 厚朴酚对胰岛素诱导的血管舒张效应的影响
如图2A所示,SHR组大鼠的主动脉血管对胰岛素诱导的舒张效应明显低于WKY组,说明SHR大鼠血管胰岛素敏感性显著降低可能发生了血管胰岛素抵抗。厚朴酚灌胃3周后SHR主动脉血管对胰岛素诱导的舒张效应明显高于未用药的SHR组,说明厚朴酚具有增强SHR血管胰岛素敏感性的作用,但用左旋硝基精氨酸甲酯(Nω-niotro-L-arginine methyl ester,L-NAME)或去内皮处理后该作用消失,见图2D。此外,ACh和S-亚硝基-N-乙酰青霉胺(S-nitroso-N-acetyl penicillamine, SNAP)都能引起SHR和WKY大鼠主动脉血管的舒张效应,但它们引起的血管舒张效应并没有显著差异,见图2B~C,提示SHR组大鼠血管胰岛素敏感性降低不是内皮释放NO功能或平滑肌舒张功能受损,而是其血管内皮胰岛素信号通路受损所致。
3 厚朴酚对血管PPARγ和TRB3的表达及胰岛素Akt/eNOS信号通路的影响
如图3所示,与WKY组相比,SHR组大鼠血管组织TRB3表达显著增加,PPARγ表达无显著变化,Akt和eNOS磷酸化显著降低,而厚朴酚可显著上调其血管组织PPARγ的表达水平及Akt、eNOS磷酸化水平,下调TRB3的表达。这些结果提示厚朴酚可能通过增加PPARγ表达及减少TRB3表达来增强胰岛素信号转导,从而增强SHR血管胰岛素敏感性。
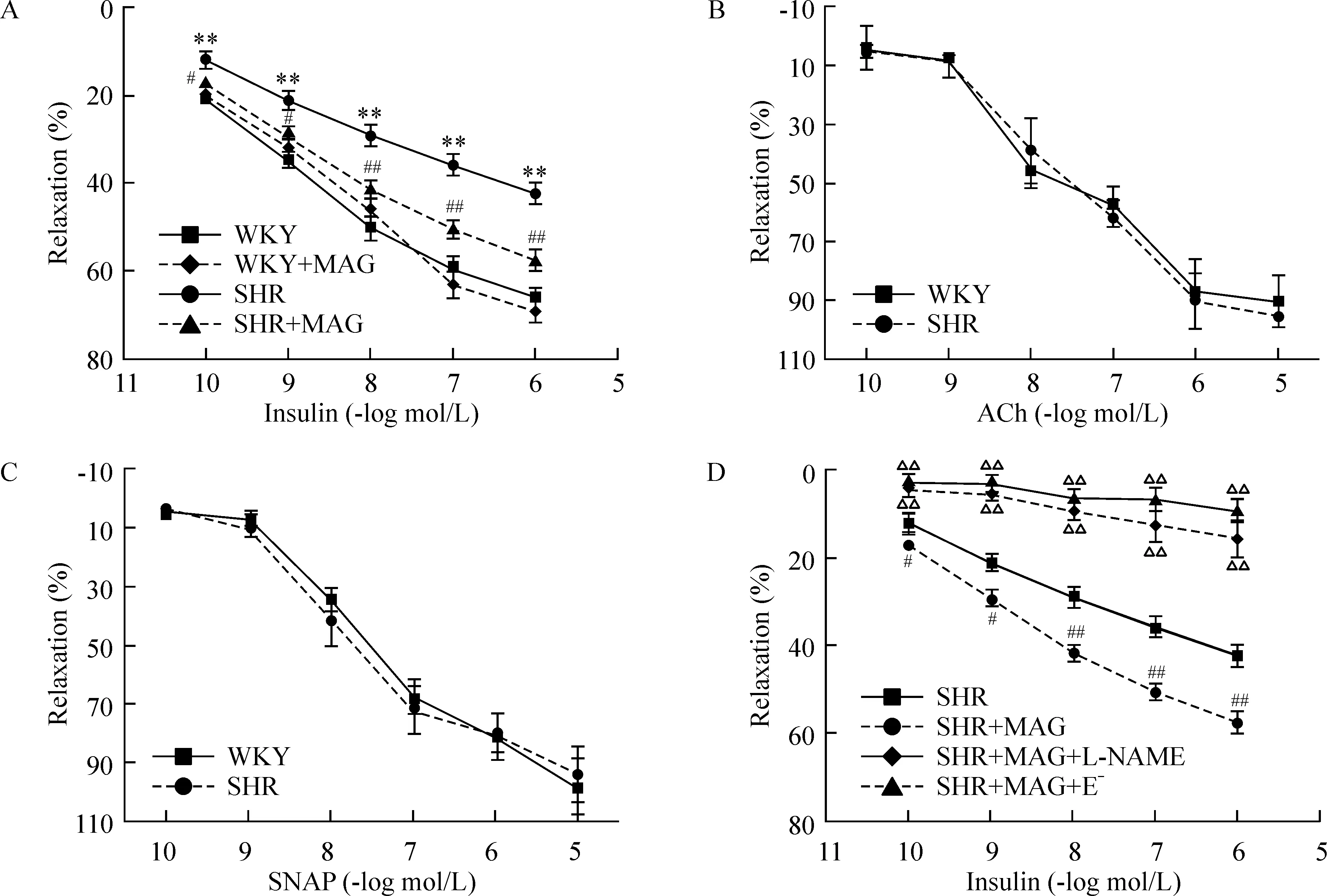
Figure 2. Impairment of insulin-induced vasodilatation and the effect of magnolo(MAG)l on insulin-induced vasodilatation in aortic segments from rats.SNAP: S-nitroso-N-acetyl penicillamine; L-NAME: Nω-nitro-L-arginine methyl ester; E-: endothelium denudation. Mean±SEM. n=6. **P<0.01 vs WKY; #P<0.05, ##P<0.01 vs SHR; ∆∆P<0.01 rs SHR+MAG.
4 厚朴酚对HUVECs 的PPARγ和TRB3表达及胰岛素Akt/eNOS信号通路的影响
如图4所示,HUVECs高糖高脂培养18 h,PPARγ的表达减少,TRB3的表达增加,磷酸化的Akt和eNOS显著降低且NO释放减少,但是厚朴酚孵育后改变了这些趋势,最后增加了NO释放。
5 PPARγ拮抗剂阻断厚朴酚增加PPARγ表达及增敏胰岛素对Akt/eNOS信号通路的作用
为更深研究,我们在高糖高脂培养的HUVECs中加入PPARγ拮抗剂双酚丙烷二环氧丙醚(bisphenol adiglycidylether,BADGE)。如图5所示,厚朴酚增加PPARγ的表达、减少TRB3的表达,增强Akt、eNOS磷酸化的作用被BADGE抑制。说明在HUVECs中厚朴酚减少TRB3表达、增敏胰岛素的作用依赖于PPARγ的上调。
讨 论
我国的“高血压前期”发生率为41.3%,其人群10年后发生高血压的比例高达52.6%,且发生高血压相关的心血管事件及死于心血管疾病的概率较血压正常者明显升高,故在高血压前期及早通过改善生活方式或预防用药来防治高血压是有意义的。厚朴酚是中药厚朴的活性成分,具有活血化瘀的功效,在心血管系统的作用主要包括改善缺血/再灌注损伤和抗动脉粥样硬化作用,但是其对血压的影响仍不清楚。我们实验证实,在高血压前期给予厚朴酚干预可显著降低其SBP和DBP,提示厚朴酚高血压前期干预可延缓高血压的进程,这对预防高血压具有临床意义,特别是对那些可能发展为高血压并出现心血管亚临床病变的高血压前期人群,就显得尤其重要。
有一种假设认为胰岛素抵抗不仅是高血压的临床表现,而且是高血压发展的一个因素。我们前期发现,在血压正常的幼年SHR,胰岛素诱导的血管舒张效应减弱,血管组织胰岛素信号通路受损(PI3K/Akt/eNOS)、NO释放减少[9-10]。提示,在高血压前期已经发生了血管胰岛素抵抗,这可能是SHR胰岛素抵抗促发外周血管功能障碍和高血压的机制之一。本研究证实,从高血压前期开始给予SHRs厚朴酚干预3周,可通过增加其血管胰岛素敏感性来降低血压,并且增强其主动脉血管Akt和eNOS磷酸化;在HUVECs中厚朴酚可以减少高糖高脂诱导的胰岛素敏感性受损,增强磷酸化Akt和eNOS表达、促进NO释放。因此,在高血压前期给予厚朴酚干预来恢复胰岛素信号通路可能参与了血管胰岛素增敏和随后的系统血压降低。

Figure 3. The effects of MAG on PPARγ (A) and TRB3 (B) expression, and insulin-stimulated activation of Akt/eNOS (C and D) signaling pathway. Mean±SEM. n=5.*P<0.05 vs WKY; #P<0.05 vs SHR.
有研究表明,与年龄匹配的WKY大鼠相比,SHR血管组织PPARγ表达水平显著下降,血压显著升高[13],激活PPARγ可能对胰岛素信号通路有关的重要基因产生直接作用[12],而厚朴酚在体外可激活PPARγ[14]。我们证实用厚朴酚干预SHR3周,可增强PPARγ表达以及胰岛素信号,并在高糖高脂培养的HUVECs中也观察到此作用,而PPARγ阻断剂抑制了这一作用。提示厚朴酚能够修复下游受损的胰岛素信号通路,即通过活化PPARγ来增加胰岛素诱导的Akt和eNOS磷酸化。此外有研究证实TRB3可通过抑制Akt磷酸化对胰岛素信号通路进行负性调控[11, 15-16]。我们发现,PPARγ拮抗剂阻断了厚朴酚降低TRB3表达的作用,提示厚朴酚可以作为一种PPARγ激动剂,通过增强PPARγ表达与活化来抑制下游TRB3的表达并增加Akt和eNOS的活化来改善血管胰岛素抵抗,最终降低血压。
总之,本研究首次证实,在SHR高血压前期给予厚朴酚干预可改善血管胰岛素抵抗并延缓血压升高,该作用与上调SHRs血管组织PPARγ表达、减少TRB3表达进而增强Akt和eNOS活性有关。这些结果提示厚朴酚有望作为一种早期抗高血压药物在高血压前期使用。
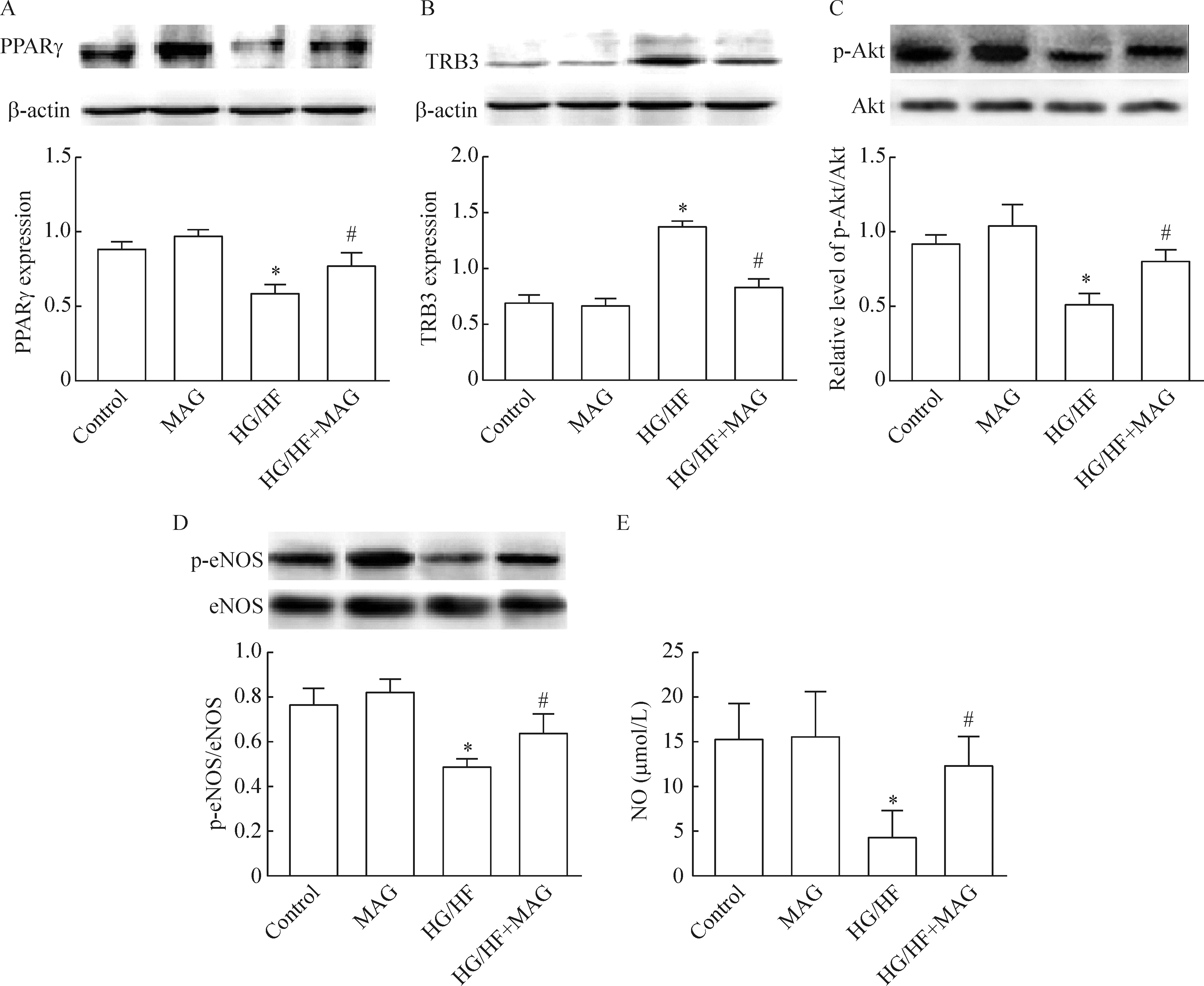
Figure 4. The effects of magnolol on PPARγ expression and insulin-stimulated activation of Akt/ eNOS/NO signaling in the HUVECs. Expression of PPARγ (A), TRB3 (B), p-Akt/Akt (C) and p-eNOS/eNOS (D), and release of NO (E) in the conditioned medium were measured. HG/HF: high glucose/high fat treatment. Mean±SEM. n=5~6. *P<0.05 vs control; #P<0.05 vs HG/HF.
[参 考 文 献]
[1] Gupta AK, McGlone M, Greenway FL, et al. Prehypertension in disease-free adults: a marker for an adverse cardiometabolic risk profile[J]. Hypertens Res, 2010, 33(9):905-910.
[2] Julius S, Nesbitt SD, Egan BM, et al. Trial of preventing hypertension (TROPHY) study investigators. Feasibility of treating prehypertension with an angiotensin-receptor blocker[J]. N Engl J Med, 2006, 354(16):1685-1697.
[3] Huang Y, Su L, Cai X, et al. Association of all-cause and cardiovascular mortality with prehypertension: a meta-analysis[J]. Am Heart J, 2014, 167(2):160-168.
[4] Xing W, Li Y, Zhang H, et al. Improvement of vascular insulin sensitivity by downregulation of GRK2 mediates exercise-induced alleviation of hypertension in spontaneously hypertensive rats[J]. Am J Physiol Heart Circ Physiol, 2013, 305(8):H1111-H1119.
[5] Jin YC, Kim KJ, Kim YM, et al. Anti-apoptotic effect of magnolol in myocardial ischemia and reperfusion injury requires extracellular signal-regulated kinase1/2 pathways in ratinvivo[J]. Exp Biol Med, 2008, 233(10):1280-1288.
[6] Karki R, Ho OM, Kim DW. Magnolol attenuates neointima formation by inducing cell cycle arrest via inhibition of ERK1/2 and NF-κB activation in vascular smooth muscle cells[J]. Biochim Biophys Acta, 2013, 1830(3):2619-2628.
[7] Karki R, Kim SB, Kim DW. Magnolol inhibits migration of vascular smooth muscle cells via cytoskeletal remodeling pathway to attenuate neointima formation[J]. Exp Cell Res, 2013, 319(20):3238-3250.
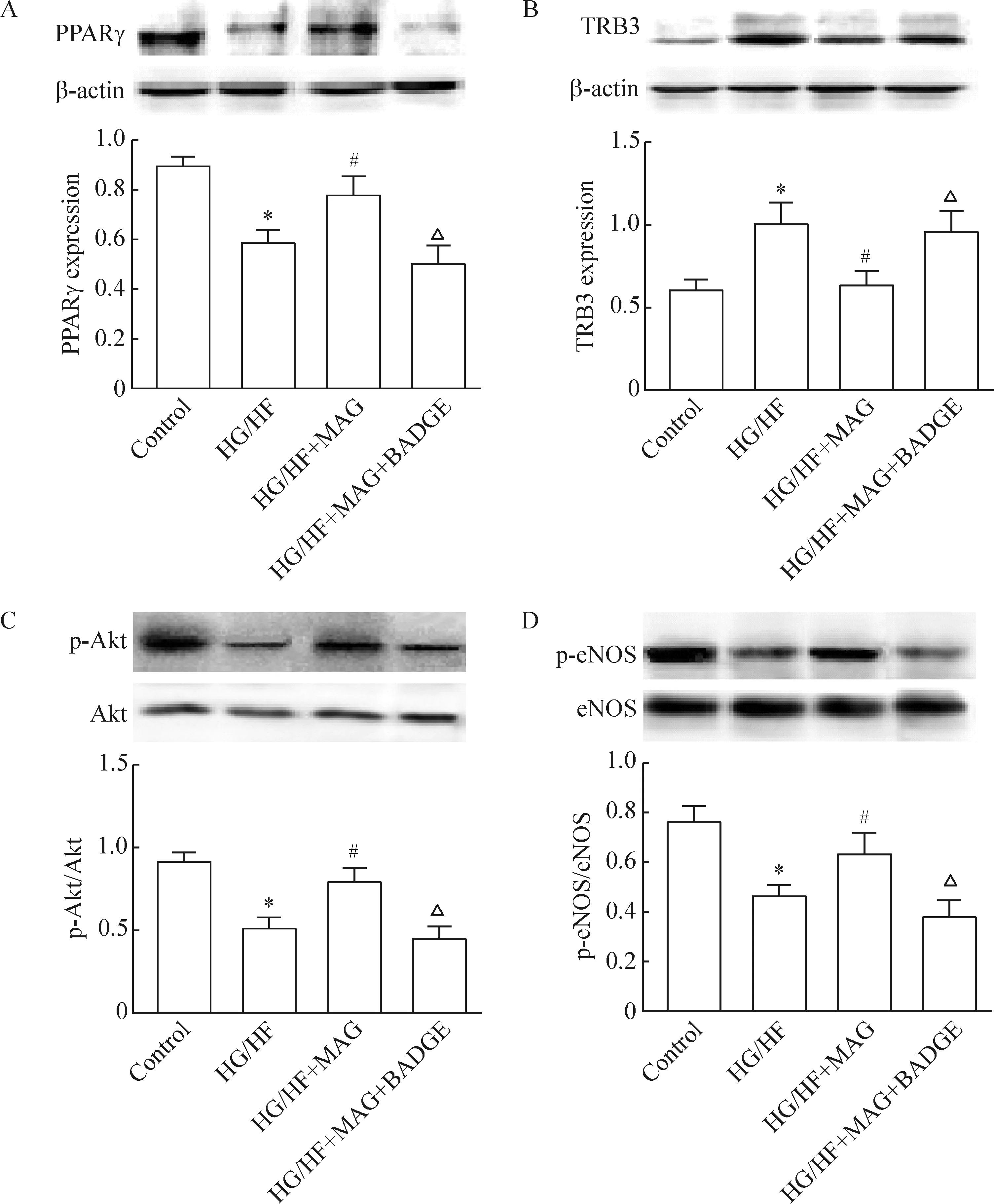
Figure 5. PPARγ antagonist blocked the effects of MAG on PPARγ expression and insulin-stimulated signaling in the HUVECs. Expression of PPARγ (A), TRB3 (B), p-Akt/Akt (C) and p-eNOS/eNOS (D) in the conditioned medium were measured. BADGE: PPARγ antagonist bisphenol adiglycidylether. Mean±SEM. n=5~6.*P<0.05 vs control; ∆#P<0.05 vs HG/HF; △P<0.05 vs HG/HF+MAG.
[8] Kim GD, Oh J, Park HJ, et al. Magnolol inhibits angiogenesis by regulating ROS-mediated apoptosis and the PI3K/AKT/mTOR signaling pathway in mES/EB-derived endothelial-like cells[J]. Int J Oncol, 2013, 43(2):600-610.
[9] Xing W, Yan W, Liu P, et al. A novel mechanism for vascular insulin resistance in normotensive young SHRs: hypoadiponectinemia and resultant APPL1 downregulation[J]. Hypertension, 2013, 61(5):1028-1035.
[10] Li R, Zhang H, Wang W, et al. Vascular insulin resistance in prehypertensive rats: role of PI3-kinase/Akt/eNOS signaling[J]. Eur J Pharmacol, 2010, 628(1-3):140-147.
[11] Du K, Herzig S, Kulkarni RN, et al. TRB3: atribbleshomolog that inhibits Akt/PKB activation by insulin in liver[J]. Science, 2003, 300(5625):1574-1577.
[12] Zhang H, Li J, Li R, et al. Reduced cardiotropic response to insulin in spontaneously hypertensive rats: role of peroxisome proliferator-activated receptor-gamma-initiated signaling[J]. J Hypertens, 2008, 26(3):560-569.
[13] Wu L, Wang R, De Champlain J, et al. Beneficial and deleterious effects of rosiglitazone on hypertension development in spontaneously hypertensive rats[J]. Am J Hypertens, 2004, 17(9):749-756.
[14] Fakhrudin N, Ladurner A, Atanasov AG, et al. Compu-ter-aided discovery, validation, and mechanistic characte-rization of novel neolignan activators of peroxisome prolife-rator-activated receptor gamma[J]. Mol Pharmacol, 2010, 77(4):559-566.
[15] Ijuin T, Takenawa T. SKIP negatively regulates insulin-induced GLUT4 translocation and membrane ruffle formation[J]. Mol Cell Biol, 2003, 23(4):1209-1220.
[16] Prudente S, Hribal ML, Flex E, et al. The functional Q84R polymorphism of mammalian Tribbles homolog TRB3 is associated with insulin resistance and related cardiovascular risk in Caucasians from Italy[J]. Diabetes, 2005, 54(9):2807-2811.

