Nodosin对HepG2细胞株的增殖抑制作用及对Bcl-2和Bax表达的影响*
海广范, 牛秉轩, 李品品, 郭兰青, 崔泰震, 李生莹
(新乡医学院 1药学院, 2 第三附属医院, 3 护理学院, 河南 新乡 453003)
肝癌又被称为癌中之王,死亡率非常高,据统计,每年全球肝癌发病率位居恶性肿瘤发病率的第5位,死亡率居第3位[1-2],其中55%的病例发生在中国[3]。肝癌的治疗方法有多种,如根治手术治疗、放疗、靶向治疗等治疗方法,其中,药物治疗即化疗在肝癌的治疗中仍占有重要地位[4]。但是目前化疗药物仍存在毒副作用大、肿瘤细胞对药物产生耐药、患者难以耐受等方面的问题,因此毒性作用小、不易耐药的新的抗癌药物的开发和研究成为研究的热点。
溪黄草为唇形科(Labiatae)香茶菜属(Isodon)植物,狭基线纹香茶菜[Isodonlophanthoides(Buch. Ham. ex D. Don) Hara var.gerardianus(Benth.) Hara] 为溪黄草的主要资源[5]。溪黄草为民间常用草药,俗称土黄连,具有凉血散瘀、退黄去湿、清热解毒等功效,可用于肝炎、痢疾、胆囊炎、跌打肿痛等病症的治疗,后研究发现溪黄草具有拮抗细菌和病毒感染、抗肿瘤等的防治作用[6]。Nodosin是从溪黄草中提取出来的有效抗癌成分,其主要化学结构是贝壳杉烷骨架的二萜,见图1。

Figure 1. Chemical structure of nodosin.
研究发现,nodosin可有效保护受损的肝脏,对移植肝脏具有显著的保护作用,该作用与血红素加氧酶1表达增加关系密切[7-9]。海广范等[10]研究发现,nodosin对HL60、LoVo、SGC7901和U87细胞都有一定程度的抑制作用,证实了nodosin体外拮抗肿瘤细胞增殖的作用,但该作用是怎么发挥的,具体作用机制尚不清楚。因此,我们以HepG2细胞为研究对象,探讨nodosin对肝癌细胞株的生长抑制作用及其作用机制,为肝癌的治疗和预防提供理论依据和技术支撑,同时为研发新的抗癌药物提供依据。
材 料 和 方 法
1 主要试剂材料
四甲基偶氮唑盐(MTT)和新生小牛血清购自郑州博兴生物科技有限公司;二甲基亚砜(DMSO)和荧光标记素购自威佳生物科技有限公司;DMEM培养液为Gibco产品;鼠抗人Bcl-2和Bax抗体为武汉博士德生物技术公司产品。Nodosin由新乡医学院药学院提供,高效液相色谱法测定其纯度为95.5%。
2 方法
2.1细胞培养 HepG2细胞(人肝癌细胞株)由新乡医学院药学院药理学教研室提供,在-196 ℃液氮中冻存,由本实验室体外传代培养。按照贴壁细胞的培养方法把HepG2细胞于37 ℃、5% CO2饱和湿度的培养箱中常规培养。2 d换液1次,3 d左右传代。
2.2不同浓度nodosin对HepG2细胞形态学的影响 取对数生长期的HepG2细胞,将其浓度调整为5×107cells/L,以100 μL/well接种于96孔培养板,置于37 ℃、5%CO2培养箱内培养,24 h后更换培养液并加入nodosin,使药物浓度分别为1.25、2.5、5、10和20 μmol/L,每个浓度均设置6个复孔,并设置空白对照组。24 h后于倒置显微镜下观察细胞形态。
2.3MTT法检测不同浓度nodosin对HepG2细胞生存率的影响 取对数生长期的HepG2细胞,按照每孔4×103个细胞的数量把细胞接种于96孔板, 24h后更换培养液,加入nodosin,使药物浓度分别为1.25、2.5、5、10和20μmol/L,每个浓度均做6个平行孔,同时设6个空白对照孔,24h后倾倒培养液,每孔加入5g/LMTT15μL,4h后加入DMSO150μL,室温放置30min后,用酶标仪在570nm波长条件下,测定各孔吸光度(A),并计算其半数抑制浓度(IC50)。抑制率(%)=1-测定组A值/空白对照组A值×100%。
2.4流式细胞术检测不同浓度nodosin对HepG2细胞凋亡率的影响 取对数生长期HepG2细胞,按照每孔2×106细胞量把细胞接种于6孔板中,24 h后更换培养液,加入nodosin,使每孔的药物浓度分别为1.25、2.5、5、10和20 μmol/L,同时设置阴性对照组,24 h后收集细胞,PI染色,流式细胞术检测细胞凋亡率。
2.5Bcl-2和Bax表达的检测 取对数生长期HepG2细胞,按照每孔2×106细胞量把细胞接种于6孔板中,24h后更换培养液,加入nodosin,使每孔的药物浓度分别为1.25、 2.5、5、 10和20μmol/L,同时设置阴性对照组,24h后收集细胞,用4 ℃、70%乙醇固定1h,加入抗体和荧光素过夜,加入Ⅱ抗孵育2h,然后收集细胞,吹散,上机检测阳性细胞数量。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用方差分析进行组间差异比较,采用LSD-t检验进行两两比较。以P<0.05为差异有统计学意义。用SPSS 16.0统计软件处理。
结 果
1 不同浓度nodosin对HepG2细胞形态学的影响
HepG2细胞正常对照组可见细胞饱满,贴壁生长旺盛,细胞呈椭圆形或“燕麦”状,排列规整,细胞间隙明显。1.25 μmol/L nodosin处理细胞形态改变不明显,2.5和5 μmol/L浓度组的细胞形态与正常对照组相比漂浮细胞增加,部分细胞变圆形,凋亡细胞明显增加;10和20 μmol/L浓度组的细胞缩小,悬浮细胞明显增多,培养液中有部分细胞碎片,除凋亡细胞外,细胞坏死现象明显,20 μmol/L浓度组的细胞基本全部死亡,正常细胞少见,见图2。
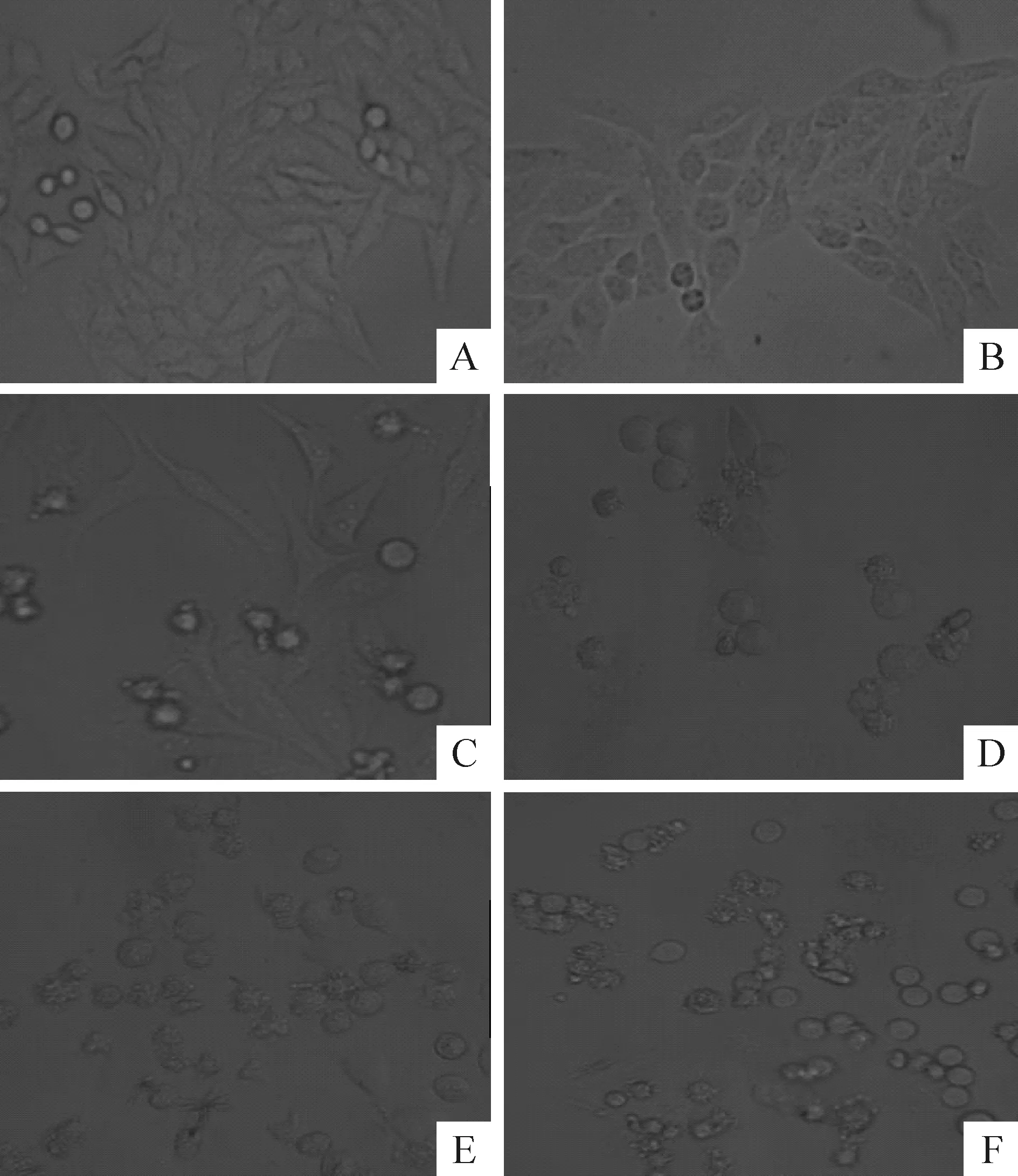
Figure 2. The effect of different concentrations of nodosin on HepG2 cell morphology under inverted microscope(×100).A:control group; B: HepG2 cells treated with 1.25 μmol/L nodosin for 24 h; C: HepG2 cells treated with 2.5 μmol/L nodosin for 24 h; D: HepG2 cells treated with 5 μmol/L nodosin for 24 h; E: HepG2 cells treated with 10 μmol/L nodosin for 24 h; F: HepG2 cells treated with 20 μmol/L nodosin for 24 h.
2 Nodosin对HepG2细胞增殖的抑制作用
与正常对照组相比,不同浓度的nodsin均显著增加细胞生长抑制率(P<0.05),说明不同浓度的nodosin均可抑制HepG2细胞的生长,20 μmol/L剂量组抑制作用最显著,其作用呈现明显的量效关系,IC50值为5.03 μmol/L,见表1。
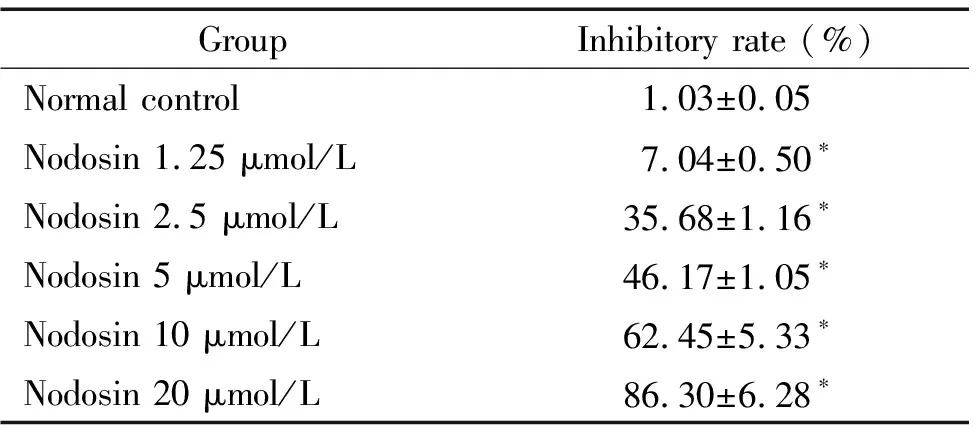
表1 不同浓度nodosin对HepG2细胞生长的抑制作用
*P<0.05vsnormal control.
3 细胞凋亡率的检测结果
阴性对照组、1.25 μmol/L组、2.5 μmol/L组、5 μmol/L组、10 μmol/L组和 20 μmol/L组的凋亡率(%)分别为:0.83±0.00、4.26±0.17、13.55±2.06、21.80±3.94、35.14±6.00和47.93±3.68。
4 Bcl-2和Bax的表达
如图3所示,5 μmol/L组Bcl-2阳性细胞比率明显降低(P<0.05),10 μmol/L组和20 μmol/L组Bcl-2阳性细胞比率降低更为显著(P<0.01)。而1.25 μmol/L组Bax阳性细胞比率明显增加,20 μmol/L组Bax阳性细胞比率达到最高值(P<0.01),见图4,并且两者的表达均呈明显的剂量-效应依赖关系。
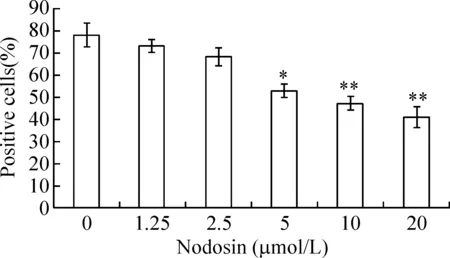
Figure 3. The detection of Bcl-2 positive cells by flow cytometry.Mean±SD.n=6.*P<0.05,**P<0.01 vs 0 μmol/L.
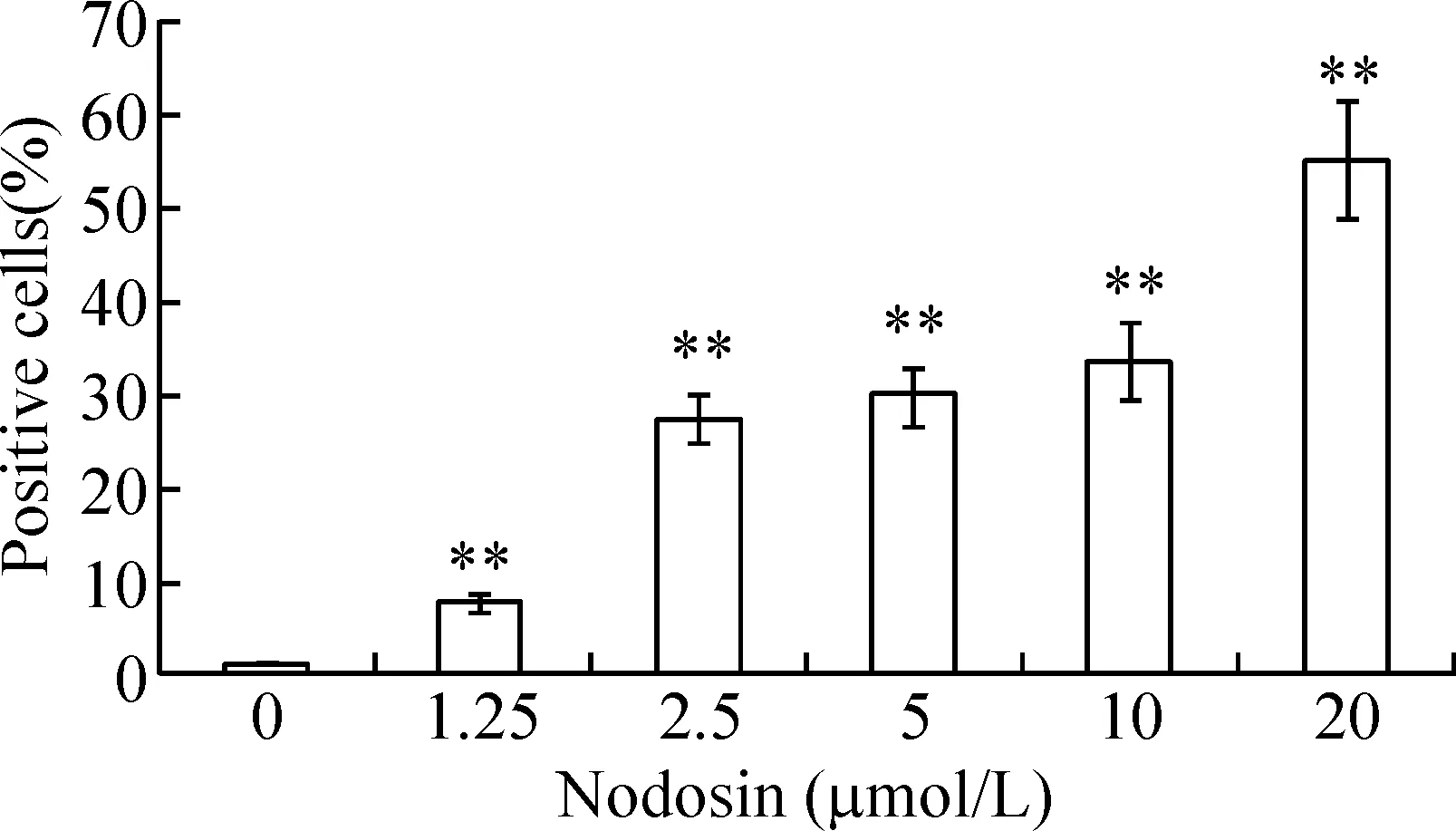
Figure 4. The detection of Bax positive cells by flow cytometry.Mean±SD.n=6.**P<0.01 vs 0 μmol/L.
讨 论
香茶菜属植物具有广泛的抗癌活性,如肝癌、胃癌、白血病等,溪黄草作为香茶菜属植物也具有类似的抗癌特性。该药在我国分布广泛,盛产于河南、河北等地,常用于呼吸道疾病、胃肠道疾病以及免疫代谢性疾病等多种疾病的治疗[11]。已有大量的资料证明,该类植物除了具有抗菌、消炎、抗风湿等作用外,还能明显缩小多种实体瘤的体积,具有防病、治病等多种功效。Nodosin是溪黄草的重要抗癌活性成分,属于二萜类化合物,在前期研究报道中nodosin具有良好的拮抗HepG2细胞生长增殖的活性,鉴此我们设计了该项实验。
实验结果提示不同浓度的nodosin对HepG2细胞具有明显的抑制作用,并且该抑制作用呈现明显的量效关系,形态学结果表明20 μmol/L nodosin可使细胞基本全部死亡,其IC50值为5.03 μmol/L,表明nodosin对该细胞株具有比较强烈的增殖抑制作用。
细胞凋亡是指程序性细胞死亡[12],在凋亡过程中细胞皱缩,形成凋亡小体,但不会释放炎症物质[13]。很多植物性抗癌药物都可以诱导细胞凋亡,那么nodosin是否是通过诱导细胞凋亡而抑制HepG2细胞的增殖?细胞凋亡包括内源性途径和外源性途径,nodosin诱导细胞凋亡是通过哪种途径完成的呢?鉴此,我们首先通过倒置显微镜观察细胞的形态学改变,结果显示:不同浓度nodosin作用于HepG2细胞24 h后,细胞皱缩,大量细胞出现死亡,流式细胞术检测表明,不同浓度的nodosin均可诱导HepG2细胞的凋亡,并且也呈现明显的量效关系,提示nodosin对HepG2细胞的抑制作用是通过诱导细胞凋亡实现的。同时,形态学检测结果显示20μmol/L nodosin可使HepG2细胞大部分死亡,凋亡率为47.93%,提示nodosin在诱导 HepG2细胞凋亡的同时也可能存在其它诱导细胞死亡的方式,也可能与实验误差关系密切。 Bcl-2和Bax蛋白是调控细胞凋亡的2种重要蛋白质,Bcl-2发挥保护细胞,减少细胞凋亡的作用,而Bax则发挥诱导细胞凋亡的作用,两者在细胞内的表达维持在平衡状态,共同调控着细胞更新,如果这种平衡被打破,则容易诱发线粒体内细胞色素C的释放,从而诱导细胞凋亡。结果显示:随着nodosin浓度的增加Bcl-2蛋白表达减少,而Bax表达增加,提示nodosin可能激发了内源性细胞凋亡途径,诱发Bcl-2和Bax的失衡,进而诱导HepG2细胞凋亡。
Nodosin诱导HepG2细胞凋亡是否还存在其它途径?譬如对p53、caspase家族的影响尚未见报道,因此,nodosin诱导HepG2细胞凋亡的其它作用机制尚待进一步探讨。
[参 考 文 献]
[1] 左衔海.恶性肿瘤转移机制研究进展[J].医学研究生学报,2008, 21(3):293-296.
[2]El-SerngHB,RudolphKL.Hepatocellularcarcinoma:epidemiologyandmolecularcarcinogenesis[J].Gastroenterology, 2007,132(7):2557-2576.
[3] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].CA Cancer J Clin, 2005, 55(2):74-108.
[4] 曾益新.肿瘤学[M].第2版.北京:人民卫生出版社,2003:395.
[5] 陈 晓,廖仁安,谢庆兰,等.溪黄草化学成分的研究[J].中草药, 2000, 31(3):171-172.
[6] 孙 奎,董 辉,曾汉英,等.单味溪黄草对小鼠移植性腹水型肝癌的防治效果观察[J].第四军医大学吉林军医学院学报, 2002, 24(2):65-66.
[7] 杜隽铭,吴 萍,孙丽娟,等. 溪黄草有效成分nodosin灌注对大鼠移植肝脏病理损伤的影响[J].器官移植, 2011,2(1):9-11.
[8] 王震宇,杜隽铭,丁 晶,等.溪黄草有效成分Nodosin保留灌注对供肝缺血期的保护作用[J]. 广东医学, 2010, 31(5):540-542.
[9] 杜隽铭,孙丽娟,李济宇,等. Nodosin灌注对离体SD大鼠肝脏组织血红素加氧酶-1表达的影响[J]. 华东理工大学学报:自然科学版, 2009, 10(3):373-377.
[10] 海广范,闫 琰,刘巨源,等.Enmein、senrrinB、nodosin和lasiodonin对HL60细胞株和LOVO细胞株的增殖抑制作用[J].新乡医学院学报,2008, 25(6):564-566.
[11] 孙治坤,潘 静,杨红旗,等.PI3K/Akt途径在Aβ诱导细胞凋亡过程中的作用[J].中国病理生理杂志,2009, 25(1):84-88.
[12] 李晋菊,丁碧蓝,许晓玲,等.胰岛素样生长因子Ⅰ通过改善线粒体功能保护新生大鼠心肌细胞免于凋亡[J].中国病理生理杂志,2013,29(9):1585-1589.
[13] Jiang X, Wang X. Cytochrome C promotes caspase-9 activation by inducing nucleotide binding to Apaf-1[J]. J Biol Chem, 2000, 275(40):31199-31203.

