着色性干皮病基因D和p53对HBV复制的影响*
丁 浩, 张吉翔
(南昌大学第二附属医院消化内科,江西 南昌 330006)
着色性干皮病基因D(xeroderma pigmentosum D,XPD)是转录因子ⅡH(transcription factor ⅡH,TFⅡH)的其中一个组份[1]。已有研究发现,XPD可保护宿主细胞,阻止HIV和MMLV的感染,并下调已整合病毒的表达[2]。所以我们提出假设:XPD亦能抑制乙型肝炎病毒(hepatitis B virus,HBV)复制。本研究组已经证实,XPD能升高p53的表达[3-4]。因此,我们亦可提出假设:XPD可能通过p53通路抑制HBV复制。为证实上述假设,本研究把重组人XPD质粒用脂质体转染进入人肝癌细胞株HepG2.2.15(整合并能复制HBV的HepG2细胞),并使用pifithrin-α(p53抑制剂)孵育细胞,然后测定乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)和乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)的mRNA水平,检测培养上清液中HBsAg、HBeAg和HBV-DNA含量,同时测定细胞内核心颗粒中HBV-DNA含量,探讨XPD与p53对乙型肝炎病毒复制的影响。
材 料 和 方 法
1 材料
肝癌细胞株HepG2.2.15是由复旦大学附属华山医院传染科张轶俊博士惠赠;DMEM培养基购自HyClone;胎牛血清购自Gibco;G418购自Solarbio;重组质粒pEGFP-N2/XPD由本实验室构建,pEGFP-N2/XPD已经通过PCR反应、酶切及基因测序鉴定[5];RNA提取试剂Trizol和脂质体LipofectamineTM2000购自Invitrogen;p53抑制剂pifithrin-α购自Sigma;逆转录试剂盒购自Fermentas;引物购自Generay Biotech;2×Taq PCR Master Mix购自天根生物;HBsAg和HBeAg的ELISA检测试剂盒购自广东中山生物工程有限公司; VERSANT HBV branched DNA (bDNA) 检测试剂盒购自Bayer;HBV-DNA荧光定量PCR试剂盒购自广州中山大学达安基因公司。
2 方法
2.1细胞培养、质粒转染和pifithrin-α的孵育 把HepG2.2.15细胞放置于含有10%胎牛血清、400 mg/L G418和双抗(100 mg/L链霉素和1×105U/L青霉素)的DMEM培养瓶中,在37 ℃、5% CO2和饱和湿度的培养箱中培养。以每孔1×105细胞的密度把细胞铺于6孔板中,24 h后细胞融合率为90%。使用LipofectamineTM2000将空载质粒pEGFP-N2和重组质粒pEGFP-N2/XPD转染进入细胞,质粒4.0 μg/well,脂质体10 μL/well介导转染。转染后的第2天使用20 μmol/L pifithrin-α孵育细胞24 h。将实验分为5组:(1)空白对照组;(2) pEGFP-N2组;(3) pEGFP-N2/XPD组;(4)pEGFP-N2/XPD+ pifithrin-α组;(5)pifithrin-α组。
2.2RT-PCR RNA抽提和逆转录参照试剂盒说明书进行。XPD上游引物5’-TCTGCCTCTGCCCTATGAT-3’,下游引物5’-CGATTCCCTCGGACACTTT-3’,产物大小为363 bp;HBsAg上游引物5’-AACATCAACTACCAGCACG-3’,下游引物5’-CACTGAACAAATGGCACTA-3’,产物大小为210 bp;HBeAg上游引物5’-CCTGCTCAAGGCAACTCT-3’,下游引物5’-GAAAGCCCTACGAACCAC-3’, 产物大小为182 bp;HBx上游引物5’-CACTTCGCCTCACCTCTG-3’,下游引物5’-TCGGTCGTTGACATTGCT-3’, 产物大小为112 bp;β-actin上游引物5’-CGGGAAATCGTGCGTGAC-3’,下游引物5’-TGGAAGGTGGACAGCGAGG-3’,产物大小为434 bp。PCR反应体系配制如下:上、下游引物各1 μL,cDNA 500 ng,2×Taq PCR Master Mix 12.5 μL,补ddH2O至25 μL终体积。以下列条件进行PCR 反应:预变性,1个循环, 94 ℃ 5 min;PCR反应,35个循环,94 ℃ 40 s,56 ℃ 40 s,72 ℃ 55 s;延伸,72 ℃ 7 min。取5 μL PCR反应产物进行琼脂糖凝胶电泳,使用紫外透射仪观察电泳结果并拍照。拍照结果用BANDLEAD 3.00软件进行分析,以目的条带/β-actin的吸光度比值进行对比。
2.3ELISA配洗涤液,将浓缩洗涤液用蒸馏水或ddH2O以1∶25的比例稀释。将待测样品以50μL/well加入包被板,并设阴性对照、阳性对照和空白对照各2孔(阴性、阳性对照孔分别加入相应对照血清各50μL,空白对照孔则加入100μL洗涤液)。立即加入酶标记物50μL/well(空白对照孔则不加),混匀。覆盖封板胶,放置于37 ℃避光孵育30min。使用洗涤液洗板5次,每次均静置1min,反扣晾干。加入底物A、B液各50μL/well,37 ℃避光显色10min后,加入终止液50μL/well。使用酶标仪450nm(单波长)以空白对照孔调零,或者用450nm/630nm(双波长),检测各孔吸光度(A)。
2.4HBV-DNA荧光定量PCR 取100 μL细胞培养上清液加入等量的DNA浓缩液,充分混匀、离心10 min。倒去上清,沉淀中加入30 μL DNA提取液,充分混匀、离心数秒,100 ℃水浴孵育10 min,离心后备用。按试剂盒说明书处理阴性质控品和阳性质控品。按比例(HBV PCR反应液40 μL/份+Taq酶3 μL/份)取相应量PCR反应液和Taq酶,充分混匀,按每管43 μL分装至0.2 mL EP管中备用。向准备好试剂的0.2 mL EP管中分别加入处理后的样品(包括标本、阴性质控品、临界阳性质控品和强阳性质控品)上清液2 μL,离心,随后放入样品槽中。设置荧光定量PCR仪条件:93 ℃ 2 min;93 ℃ 45 s,55 ℃ 60 s,10个循环;93 ℃ 30 s,55 ℃ 45 s,30个循环。
2.5HBVbDNA实验 将6孔板中的经实验处理的细胞以PBS洗涤2次,用细胞裂解液将细胞转移至EP管内,离心后保留上清液,加DNaseI和RNaseA37 ℃ 孵育15min后,以EDTA和PEG8000沉淀核心颗粒,然后重悬沉淀,加裂解液孵育过夜,用酚-氯仿-异戊醇抽提,干燥后溶于50μL双蒸水中。应用bDNA试剂盒定量检测HBV-DNA的滴度,其最低检测值为0.7GEq/L。
3 统计学处理
实验均重复6次,使用统计学软件SPSS 13.0分析,数据用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 pEGFP-N2/XPD和pifithrin-α对HBsAg、HBeAg和HBx mRNA表达的影响
RT-PCR结果显示,与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组和pEGFP-N2/XPD+pifithrin-α组XPD mRNA的表达明显增多(均P<0.01);与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组HBsAg、HBeAg和HBx mRNA的表达明显减少(均P<0.01);与空白对照组相比,pifithrin-α处理组HBsAg、HBeAg和HBx mRNA的表达明显增多(P<0.05或P<0.01);与转染重组质粒pEGFP-N2/XPD组相比,pEGFP-N2/XPD+pifithrin-α组HBsAg、HBeAg和HBx mRNA的表达明显增多(均P<0.01);而空白对照组与转染空载质粒pEGFP-N2组之间相比,差异无统计学意义(均P>0.05),见图1。
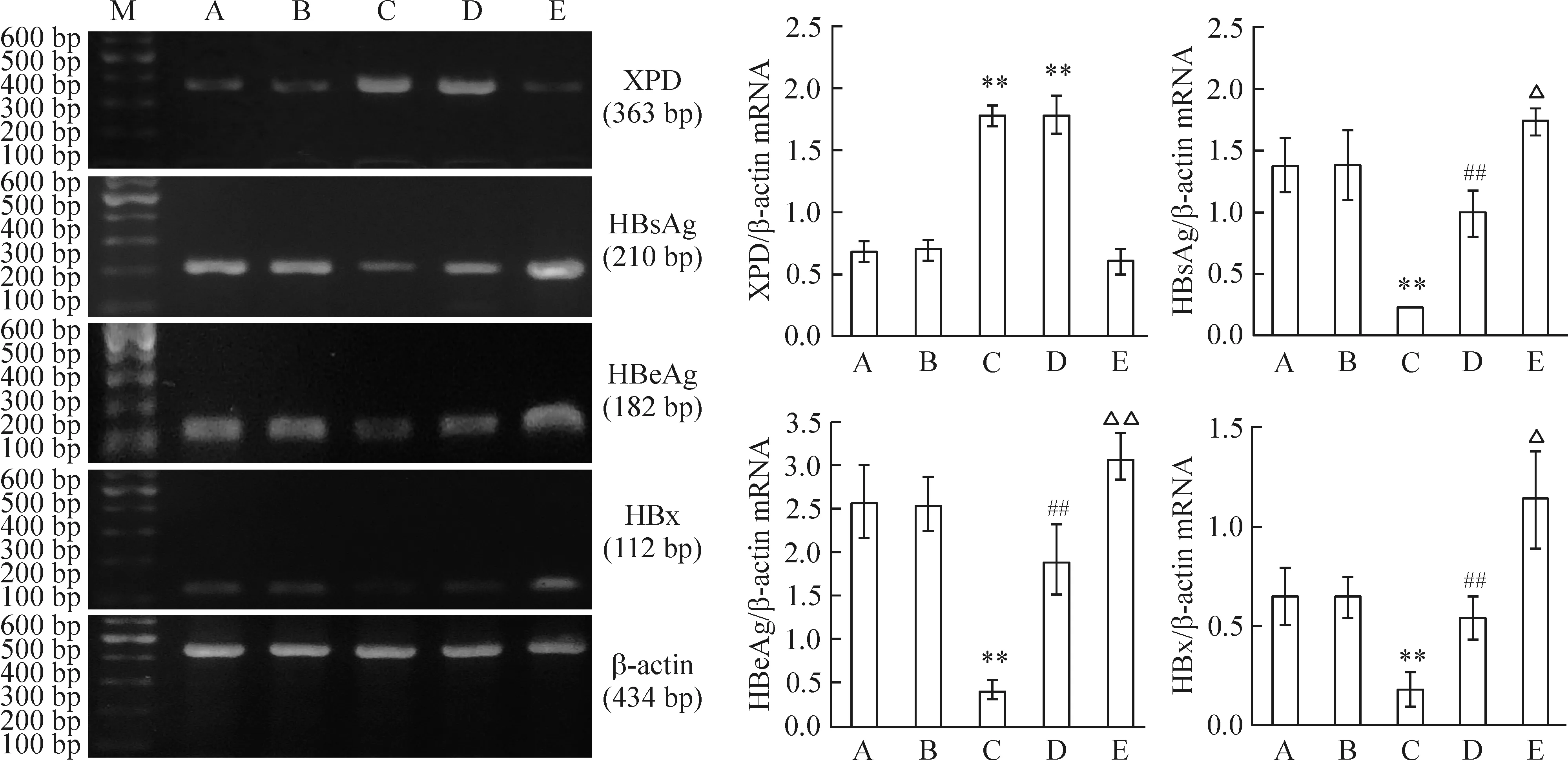
Figure 1. The changes of mRNA expression levels of XPD, HBsAg, HBeAg and HBx in HepG2.2.15 cells treated with pEGFP-N2/XPD and pifithrin-α.M: 100 bp marker; A: blank control group; B: pEGFP-N2 group; C: pEGFP-N2/XPD group; D: pEGFP-N2/XPD+pifithrin-α group; E: pifithrin-α group.Mean±SD.n=6.**P<0.01 vs A or B; ##P<0.01 vs C;△P<0.01, △△P<0.05 vs A.
2 pEGFP-N2/XPD和pifithrin-α对细胞培养上清液中HBsAg和HBeAg含量的影响
ELISA结果发现,与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组的培养上清液中HBsAg和HBeAg含量明显减少(均P<0.01);与转染重组质粒pEGFP-N2/XPD组相比,pEGFP-N2/XPD + pifithrin-α组的培养上清液中HBsAg和HBeAg含量明显增多(均P<0.01);而空白对照组、转染空载质粒pEGFP-N2组与pifithrin-α组三者之间相比,差异无统计学意义(均P>0.05),见图2。
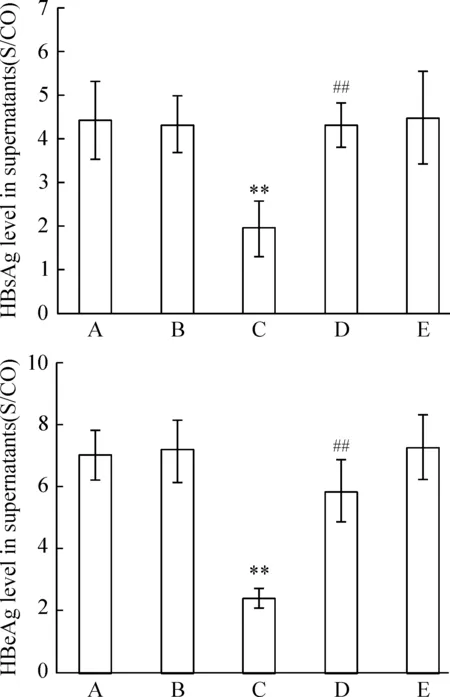
Figure 2. The content of HBsAg and HBeAg in the supernatants of culture medium of HepG2.2.15 cells treated with pEGFP-N2/XPD and pifithrin-α.A: blank control group; B: pEGFP-N2 group; C: pEGFP-N2/XPD group;D: pEGFP-N2/XPD + pifithrin-α group; E: pifithrin-α group.Mean±SD.n=6.**P<0.01 vs A or B; ##P<0.01 vs C
3 pEGFP-N2/XPD和pifithrin-α对培养上清液和细胞内核心颗粒中HBV-DNA含量的影响
荧光定量PCR和bDNA结果显示,与空白对照组和转染空载质粒pEGFP-N2组相比,转染重组质粒pEGFP-N2/XPD组的培养上清液和细胞内核心颗粒中HBV-DNA含量明显减少(均P<0.01);与转染重组质粒pEGFP-N2/XPD组相比,pEGFP-N2/XPD + pifithrin-α组的培养上清液和细胞内核心颗粒中HBV-DNA含量明显增多(均P<0.01);而空白对照组、转染空载质粒pEGFP-N2组与pifithrin-α组三者之间相比,差异无统计学意义(均P>0.05),见图3。
讨 论
p53基因是公认的抑癌基因,当DNA受损时,p53先诱导细胞进入细胞周期的G1期,从而抑制细胞的增殖,直到受损DNA被修复。如果DNA不被修复,p53就介导受损细胞发生凋亡[6]。XPD是剪切修复基因,其蛋白有着重要的核酸剪切修复能力[7]。当DNA受损时,XPD能活化DNA的损伤检控点,能修复受损DNA,增加基因稳定性,从而避免基因突变[8]。本研究组既往的实验已经证实,XPD能上调肝癌细胞中p53的表达[3-4]。
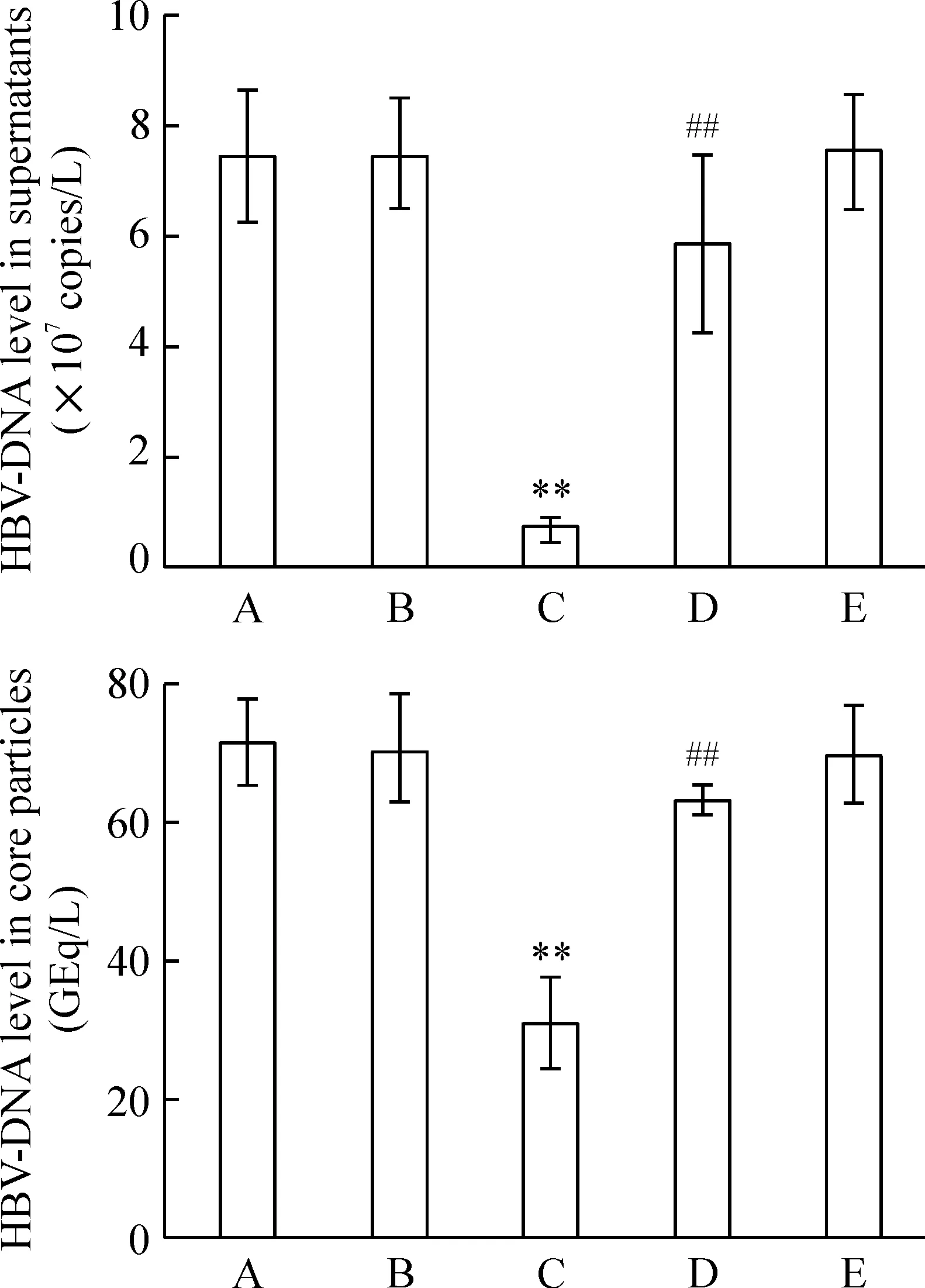
Figure 3. The content of HBV-DNA in the supernatants of culture medium and the core particles in the HepG2.2.15 cells treated with pEGFP-N2/XPD and pifithrin-α.A: blank control group; B: pEGFP-N2 group; C: pEGFP-N2/XPD group; D: pEGFP-N2/XPD + pifithrin-α group; E: pifithrin-α group.Mean±SD.n=6.**P<0.01 vs A or B; #P<0.01 vs C.
在我国范围内,乙型肝炎是造成慢性肝炎、肝纤维化以及肝癌的主要原因[9]。HBV大量复制诱发了宿主肝细胞针对HBV的免疫应答,而后者导致了宿主肝细胞的损害,从而造成了肝炎和肝纤维化[10]。所以,抑制HBV复制以及彻底清除宿主肝细胞内的HBV是治疗乙型肝炎的目标。但是,现在针对乙型肝炎的治疗方法均不甚理想,效果有限。
Yoder等[2]的研究结果发现,XPD的核酸剪切修复功能的丧失能使得病毒MMLV在宿主细胞内的表达升高,即XPD能下调已整合的MMLV表达。所以,我们提出假设:XPD亦能抑制HBV在宿主细胞内复制。而且如前所述, XPD能升高p53表达[3-4]。因此,我们假设:XPD可能是通过p53通路来阻断HBV复制。
为证实上述假设,本研究将重组质粒pEGFP-N2/XPD转染进入肝癌细胞株HepG2.2.15,使得XPD表达增高,同时使用pifithrin-α抑制p53,然后检测HBV复制的变化。需要指出的是,本研究使用的人肝癌细胞株HepG2.2.15是整合了HBV并能复制HBV的HepG2细胞株[11]。另外,本研究使用到的pifithrin-α是一种p53抑制剂,能可逆性阻断p53依赖的基因转录激活[12-13]。
本研究发现,转染重组质粒pEGFP-N2/XPD能下调HBsAg、HBeAg和HBx mRNA的表达,减少培养上清液中HBsAg、HBeAg和HBV-DNA含量,并减少细胞内核心颗粒中HBV-DNA含量。这表明,XPD可抑制HBV复制。本研究还发现,XPD上述作用均能被pifithrin-α阻断。这表明,XPD阻断HBV复制是通过p53通路而实现的。
本研究还发现,与空白对照组相比,pifithrin-α能上调HBsAg和HBeAg mRNA的表达,然而对培养上清液中的HBsAg、HBeAg和HBV-DNA的含量却没有明显影响。就本研究结果来看,我们分析其可能原因是: pifithrin-α降低细胞内HBsAg和HbeAg mRNA的表达幅度原本较小,而HBsAg、HBeAg及HBV-DNA从细胞内释放进入培养上清液后浓度即被稀释,这导致了HBsAg、HBeAg及HBV-DNA在培养上清液中的含量被检测时,与空白对照相比无明显差异。
综上所述,XPD可通过p53通路抑制HBV复制。所以,XPD和p53可能成为乙型肝炎抗病毒治疗的分子作用靶点,为治疗乙型肝炎提供新的可能途径。
[参 考 文 献]
[1] Coin F, Proietti De Santis L, Nardo T, et al. p8/TTD-A as a repair-specific TFIIH subunit[J]. Mol Cell, 2006, 21(2):215-226.
[2]YoderK,SarasinA,KraemerK,etal.TheDNArepairgenesXPBandXPDdefendcellsfromretroviralinfection[J].ProcNatlAcadSciUSA, 2006, 103(12):4622-4627.
[3] Wang HY, Xiong GF, Zhang JX, et al. The role of XPD in cell apoptosis and viability and its relationship with p53 and cdk2 in hepatoma cells[J]. Med Oncol, 2012, 29(1):161-167.
[4]DingH,XuJJ,HuangY,etal.XPDcouldsuppressgrowthofHepG2.2.15anddown-regulatetheexpressionofhepatitisBvirusxproteinthroughP53pathway[J].BiochemBiophysResCommun, 2012, 419(4):761-767.
[5] 汤 蕾,张吉翔,熊 瑛. 人着色性干皮病D组基因的克隆及其真核表达[J].生物医学工程学杂志, 2008, 25(3):668-672.
[6]GoldsteinI,MarcelV,OlivierM,etal.Understandingwild-typeandmutantp53activitiesinhumancancer:newlandmarksonthewaytotargetedtherapies[J].CancerGeneTher, 2011, 18(1):2-11.
[7] Hernández-Boluda JC, Pereira A, Cervantes F, et al.A polymorphism in theXPDgene predisposes to leukemic transformation and new nonmyeloid malignancies in essential thrombocythemia and polycythemia vera[J]. Blood, 2012, 119(22):5221-5228.
[8]ZhuQ,WaniG,SharmaN,etal.LackofCAKcomplexaccumulationatDNAdamagesitesinXP-BandXP-B/CSfibroblastsrevealsdifferentialregulationofCAKanchoringtocoreTFIIHbyXPBandXPDhelicasesduringnucleotideexcisionrepair[J].DNARepair(Amst), 2012, 11(12):942-950.
[9] 张香梅,乐晓华,陈培芬,等. 乙型肝炎病毒对肝内TGF-β1/Smads信号通路的作用[J]. 中国病理生理杂志, 2013, 29(12):2218-2222.
[10] 陈林林,谢 青,单晓亮,等. 乙型肝炎病毒X蛋白抑制SFRP5启动子的活性[J]. 中国病理生理杂志, 2013, 29(2):200-204.
[11] Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA[J]. Proc Natl Acad Sci U S A, 1987, 84 (4):1005-1009.
[12]KomarovPG,KomarovaEA,KondratovRV,etal.Achemicalinhibitorofp53thatprotectsmicefromthesideeffectsofcancertherapy[J].Science, 1999, 285(5434):1733-1737.
[13] Javelaud D, Besancon F. Inactivation of p21WAF1sensitizes cells to apoptosis via an increase of both p14ARFand p53 levels and an alteration of the Bax/Bcl-2 ratio[J]. J Biol Chem, 2002, 277(40):37949-37954.

