转录因子Hand2在妊娠期糖尿病胎鼠心脏发育过程中的表达
吴 瑕, 黄婉仪, 韩莎莎, 孙凤杰, 徐 婧, 杨雪松, 柳国胜△
(暨南大学 1附属第一医院新生儿科, 2医学院组织学与胚胎学系,广东 广州 510632)
妊娠期糖尿病(gestational diabetes mellitus,GDM)的发病率在迅速增加,全球GDM的发病率在3%~14%之间[1]。澳洲开展流行病学调查显示亚裔妇女的发病率最高(11.5%),是澳洲妇女发病率的3倍(3.7%)[2]。2006年中国18城市的调查表明,GDM的总体发病率为4.3%。GDM可致胎儿发育异常,尤其是胎儿心脏畸形发生率高且严重影响患儿的生存质量。美国研究显示GDM孕妇其胎儿患心血管畸形(尤其是流出道畸形以及心脏瓣膜发育异常)的几率是正常妊娠的3~5倍[3]。
碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)蛋白是与各种类型的细胞核组织的发育和功能相关的转录因子。Hand1和Hand2是bHLH蛋白家族中最重要的转录因子,尤其对心肌细胞的增殖和分化、心脏发育模式及形态发生和心脏收缩有着重要的调控作用,与先天性心脏病的发生关系密切[4]。学者通过鼠的基因敲除等手段发现,纯合体(Hand2-/-)突变鼠可出现明显的心肌缺陷,这些心肌缺陷主要表现为心管环化障碍、右心室缺失、主动脉弓消失等[5]。本研究旨在了解GDM 胎鼠心脏发育过程中Hand2表达的变化,为深入探讨其在GDM胎鼠心脏发育异常中的作用机制奠定基础。
材 料 和 方 法
1 动物和材料
无交配史的清洁级雌性成年SD大鼠120只,体重(260±18) g,雄鼠60只,体重(301±14) g。采购于广东省医学实验动物中心,动物许可证号为SCXK(粤)2010-0002。
链脲佐菌素(streptozotocin,STZ)购自Sigma; Trizol 提取液购自Invitrogen;Hand2 抗体购自Santa Cruz; SABC试剂盒及DAB显色试剂盒购自武汉博士德生物技术有限公司; 蛋白样品初步定量采用南京凯基生物发展有限公司提供的试剂盒(型号为KGPBCA);其它生化试剂均为进口分装或国产分析纯。
2 方法
2.1动物分组与模型制备[6]将无交配史的清洁级成年SD大鼠雌雄分开喂养,适应性喂养1周后,尾静脉采血测定雌鼠空腹血糖,若血糖>7.1 mmol/L,予以剔除。本实验未剔除任何雌鼠。然后按雌雄比例2∶1合笼,第2天早上取阴道分泌物涂片,见精子之日定为妊娠第0天(E0)。饲养过程中有6只雌鼠未受孕或意外死亡,共有114只雌鼠成功受孕,受孕后单独饲养,随机分配到以下4组。
空白对照组(blank control组,n=24):不加任何干预,受孕后72 h尾静脉采血测定血糖。
GDM组(n=30):将查到精子的大鼠空腹8 h后,用现配的柠檬酸-柠檬酸钠缓冲液(0.l mmol/L,pH 4.4)配制成2% STZ新鲜溶液,按40 mg/kg一次性单侧腹腔(近胰腺部位)注射[7],4 h后给予正常饮食,72 h后尾静脉采血测定血糖。若母鼠血糖>8.12 mmol/L,可进入下一阶段实验流程;若血糖<8.12 mmol/L,则按10~15 mg/kg补注STZ,直至血糖>8.12 mmol/L。
柠檬酸组(negative control组,n=30):将查到精子的大鼠空腹8 h后,用等体积的柠檬酸-柠檬酸钠缓冲液(0.l mol/L,pH 4.4,现配),一次性单侧腹腔(近胰腺部位)注射,4 h后正常饮食,72 h后尾静脉采血测定血糖。
胰岛素干预组(insulin组,n=30):按上述GDM组处理后血糖>8.12 mmol/L者,每天下午5~6时皮下注射中效胰岛素(诺和锐30R)16~20 U·kg-1·d-1,根据血糖水平每天调整胰岛素用量,使空腹血糖控制在4.8~7.0 mmol/L,直至解剖取胎当天。
2.2标本收集与样本制备 给药72 h 后每天检测孕鼠血糖及体重,各组分别于孕12 d(embryotic day, E12)、E15和E19随机剖宫,观察孕鼠流产情况,检查胎鼠的外部形态 (包括活胎、死胎及吸收胎等) ,称量胎鼠体重并取材。本实验中胎鼠发育异常情况参考了毛东伟等[8]所做的定义:死胎是指子鼠发育成形后死于宫内;吸收胎是指子鼠尚未发育成形即逐渐被母体所吸收,尚留有部分组织,可出现液化或坏死的胚胎。
2.3HE染色 采用4%多聚甲醛溶液固定各实验组心脏组织,常规脱水及石蜡包埋,制备成3μm连续切片后行HE染色,光镜下观察各组胎鼠心脏组织的病理学改变。
2.4胎鼠心脏组织Hand2 mRNA的检测 采实时用荧光定量PCR法,以β-actin为内参照,检测胎鼠心脏Hand2 mRNA表达。Trizol法提取胎鼠心脏组织总RNA,逆转录为cDNA,取2 μL进行PCR反应,体系为25 μL,Hand2正义链5’ -TCCTACAGTCCCGAGTACGCCA-3’,反义链5’- GGCACTTGAATGGTATTTGGAGA -3’;β-actin正义链5′- ACCACAGTCCATGCCATCAC -3′,反义链5′-TCCACCACCCTGTTGCTGTA-3′。反应条件为95 ℃预变性1 min,95 ℃ 15 s,60 ℃ 15 s,60 ℃ 20 s,共40个循环。以β-actin为内参照,利用2-ΔΔCT方法分析不同组间Hand2的表达水平。
2.5免疫组化检测Hand2蛋白表达 常规石蜡包埋,制作6μm切片。采用免疫组织化学SABC法染色,DAB显色,经苏木素复染后,盐酸乙醇分化;脱水、透明,中性树胶封片、光镜下检查。染色均设立以PBS代替Ⅰ抗的阴性对照组。每个时点每组随机抽取5张不同切片,每张切片于光镜下(×200)随机选取5个视野,固定窗口面积,利用Q-win图像分析系统,测定平均灰度值以表示阳性产物的强度。
2.6Western blotting 检测Hand2蛋白表达水平 取胎鼠心脏组织约100 mg,冰上操作,加500 μL RIPA裂解液于匀浆器中反复碾碎并离心以提取总蛋白;依据试剂盒说明书对蛋白样品初步定量,取10 μL蛋白溶液加样品处理液煮沸5 min,SDS-PAGE 120 min转至PVDF膜后,室温下用5%脱脂奶粉封闭1 h;洗膜后加I抗,室温孵育4 ℃过夜,TBST洗膜3次,每次5 min;加II抗,室温孵育1 h,TBST漂洗3次,每次5 min;将化学荧光发光底物均匀地加到膜的表面,且反应持续5 min;去除膜表面的残液,置于曝光盒中曝光、显影、定影;采用凝胶图像处理系统分析条带灰度值。
3 统计学处理
采用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,组间采用2检验和t检验,组内差异采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 各组胎鼠心脏组织病理学变化
正常大鼠胚胎在E12时,心脏外型上已基本具备成体心脏的雏形,心脏房间孔已发育基本完全。室间隔肌部与心内膜垫之间留有室间孔。E15时,室间孔消失,室间隔膜部形成,至此心室完全分隔为左右心室,同时心房壁上出现较少的短小肌小梁结构,心室壁增厚,心肌小梁增多。E19时,心脏继续逐渐增大,心房心室壁继续逐渐增厚,心肌小梁逐渐增多、增粗,同一孕期心脏大小均一,未见心肌壁异常增厚,房室间隔病理性缺损、动脉圆锥干畸形等异常情况。高倍镜下可见心肌细胞呈椭圆形,胞浆丰富。核大,形态规则,染色均匀。可见心肌肥厚及室间隔缺损,心脏畸形发生率低,见图1。
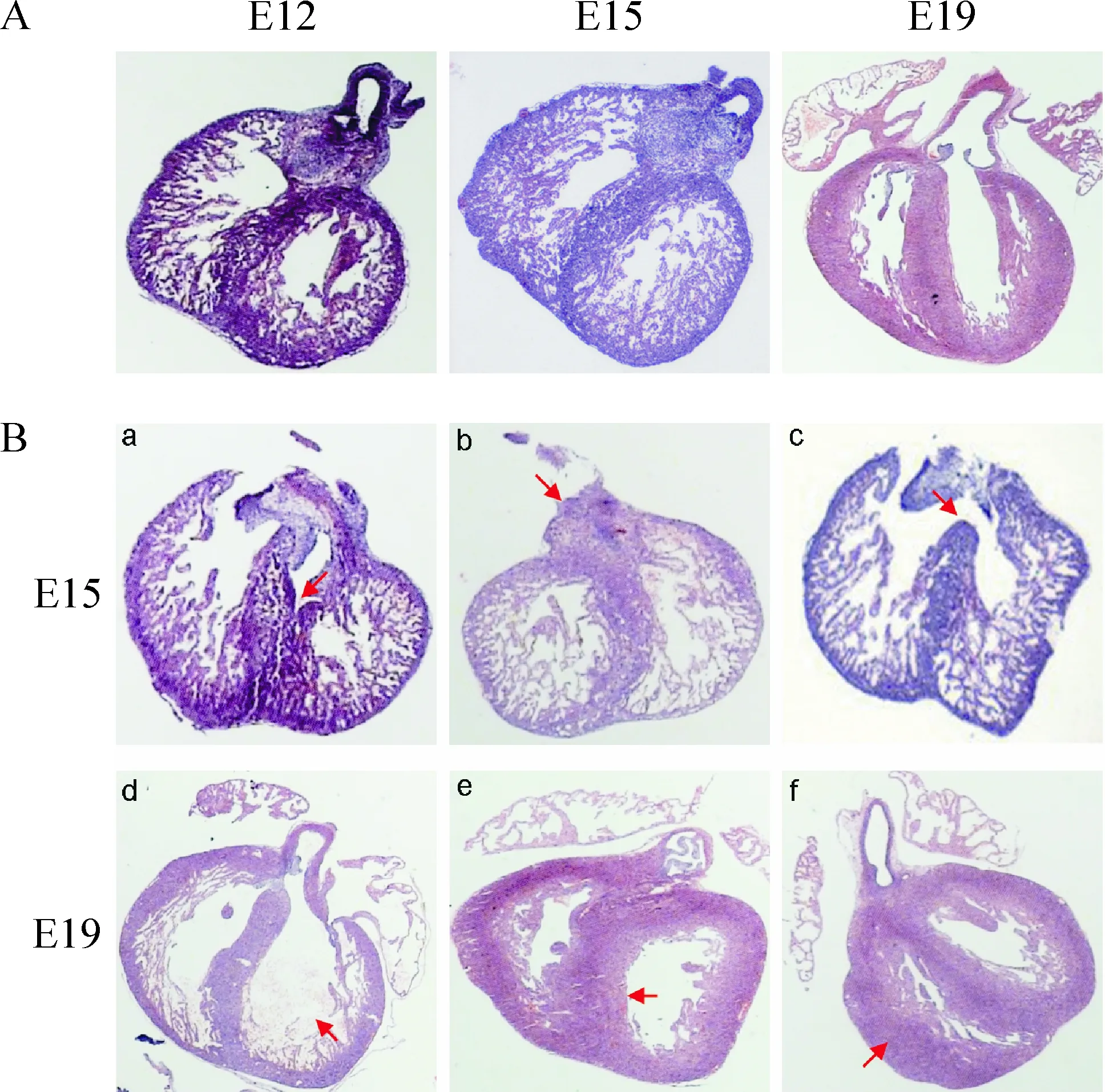
Figure 1. The changes of fetal cardiac tissues on E12, E15 and E19 in control group and GDM group (HE staining, × 25).A: blank control group B: GDM group on E15 and E19. a: interventricular septum rupture; b: truncus arteriosus communis; c: ventricular septal defect; d: ventricular chamber dilatation; e: interventricular septum increased thickness; f: myocardial hypertrophy.
GDM组胎鼠心脏组织病理切片可见圆锥干发育畸形(根据文献报道,圆锥干畸形包括法洛四联症、大动脉转位、动脉单干、右室双流出道等,本研究中仅发现动脉单干)、室间隔缺损及室间隔裂、心肌壁肥厚、心腔扩大等。高倍镜下可见GDM组E12胎鼠心肌细胞排列尚整齐,胞浆未见明显溶解,胞核形态尚规则,但细胞核染色较其它3组深;E15胎鼠心肌细胞排列欠整齐,胞浆稍有溶解,胞核形态不规则,并出现核皱缩等表现;E19胎鼠心肌细胞排列较紊乱,胞浆溶解,成片的无结构区,胞核形态不规则。其它3组心肌细胞呈椭圆形,胞浆丰富,细胞核较大,形态规则,染色均匀,见图2。
Negative control大鼠胚胎心脏发育情况与blank control组相似,偶见心脏发育畸形的胎鼠,E19见2只心脏畸形胎鼠,主要表现为心肌肥厚及室间隔缺损。
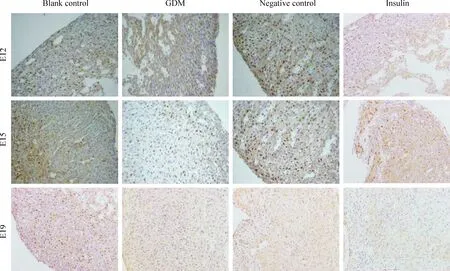
Figure 2. The expression of Hand2 on E12, E15 and E19 in 4 groups (immunohistochemical staining; × 200). Compared with other groups on E12 and E15, the expression of Hand2 in GDM group deceased at the same time points.
Insulin组大鼠胚胎心脏发育情况与blank control组相似,E12、E15和E19均可见胎鼠心脏发育异常,但其发生率不高,与A组相比差异无统计学意义。胎鼠心脏畸形主要表现为心肌肥厚、室间隔缺损及心腔扩大等。
2 各组胎鼠心脏发育畸形的比较
GDM组与其它3组相比较,其心脏畸形发生率明显升高(P<0.05),见表1。

表1 胎鼠心脏畸形例数的比较
*P<0.05vsblank control group.
3 免疫组化检测各组胎鼠心脏组织Hand2 蛋白的表达
免疫组化发现Hand2蛋白主要表达于心脏组织的细胞核中,呈棕黄色颗粒状。E12时,Hand2主要表达在右心室及大动脉根部;E15时,Hand2蛋白表达增加,并主要表达于右心室区域、主动脉弓及右室流出道等;E19时,Hand2蛋白表达量显著升高,在右心室、动脉囊和主动脉弓等均表达,在左心室有少量表达。negative control组及insulin组Hand2蛋白定位表达情况与blank control组基本一致。GDM组E12及E15时Hand2蛋白的表达较其它3组明显下降,E19时Hand2在胎鼠心脏表达量与其它3组相似,差异无统计学意义(P>0.05),见图2。
利用Q-win图像彩色分析系统进行图像半定量分析,测定平均灰度值以表示阳性产物的强度。灰度值设定时,把纯黑色定义为0,白色定义为255,故灰度值越低,其阳性反应产物的强度越强,即表明Hand2蛋白含量越高。统计结果显示,与同组各孕龄的平均灰度值相比,E12的平均灰度值最高,即其所表达的Hand2蛋白含量最低,其后依次为E15、E19,3者间差异有统计学意义(P<0.05);E12时,GDM组平均灰度值高于其它3组,差异有统计学意义(P<0.05),而3组平均灰度值两两比较,无统计学意义(P>0.05);E15的情况与E12相似,GDM组平均灰度均高于其它3组,且有统计学意义。但E19时,4组心脏组织的平均灰度值差异无统计学意义,见表2。
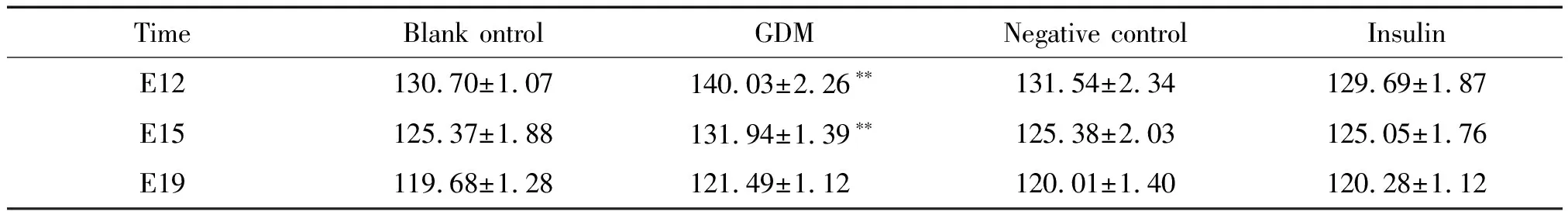
表2 免疫组织化学检测Hand2蛋白表达情况
**P<0.01vstinsulin group.
4 各组胎鼠心脏组织中Hand2 mRNA的表达水平
Real-time qPCR分析结果显示,E12及E15时,GDM组胚胎心脏组织中的Hand2表达与其它3组相比明显降低,E19时Hand2 mRNA表达水平与其余3组相比差异无统计学意义(P>0.05),见图3。
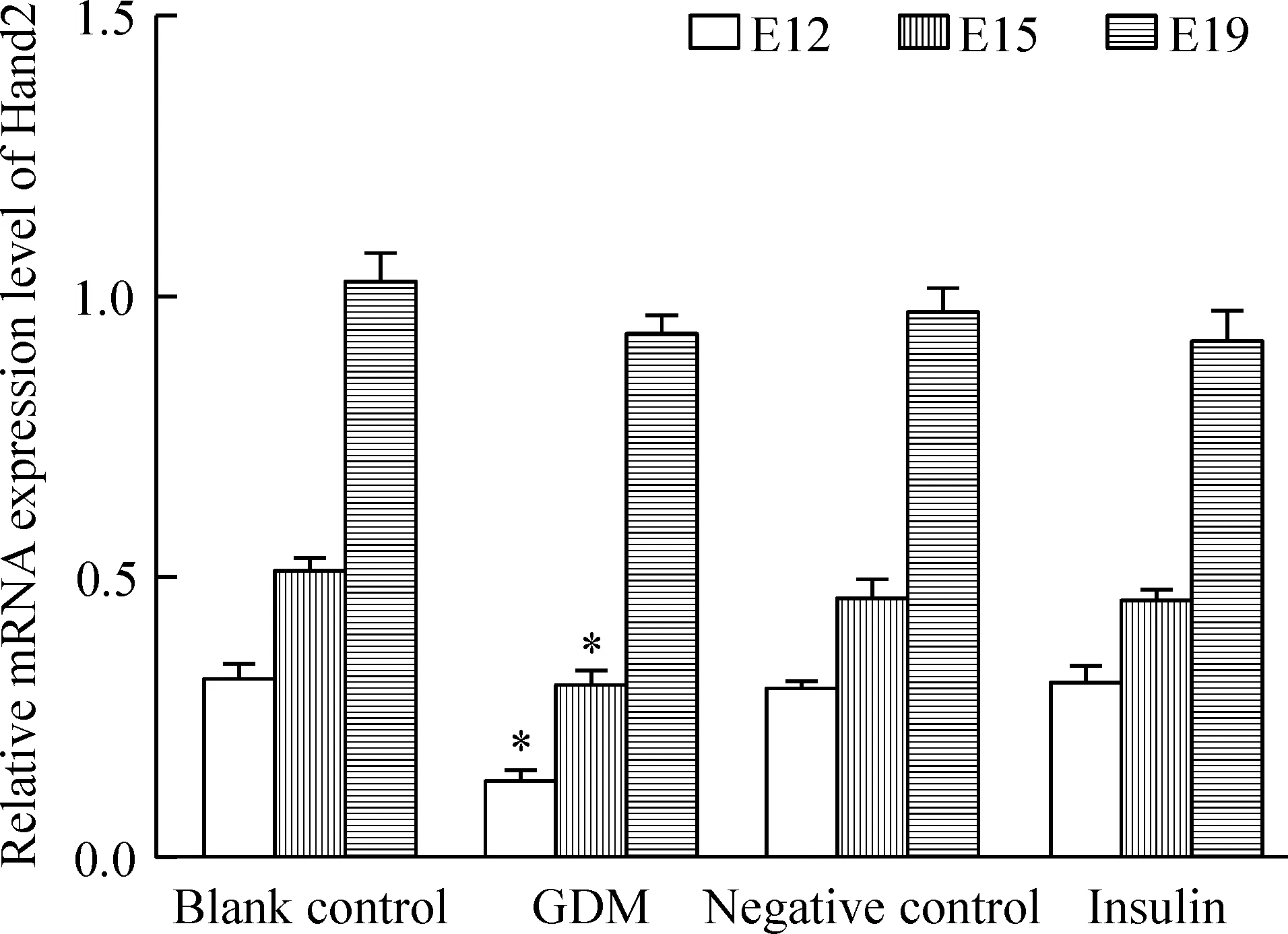
Figure 3. Ralative mRNA expression of Hand2 in the myocardial tissues from each group measured by real-time fluorescence quantitative RT-PCR. Mean±SD. n=3. *P<0.05 vs blank control group.
5 各组胎鼠心脏组织中Hand2蛋白的表达水平
用Western blotting检测各组胚胎心脏组织中Hand2蛋白的表达水平,结果显示GDM组E12和E15时点的Hand2表达减少,差异有统计学意义(P<0.05),见图4、5。
讨 论
GDM是指妊娠期间首次发现或发生的不同程度的糖耐量异常[9],其发病率在世界范围不断上升[10],对孕母和胎儿均有不良影响,是胚胎期发生心血管畸形的病因之一,有研究提示GDM孕妇胎儿发生心血管畸形的风险是正常孕妇的5倍[11]。糖尿病诱导胚胎畸形的确切机制还不明确,高血糖被认为是对心血管发育造成不利影响的主要原因;在高血糖环境下控制正常心脏神经节发育的基因表达被改变,从而导致中断心脏神经节的分化[12]。高血糖可使孕妇体内发生各种激素及氧化物代谢紊乱,胎儿发育所需的某些转录因子或关键基因等物质在这样的环境下发生质或量的改变,最终导致胎儿先天畸形的发生。在本实验中,我们观察到GDM组液化吸收胎、死胎、畸形胎等发育异常胚胎的发生率明显高于blank control组,GDM组胎鼠心脏发育异常与临床资料中GDM孕母所致胎儿心脏发育异常的病理类型相符合[13]。同时,我们专门设计insulin组控制血糖在正常范围内,观察STZ 药物本身是否对胚胎发育产生影响,结果insulin组的液化吸收胎的发生率升高,甚至与GDM组相近;而insulin组胎鼠表观畸形与心脏发育畸形的比例却远低于GDM组。这一现象引起了我们的猜测:链脲佐菌素药物本身可能对大鼠早期胚胎发育有一定影响,但其对胚胎心脏等其它器官的发育影响不大。对于这一猜测的真实性,则仍需要我们进一步探讨。

Figure 4. The expression of Hand2 protein in embryonic heart tissue detected by Western blotting.
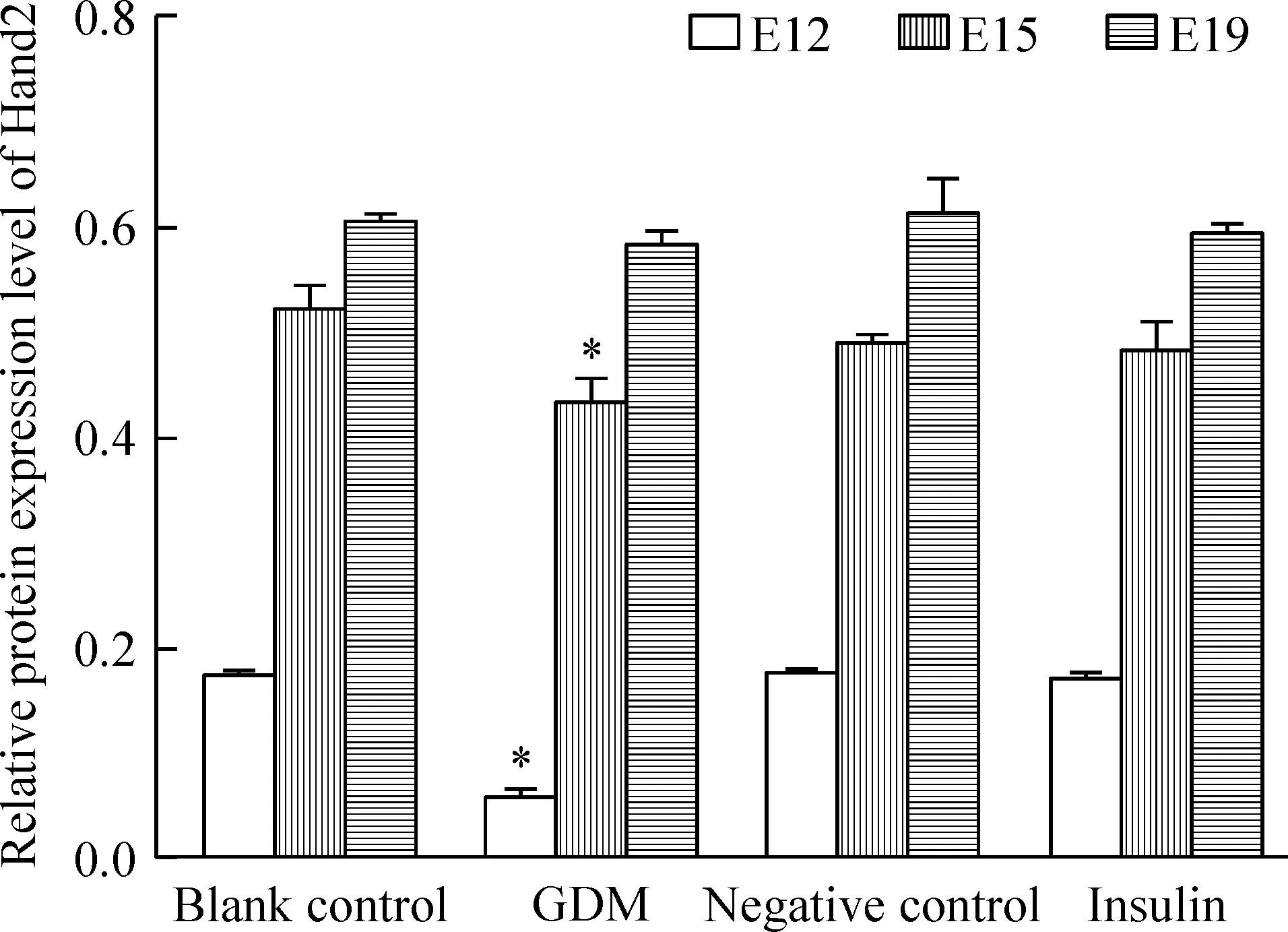
Figure 5. The expression of Hand 2 protein in the fetal rat cardiac tissues from each group measured by Western blotting. Mean±SD. n=3. *P<0.05 vs blank control group.
bHLH蛋白家族是心脏形成过程中重要的转录因子,它将上游诱导信号与下游调控基因联系起来, 控制心肌细胞的增殖和分化、心脏发育模式及形态发生和心脏收缩[14]。Hand2是bHLH蛋白家族的重要成员,与胚胎心脏发育密切相关。在心管形成前, Hand蛋白首先在心脏前体侧壁中胚层、神经嵴和腮弓上表达,然后持续表达于整个心脏发育过程中,直到心腔分化完成。虽然在哺乳动物心脏形态形成和早期胚胎心管不对称环化过程中Hand1 和Hand2 最初是共同表达的,但随后Hand1 逐渐主要局限在左心室表达,Hand2 逐渐主要局限在右心室表达[15]。不少学者在鸡胚和鼠胚的研究表明[16],Hand2 在胚胎心脏、血管、肢体等发育过程中扮演重要角色。Liang等[17]研究发现,在斑马鱼中,Hand2不仅在胚胎发育早期的侧板中胚层有较强表达,随着胚胎发育时间的推移,还表达于胚胎的咽弓、心脏和鳍芽。本实验结果显示:GDM组及对照组胎鼠心脏中均可检测到Hand2的表达,E12时Hand2主要表达在右心室及大动脉根部;E15时,Hand2蛋白的表达增加,并主要表达于右心室区域、主动脉弓及右室流出道等;E19时,Hand2蛋白的表达量显著升高,在右心室、动脉囊和主动脉弓等均表达,表明Hand2在胚胎心脏发育过程中表达呈现上升过程。
孙淑娜等[18]向斑马鱼胚胎注射吗啡啉修饰的反义寡核苷酸(morpholino oligonucleotides,MO)抑制Hand2基因的表达后,发现其胚胎心脏发育异常比例显著升高。Morikawa等[19]指出Hand2基因在神经嵴中的缺失可以导致流出道及主动脉弓动脉的对位不良,导致的心脏畸形表现为肺动脉及右锁骨下动脉食管后位。GDM组胎鼠心脏畸形的发生率明显高于其余3组,心脏畸形的种类包括室间隔缺损、圆锥干畸形、心肌肥厚以及心室腔扩大等,与缺乏Hand2导致的心脏畸形种类基本相吻合。
Hand2通过多种信号通路以及与其它基因之间相互作用参与调节胚胎心脏的发育。在老鼠模型中,RRR109-111突变可撤除Hand2 DNA对于荧光素酶报导基因转录的结合和活化[20],造成胎鼠10.5 d死亡和右心室发育异常,提示Hand2可通过依赖结合DNA和独立的机制来调节体内组织生长和发育[21]。Zhao等[22-23]发现某些microRNA可特异性结合Hand2 mRNA, 阻止其翻译成蛋白质, 导致胚胎发育初期心肌前体细胞的扩增受限, 进而造成心室没有足够心肌细胞而发展为畸形,提示Hand2可通过microRNA在转录后翻译水平调节蛋白合成,从而影响胚胎心脏发育。本实验表明,E12、E15 GDM 模型鼠的Hand2 mRNA 及蛋白水平较对照组下降(P<0.05),Hand2基因在妊娠期高血糖环境下发生突变,导致其mRNA及表达产物下调,从而影响了胚胎心脏的发育调控过程,导致先天性心脏缺陷。至于Hand2的表达下调可导致何种类型的心脏发育畸形,它又是通过何种具体途径导致GDM母亲胎儿心脏发育畸形,仍有待进一步研究。
[参 考 文 献]
[1] 杨慧霞. 妊娠合并糖尿病[M].第2版. 北京:人民卫生出版社, 2008.25-30.
[2]CarolanM,DaveyMA,BiroMA,etal.Maternalage,ethnicityandgestationaldiabetesmellitus[J].Midwifery, 2012, 28(6):778-783.
[3] Correa A, Gilboa SM, Besser LM, et al. Diabetes mellitus and birth defects[J]. Am J Obstet Gynecol, 2008, 199(3):231-239.
[4]TsuchihashiT,MaedaJ,ShinCH,etal.Hand2functioninsecondheartfieldprogenitorsisessentialforcardiogenesis[J].DevBiol, 2011, 351(1):62-69.
[5] Holler KL, Hendershot TJ, Troy SE, et al. Targeted deletion of Hand2 in cardiac neural crest-derived cells influences cardiac gene expression and outflow tract development[J]. Dev Biol, 2010, 341(1):291-304.
[6] 孙凤杰,任建兵,黄 晓,等.GATA-4在妊娠期糖尿病胎鼠心脏中的表达[J].中国病理生理杂志,2013, 29(3):449-454.
[7] 柳国胜, 罗 瑶,赵立华, 等. 链脲霉素实验性大鼠妊娠期糖尿病对子鼠心肌细胞超微结构的影响[J]. 暨南大学学报(医学版), 2007, 28( 4):374-378.
[8] 毛东伟,赵一平,李守柔, 等. 高血糖致胎鼠神经管畸形的发生机理及牛磺酸拮抗作用的研究[J]. 中华妇产科杂志, 2004 ,39(3):169-172.
[9] 丰有吉,沈 铿,马 丁,等. 妇产科学[M].第2版.北京:人民卫生出版社,2010. 140-143.
[10]CripeSM,O’BrienW,GelayeB,etal.PerinataloutcomesofsoutheastAsianswithpregnanciescomplicatedbygestationaldiabetesmellitusorpreeclampsia[J].JImmigrMinorHealth, 2012, 14(5):747-753.
[11] Wren C, Birrell G, Hawthorne G. Cardiovascular malformations in infants of diabetic mothers[J]. Heart, 2003, 89(10):1217-1220.
[12]KumarSD,DheenST,TaySS.Maternaldiabetesinducescongenitalheartdefectsinmicebyalteringtheexpressionofgenesinvolvedincardiovasculardevelopment[J].CardiovascDiabetol, 2007, 6:34.
[13] Lisowski LA,Verheijen PM,Copel JA, et al. Congenital heart disease in pregnancies complicated by maternal diabetes mellitus. An international clinical collaboration,literature review, andmeta-analysis[J]. Herz, 2010,35(1):19-26.
[14]OlsonEN.Generegulatorynetworksintheevolutionanddevelopmentoftheheart[J].Science, 2006, 313(5795):1922-1927.
[15] Firulli AB, McFadden DG, Lin Q, et al. Heart and extraembryonic mesodermal defects in mouse embryos lacking the bHLH transcription factor Hand1[J]. Nat Genet, 1998, 18(3):266-270.
[16]FirulliAB,FirulliBA,WangJ,etal.Genereplacementstrategiestotestthefunctionalredundancyofbasichelix-loop-helixtranscriptionfactor[J].PediatrCardiol, 2010, 31(3): 438-448.
[17] Liang J, Gui Y, Wang W, et al. Elevated glucose induces congenital heart defects by altering the expression of tbx5, tbx20, and has2 in developing zebrafish embryos[J]. Birth Defects Res A Clin Mol Teratol, 2010, 88(6):480-486.
[18] 孙淑娜,桂永浩,宋后燕,等. hand2 基因对斑马鱼胚胎发育影响的实验研究[J]. 复旦学报:医学版,2008, 35(3):523-527.
[19] Morikawa Y, Cserjesi P. Cardiac neural crest expression of Hand2 regulates outflow and second heart field development[J]. Circ Res, 2008, 103(12):1422-1429.
[20]McFaddenDG,McAnallyJ,RichardsonJA,etal.MisexpressionofdHANDinducesectopicdigitsinthedevelopinglimbbudintheabsenceofdirectDNAbinding[J].Development, 2002, 129(13):3077-3088.
[21] Liu N, Barbosa AC, Chapman SL, et al. DNA binding-dependent and -independent functions of the Hand2 transcription factor during mouse embryogenesis[J]. Development, 2009, 136(6):933-942.
[22]ZhaoY,SamalE,SrivastavaD.Serumresponsefactorergulatesamuscle-specificmicroRNAthattargetsHand2duringcardiogenesis[J].Nature, 2005, 436 (7048):181-182.
[23] Zhao Y, Ransom JF, Li A, et al. Dysregulation of cardiogenesis, cardiac conduction, and cell cycle in mice lacking miRNA-1-2[J]. Cell, 2007, 129(2):303-317.

