跨代染镉对子代大鼠大脑引起的脂质过氧化
张 燕,王克跃
(遵义医学院公共卫生学院 毒理学教研室,贵州 遵义 563099)
镉是一种常见的金属毒物,可对多组织产生毒作用。由于工业三废和生活中大量含镉废弃物进入环境, 目前已在局部地区对公众造成了不同程度的危害,引起了人们的高度重视[1-2]。世界卫生组织和联合国环境规划署将其列为重点研究的环境污染物。而锌则是人体的必需微量元素,锌对脑的发育及维持其正常功能有重要作用,并且在人和动物神经细胞的成熟分化过程中发挥重要作用,还具有抗氧化功能, 慢性镉中毒时,增加锌的摄入量可以防止大鼠肾功能损伤和骨代谢障碍[3]。无论什么原因干扰了锌的功能和代谢,都会对机体健康产生不良后果。已有大量的研究表明,镉对机体的损害,与镉引起锌在体内的代谢和功能的异常密切相关。脂质过氧化是镉引起机体损伤的机理之一[1],有研究表明,镉对培养的原代大鼠皮质神经细胞有致脂质过氧化作用[4],本研究旨在探讨低浓度跨代长期镉暴露的情况下,镉是否能引起子代大鼠大脑脂质过氧化损伤。
1 材料与方法
1.1 实验动物 SD清洁级大鼠36只,雄性12只,雌性24只,体重212±6.9g,由第三军医大学实验动物中心提供[许可证号SCXK(渝)2012-0003]。
1.2 主要试剂 氯化镉(优级纯, 上海试剂二厂) 、MDA测试盒( 碧云天生物试剂公司)。
1.3 主要仪器 756 分光光度计( 上海第三分析仪器厂) ;Spectr AA 240Z型原子吸收分光光度计(美国CARIN公司)。
1.4 动物处理及各指标测定方法 将36只SD大鼠随机分为以下4组:饲料中不添加镉组(1组);饲料中按1mg/kg加入镉组(2组);饲料中按5mg/kg加入镉组(3组)、饲料中按25mg/kg加入镉组(4组),每组含3只雄鼠和6只雌鼠,将镉掺入饲料中充分搅拌混匀后配成含不同镉含量的颗粒饲料。亲代大鼠染镉1月后,每组按照雌雄2:1的比例合笼,产下子鼠后,将10只新生大鼠处死,取出肝、肾和脑组织,放入-80℃冰箱内保存。待亲代雌鼠哺乳结束后处死,将5只亲代大鼠取出肝、肾和脑组织,放入-80℃冰箱内保存。其余的乳鼠同亲代大鼠染镉方式,喂养8周后处死,取肝、肾和脑组织-80℃冰箱内保存。各指标测定方法如下:
1.4.1 丙二醛(malonydiadehyde, MDA)含量测定大脑中MDA含量测定按照试剂盒内说明书进行测定。
1.4.2 镉和锌的测定 测定时将组织解冻,经微波消解,用0.5%的稀硝酸稀释后,采用石墨炉原子吸收光谱法测定镉和锌的含量。

2 结果
2.1 MDA检测结果 从表1可以看出, 3个染毒组的脑组织MDA 含量与1组比较,差异均有统计学意义(P<0.05)。


分组MDA( nmo l/ mgPro)1组2.0473±0.08332组 2.3953±0.0786a3组2.5020±0.0688a4组2.6253±0.0543a
a与1组比较P<0.05。
2.2 镉和锌测定结果 亲代大鼠、乳鼠及8W的大鼠镉、锌含量(见表2、表3)。可以看出,亲代大鼠染镉后,所产下的乳鼠体内镉含量也相应的增高,随着染镉剂量的增加,大脑内锌的含量相应降低,经相关分析,亲代大鼠肝脏镉的含量与子代新生大鼠肝脏镉含量呈正相关(r=0.554,P<0.05);亲代大鼠肾脏镉含量与子代新生大鼠肾脏中镉含量呈正相关(r=0.559,P<0.05);亲代大鼠脑中镉含量与子代新生大鼠脑中镉含量呈正相关(r=0.924,P<0.01),子代8周大鼠脑中MDA含量与脑中锌含量呈负相关(r=-0.11,P<0.05)。


鼠别n器官组别1234亲代大鼠5肝肾脑13.77±2.7814.00±1.9113.56±1.2622.06±2.08a17.53±1.63a15.19±1.4323.86±1.84a19.67±1.13ab17.34±1.79ab25.99±1.62abc20.79±1.09abc19.78±0.93abc子代新生大鼠10 肝肾脑10.42±1.9410.01±2.347.03±1.0715.11±3.29a10.85±1.858.38±1.44a15.84±2.48a14.05±1.64ab11.12±1.25ab16.67±4.51a16.53±3.28abc12.15±1.43ab子代8周大鼠15肝肾脑27.00±5.5725.51±3.789.28±0.8145.11±3.70a42.59±5.87a13.39±1.11a57.98±4.51ab53.26±4.31ab17.08±0.56ab60.24±1.65ab60.11±1.80abc20.62±1.14abc
a与1组比较P<0.05,b与2组比较P<0.05,c与3组比较P<0.05。
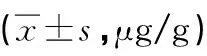

鼠别n组别1234亲代大鼠516.68±6.867.49±4.48a5.44±5.75a1.04±2.32a子代新生大鼠109.42± 2.9110.88±3.176.86±5.38b3.73±4.83ab子代8周大鼠1514.99±7.5616.38±1.5812.89±1.06b8.31±0.76abc
a与1组比较P<0.05,b与2组比较P<0.05,c与3组比较P<0.05。
3 讨论
大量的研究已经证实[5-6],镉的毒性作用与氧化损伤有密切的关系,进入体内的镉,可以引起机体脂质过氧化,导致细胞膜结构及功能异常,引发一系列的镉损伤,而锌对镉引起的脂质过氧化有保护作用[7]。MDA是最常用的反应机体脂质过氧化的指标,是反映镉损伤的间接指标之一。既往的镉毒性实验研究都是在同代动物中进行的,本研究给大鼠跨代经饲料低剂量染镉来模拟人群接触镉的情况,探讨跨代染镉对子代的影响。本实验结果显示,亲代和子代两个时期的大鼠大脑、肝和肾中镉含量均随染镉剂量增加而增加,表明孕鼠接触镉可通过胎盘将镉转运到子鼠,结果与已有的研究结果一致[8]。同时,脑组织中锌含量随染镉剂量增加而降低,高剂量组低于对照组。目前认为,镉和锌在消化道都是经二价金属转运体1竞争性吸收[9],而镉的竞争性远比锌大[10],故脑组织中锌含量降低可能是由于镉影响了锌在消化道吸收的结果。脑组织中MDA含量也随染镉剂量增高而增高,且与脑组织中锌含量呈负相关,与肝脏、肾脏和大脑中镉含量呈正相关,有明显的剂量效应关系,表明在实验的剂量范围内,不但可使体内镉含量增高,脑中锌含量降低,还引起了脂质过氧化损伤。提示镉引起的脂质过氧化损伤损伤与锌的代谢异常有密切关系。本研究的结果提示,世代长期生活在高镉环境中的人群,比外来人群更容易受到镉危害,如果适量补充锌可能有利于拮抗镉引起的氧化损伤。
[参考文献]
[1] Wang B, Li Y,Shao1 C,et al.Cadmium and Its Epigenetic Effects[J].Current Medicinal Chemistry,2012, 19(16):2611-2620.
[2] Chang Y F,Wen J F,Cai J F, et al. An investigation and pathological analysis of two fatal case of cadmium poisoning[J]. Forensic Sci Int,2012,220(1-3):e5-8.
[3] Jihenel H, Sonia S,Fatima H, et al. Interaltionships between cadmium, zinc and antioxidants in the liver of rat exposdred orally to raltively high doses of cadmium and zinc [J]. Ecotoxicol Enwiron Sal,2011, 74(7):2099-2104.
[4] 袁燕,刘学忠,张燕,等.镉对大鼠大脑皮质神经细胞的氧化损伤及N-乙酰半胱氨酸的保护效应[J]. 2011,31(3):391-393.
[5] 韩国安, 姜会敏.锌、硒拮抗镉致妊娠大鼠肝细胞损伤的研究[J].山东医科大学学报, 1996,34(1):28-30.
[6] 洪峰.镉与氧化损伤研究进展[J].国外医学医学地理分册,2002,23(3):97-103.
[7] 李红,王克跃,石修权.锌对镉所致大鼠肝脏脂质过氧化损伤的保护作用研究[J].遵义医学院学报,2004,27(4):322-323.
[8] 石修权,王克跃,李红,等.镉对大鼠胚胎损害作用的实验研究[J].陕西医学杂志,2004,31(11):971-973.
[9] 柯亚,钱忠明,二价金属离子转运蛋白1—一个新发现的重要铁转运蛋白生物化学与生物物理进展,2002,29(2):184-188.
[10] Illing A C, Shawki A, Cunningham C L, et al.Substrate profile and metal-ion selectivity of human divalent metal-ion transporter-1[J]. J Biol Chem,2012,287(36):30485-30496.

