金钗石斛种子萌发率提高及可诱导愈伤组织培养基的研究
徐德林,蔡振锋,张 林,储士润,祝 飞,钱 刚
(1.遵义医学院 细胞生物学与遗传学教研室,贵州 遵义 563099;2.遵义医学院 第一临床学院,贵州 遵义 563099)
由于金钗石斛极高的经济和药用价值[1],长期以来被人们过度采摘,再加上其自然生长缓慢、繁殖率低等生物因素影响,野生资源渐近枯竭,目前资源濒危[2],已被列为国家二类保护植物并列入《国家重点保护野生植物名录》[3]。因此,如何保护种质资源,并降低人们对野生金钗石斛的依赖,实现金钗石斛资源的可持续发展和利用迫在眉睫。近年来,随着生物技术的进步和栽培技术的不断发展,金钗石斛的人工繁育已成一定规模[1,4],高产优质种苗正成为科研工作者积极探索的热点。针对金钗石斛种子自然发芽率极低的状况,本研究明确了最适种子萌发的培养基;并利用植物组织培养技术寻求诱导金钗石斛愈伤组织培养基,为实现其快速无性繁殖提供保障和技术参数,也为细胞悬浮培养、细胞杂交、多倍体优质种苗培育等后续研究奠定了坚实的实验基础[5]。
1 材料与方法
1.1 实验材料 金钗石斛未开裂的蒴果。
1.2 金钗石斛蒴果消毒 取尚未开裂的金钗石斛蒴果,流水下冲洗20 min,置超净工作台上用75%酒精浸泡30 s,并不断轻摇,用无菌水冲洗3次,然后在加入有两滴Tween-80的0.1%升汞中浸泡12 min,浸泡过程中不断轻摇,最后用无菌水冲洗5次,用吸水纸吸干表面的水分,备用。
1.3 金钗石斛种子的播撒 在超净工作台上将消毒后的金钗石斛蒴果用无菌解剖刀纵向剖开,用无菌镊子轻轻镊取种子播撒在预先配置好的固体培养基内,每瓶培养基播撒量以均匀铺陈在培养基表面为宜。
1.4 萌发率计算方法 每种培养基取5皿,统计并记录每皿中萌发的种子数和种子总数,取二者的比值作为萌发率。
1.5 培养基配制与培养方式 以MS固体培养基为基本培养基,附加萘乙酸(Napthalene acetic acid,NAA)、6-苄基腺嘌呤(6-Benzyl adenine,6-BA)、2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D)三种不同激素组合,使用的天然添加物为土豆,加入量为10g/L,各种培养基附加30g/L蔗糖和7g/L琼脂,pH5.95(高压灭菌前)。采用光照和黑暗两种培养方式进行金钗石斛种子的萌发诱导和愈伤组织的诱导(见表1)。培养基接种外植体后在温度为25±2℃、光照周期12h/d、光照强度2000—2500lx条件下进行种子的萌发与愈伤组织诱导培养的研究。每种培养基接种10瓶,30 d后统计金钗石斛种子萌发情况和愈伤组织诱导情况。
表1不同培养基组分

编号培养基组分1MS+2,4-D 0.2 mg/L+琼脂7 g/L+蔗糖30 g/L2MS+2,4-D 0.5 mg/L+琼脂7 g/L+蔗糖30 g/L3MS+2,4-D 1.0 mg/L+琼脂7 g/L+蔗糖30 g/L4MS+NAA 0.2 mg/L+琼脂7 g/L+蔗糖30 g/L5MS+NAA 0.5 mg/L+琼脂7 g/L+蔗糖30 g/L6MS+NAA 1.0 mg/L+琼脂7 g/L+蔗糖30 g/L7MS+NAA 0.2 mg/L +土豆10 g/L+琼脂7 g/L+蔗糖30 g/L8MS+NAA 0.5 mg/L +土豆10 g/L+琼脂7 g/L+蔗糖30 g/L9MS+NAA 1.0 mg/L +土豆10 g/L+琼脂7 g/L+蔗糖30 g/L10MS+NAA 0.2 mg/L +6-BA1.0 mg/L+琼脂7 g/L+蔗糖30 g/L11MS+NAA 0.5 mg/L +6-BA1.0 mg/L+琼脂7 g/L+蔗糖30 g/L12MS+NAA 1.0 mg/L +6-BA1.0 mg/L+琼脂7 g/L+蔗糖30 g/L13MS +土豆10 g/L+琼脂7 g/L+蔗糖30 g/L14MS+2,4-D 0.2 mg/L+碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L15MS+2,4-D 0.5 mg/L+碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L16MS+2,4-D1.0 mg/L+碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L17MS+NAA0.2 mg/L +碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L18MS+NAA0.5 mg/L +碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L19MS+NAA1.0 mg/L +碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L20MS+碳颗粒0.2 g/L+琼脂7 g/L+蔗糖30 g/L
1.6 幼苗株高的测量方法 随机抽取相同培养基下萌发45 d的光培养与暗培养组培苗各30株,测量株高,利用SPSS19.0软件进行独立样本t检验。
2 结果
2.1 种子萌发的诱导
2.1.1 金钗石斛种子成熟度对萌发的影响 成熟的金钗石斛蒴果呈黄绿色,种子为金黄色针状;而未成熟的蒴果为浅绿色,种子为浅白色针状;成熟的种子在第9天时开始萌发(见图1),萌发率可达到92.5%;未成熟的种子16 d后才开始萌发,萌发率为80.5%。

图1 萌发的金钗石斛种子
2.1.2 天然添加物土豆对种子萌发的影响 同种激素比例条件下,加入天然添加物土豆对金钗石斛种子萌发的影响如图2所示,由图可以看出在其它条件相同的情况下未添加土豆的培养基种子萌发率都要高于添加土豆的培养基。但在不添加任何激素的条件下只加入土豆,种子的萌发率可达92.5%。
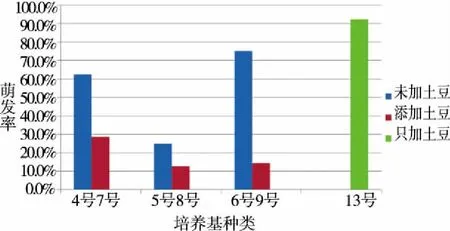
横坐标为表1培养基编号。 图2 激素浓度和天然添加物对金钗石斛种子萌发率的影响
2.1.3 培养方式对种子萌发的影响 在其它条件都相同的条件下,光照培养与黑暗培养两种培养方式都可以使种子萌发,但光照培养种子萌发时得到
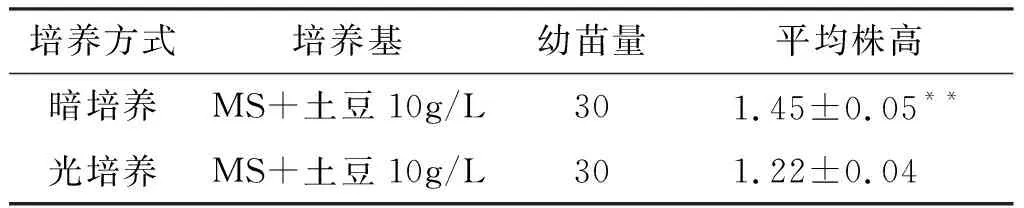
的是鲜绿色的原球茎,黑暗培养种子萌发时得到的原球茎为上端浅白色,下端浅黄色(见图3)。通过测量我们发现,黑暗培养种子萌发后长出的幼苗的平均高度为1.45 cm,显著高于光照培养的1.22 cm(见表2)。进一步将暗培养的小苗其转为光培养,3~4 d后即可转为嫩绿色。

A:为暗培养组培苗;B:为光培养组培苗。 图3 光培养与暗培养对金钗石斛组培苗外观性状的影响
表2暗培养与光培养组统计量
培养方式培养基幼苗量平均株高暗培养MS+土豆10g/L301.45±0.05**光培养MS+土豆10g/L301.22±0.04
**表示P<0.01。
2.1.4 激素组合对种子萌发的影响 将1至13号培养基种子萌发情况进行统计,平均萌发周期由短到长依次为:只加土豆(9d)、只加NAA(14.7d)、NAA与6-BA的组合(17.3d)、只加2,4-D(22.7d)、NAA添加土豆(28.3d)(见图4A),且只加土豆的培养基(13号培养基)萌发率最高达92.5%(见图4B)。
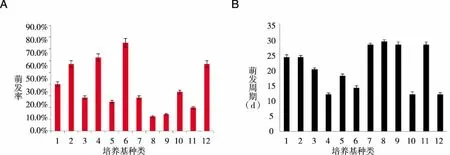
A:为不同激素组合对金钗石斛种子萌发率的影响;B:为不同激素组合对金钗石斛种子萌发周期的影响。图4 激素组合对种子萌发的影响
2.2 愈伤组织的诱导 愈伤组织的诱导如表3所示,在MS基本培养基中仅加入2,4-D浓度为1 mg/L时可得到少量愈伤组织;当仅加入NAA时,均不能诱导出愈伤组织,但在这两种激素中还加入0.2 g/L碳颗粒时,均可诱导出愈伤组织,且在MS基本培养基中不加任何激素而仅添加碳颗粒时,可以诱导出大量疏松,浅黄绿色的愈伤组织(见图5A)。进一步观察还发现,在不添加任何激素不加碳颗粒的14号培养基(对照)中,种子不会发育成愈伤组织而直接萌发为原球茎(见图5B)。

A:金钗石斛愈伤组织;B:金钗石斛原球茎。图5 碳粉对金钗石斛愈伤组织诱导的影响
表3植物激素种类与碳颗粒对愈伤组织诱导的影响
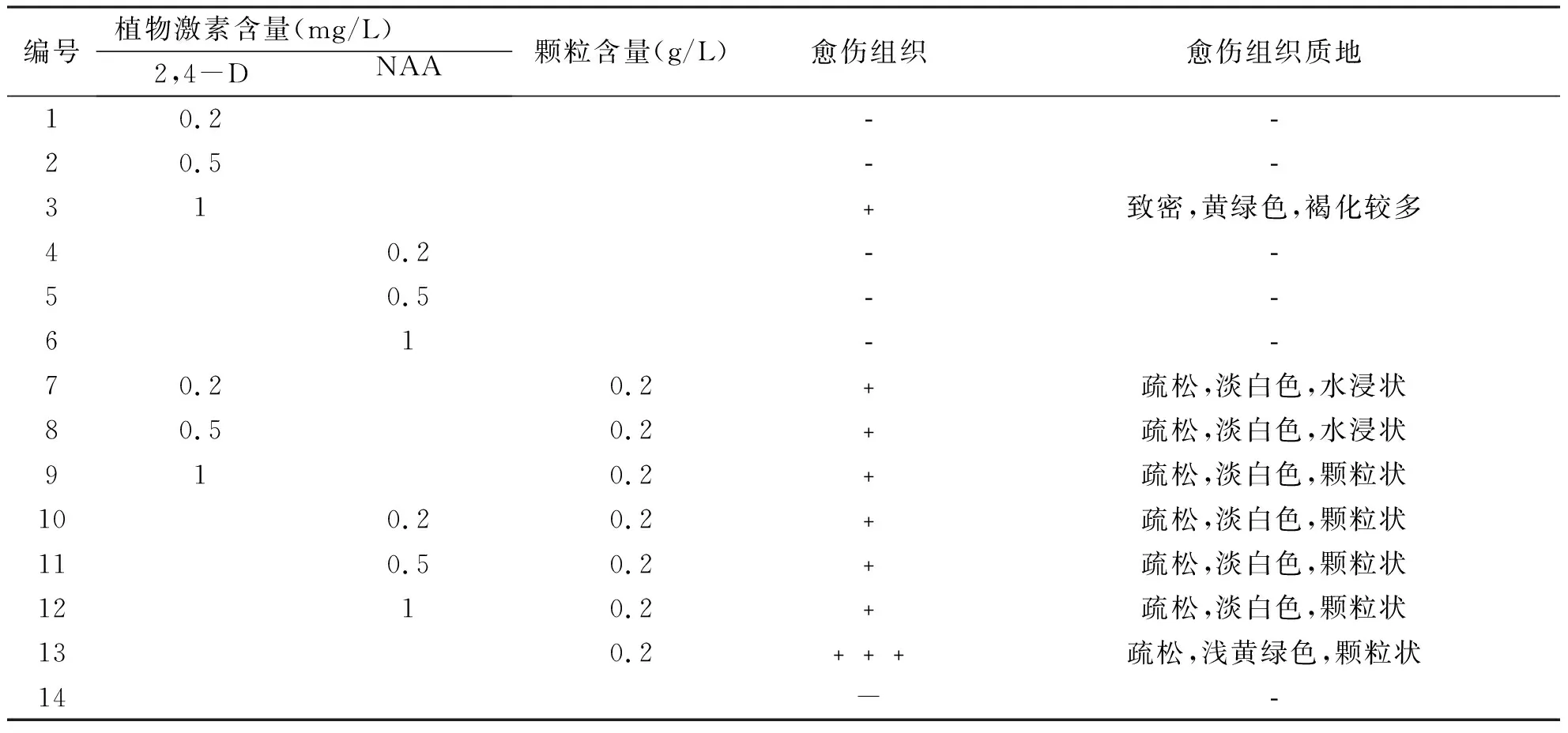
编号植物激素含量(mg/L)2,4-DNAA颗粒含量(g/L)愈伤组织愈伤组织质地10.2﹣﹣20.5﹣﹣31﹢致密,黄绿色,褐化较多40.2﹣﹣50.5﹣﹣61﹣﹣70.20.2﹢疏松,淡白色,水浸状80.50.2﹢疏松,淡白色,水浸状910.2﹢疏松,淡白色,颗粒状100.20.2﹢疏松,淡白色,颗粒状110.50.2﹢疏松,淡白色,颗粒状1210.2﹢疏松,淡白色,颗粒状130.2﹢﹢﹢疏松,浅黄绿色,颗粒状14-﹣
“-”代表未诱导出愈伤组织,“﹢”代表愈伤组织诱导情况。
3 讨论
金钗石斛种子细小,不含胚乳,仅有的胚中储存的营养成分无法满足种子萌发所必需的全部养分,因此在自然条件下难以萌发(一般萌发率低于5%),常需要与特殊真菌共生才能萌发[6],这是其萌发率低的一个重要原因。本研究筛选出的最佳培养基可使金钗石斛种子萌发率达92.5%,这表明在非共生条件下,可以通过合理的调整培养基和激素的比例,为金钗石斛种子的萌发提供适宜的营养成分,从而提高种子的萌发率,这为通过组培技术促进金钗石斛种子萌发、实现快速繁殖提供了实验基础。
NAA可以提高种子中过氧化酶和过氧化氢酶的完整性,促进种子萌发[7]。目前,利用NAA提高种子的萌发率已被广泛应用[8-9]。本研究通过对金钗石斛种子的萌发率分析,发现在以MS为基本培养基的前提下当NAA浓度为1mg/L时种子萌发率较高为75%,萌发时间较短为14d,说明NAA对金钗石斛种子的萌发也有显著的促进作用。
有研究显示天然添加物可以促进金钗石斛壮苗和生根[10-11],本研究发现,用成熟的金钗石斛种子为外植体,在单独添加天然添加物土豆(10g/L)的条件下,金钗石斛种子的萌发率最高,萌发时间最短,说明天然添加物土豆在金钗石斛种子萌发阶段发挥着重要的作用,这可能是由于土豆中含有的某些天然营养物质可以为金钗石斛种子的萌发提供更为充分的养分。但在其它条件相同的情况下同时加入土豆和NAA则使金钗石斛种子的萌发受到了抑制(见图2),明显低于单独添加土豆和单独添加NAA时的萌发率,产生这种情况的原因目前尚未见报道。由于高浓度的NAA可抑制种子的生长[12],因此我们推测可能是由于在种子萌发阶段,土豆中含有的某些天然营养物质产生了与生长素NAA相类似的作用,两种物质同时加入导致激素浓度过高,从而抑制种子的萌发。具体机制有待进一步研究。
金钗石斛种子在有碳颗粒存在的培养条件下,其萌发受到了明显的抑制,而在没有加入碳颗粒的培养基中,种子大多萌发生成原球茎,并逐渐分化出茎、叶、根,这和王红梅的研究相吻合,他们的研究发现添加过量的碳粉会吸附大量培养基中的生长调节物质,抑制了这些物质发挥作用[13]。
同时本研究也发现,适当的添加碳颗粒可以有效促进金钗石斛愈伤组织的生成。碳颗粒虽不能促进种子萌发和生长,但可明显促进愈伤组织的形成。在仅有碳颗粒存在的条件下金钗石斛种子可诱导出大量疏松、浅黄绿色的愈伤组织,这为利用组织培养技术诱导出金钗石斛愈伤组织提供了有意义的思路和参考。
[参考文献]
[1] 国家药典委员会. 中华人民共和国药典2010年版(一部)[S]. 北京:中国医药科技出版社, 2010: 85-86
[2] Mohanty P, Nongkling P, Das M C, et al. Short-term storage of alginate-encapsulated protocorm-like bodies ofDendrobiumnobileLindl.: an endangered medicinal orchid from North-east India[J].Biotech,2013,3(3):235-239.
[3] 乙引,陈玲,张习敏.金钗石斛研究[M].北京:电子工业出版社,2009:1-3.
[4] 唐玲,张丽霞,王云强,等.金钗石斛种苗分级质量标准研究[J].中药材,2012,35(1):12-15.
[5] da Silva J A T, Zeng S, Galdiano R F Jr, et al.In vitro conservation ofDendrobiumgermplasm [J]. Plant Cell Rep, 2014, 21 May, online.
[6] 何炜,杨晓红,戴木兰,等.兰科菌根共生效应研究进展[J].安徽农业科学,2008,36(17):7206-7207,7226.
[7] 张林静,原跃军,王城刚,等.水杨酸和萘乙酸对山茱萸种子萌发的生理学研究[J].山西师范大学学报:自然科学版,2006,20(4):75-79.
[8] Shen Y, Chen W J, Lei X T, et al. Effects of plant growth regulators and temperature on seed germination of yellow nut-sedge (CyperusesculentusL.) [J]. Journal of Medicinal Plants Research, 2011,31(5):6759-6765.
[9] 彭茂林,杜康兮,李立芹.3种植物生长调节剂对烟草种子萌发的影响[J].种子,2012,31(7):110-116.
[10] 唐德英,王云强,段立胜.金钗石斛种苗繁育技术[J].时珍国医国药,2007,18(4):1020.
[11] 罗林会,王勤.金钗石斛的离体快繁体系研究[J].安徽农业科学,2012,40(15):8476,8479.
[12] 李威,周青平,颜红波.萘乙酸对燕麦种子胚根长、胚芽长和发芽率的影响[J].种子,2010,29(12):98-99.
[13] 王红梅.活性炭在植物组织培养中的应用[J].上海农业科技,2011(4):19,21.

