手性四氢喹啉-4-醇衍生物的绝对构型的分析方法
周晓建,郑代军,陈永正
(遵义医学院 药学院,贵州 遵义 563099)
手性醇是重要的多种化工医药中间体,而手性分析的方法则成为关键[1-2]。目前常用的测定绝对构型的物理方法包括X射线单晶衍射法[3-4]和手性光学法[5-6],虽然能满足测定手性醇类化合物绝对构型的需要,但也存在一些缺陷。比如X射线单晶衍射法要求化合物须具有较好的晶型,手性光学法要求化合物必须含有发色基团。因而,设计和发展用于测定手性醇类化合绝对构型的新方法正逐步成为研究热点[7],而以手性衍生试剂衍生后通过核磁共振仪确定绝对构型研究由于操作简便,准确性高引起了研究者的关注[8]。随着超导核磁的发展,改进的Mosher法也用于确定手性仲醇的绝对构型[9-10]。本文就是根据手性醇被(R)-MTPA-Cl和(S)-MTPA-Cl衍生化以后,根据质子被MTPA中苯基基团屏蔽效应的大小,然后根据构象图来测定手性四氢喹啉-4-醇衍生物绝对构型。
1 材料与方法
1.1 材料 手性-4-羟基-3,4-二氢喹啉-1(2H)-碳酸叔丁基酯(a),手性-4-羟基-3,4-二氢喹啉-1(2H)-碳酸苄基酯(b)(由实验室合成),二氯甲烷,(R)和(S)-MTPA-Cl,吡啶,乙酸乙酯,石油醚(试剂均为分析纯)。
1.2 仪器 ZF-7型三用紫外分析仪;B11-1型恒温磁力搅拌器;EYEL-4型旋转蒸发仪;SHZ-ⅢD型循环水真空泵;4000Qtrap LC-MS质谱仪;Agilent-400 MHZ核磁共振仪(CDCl3为溶剂,TMS为内标)。
1.3 Mosher酯的合成方法 在10 mL圆底烧瓶中分别加入手性四氢喹啉-4-醇衍生物a和b 50 μmol,依次加入5 mL二氯甲烷,100μmol吡啶,最后逐滴加入100 μmol的(R)或(S)-MTPA-Cl,薄层色谱跟踪反应,在室温搅拌下3 h后结束反应,反应液用1 M稀盐酸洗涤2次,有机相用无水硫酸钠干燥,浓缩后经石油醚和乙酸乙酯作为洗脱剂过柱纯化分离后得到图1中的4种Mosher酯,其(S)-MTPA-(S)-a、(R)-MTPA-(S)-a、(S)-MTPA-(S)-b和(R)-MTPA-(S)-b的产率分别为77%、73%、88%和84%(合成路线见图1)。

图1 4种Mosher酯的合成路线
2 结果
化合物(S)-MTPA-(S)-a:无色液体,77%的分离产率:1H NMR (400 MHz, CDCl3):δ7.83 (d,J= 8.4 Hz, 1H), 7.44-7.42 (m, 2H), 7.37-7.27 (m, 5H), 7.04 (t,J= 7.2 Hz, 1H), 6.17 (t,J= 3.2 Hz, 1H), 4.10-4.05 (m, 1H), 3.51 (s, 3H), 3.40-3.35 (m, 1H), 2.13-2.09 (m, 2H), 1.49 (s, 9H);13C NMR (100 MHz, CDCl3):δ165.9, 153.3, 138.8, 132.2, 129.6, 129.5, 129.1, 128.4, 127.1, 124.7, 123.7, 123.3, 81.4, 70.5, 55.4, 40.0, 29.7, 29.2, 28.8, 28.2; MS (ESI): calcd for C24H26F3NO5Na [M + Na]+, 488.0。
化合物(R)-MTPA-(S)-a:无色液体,73%的分离产率:1H NMR (400 MHz, CDCl3):δ7.77 (d,J= 8.4 Hz, 1H), 7.50-7.48 (m, 2H), 7.40-7.35 (m, 3H), 7.27-7.23 (m, 1H),7.23-7.22 (m, 1H), 6.98 (t,J= 7.2 Hz, 1H), 6.14 (t,J= 4.4 Hz, 1H), 4.13-4.06 (m, 1H), 3.57-3.50 (m, 1H), 3.48 (s, 3H), 2.23-2.18 (m, 2H), 1.50 (s, 9H);13C NMR (100 MHz, CDCl3):δ166.0, 153.2, 138.7, 131.9, 129.6, 129.3, 128.9, 128.4, 127.3, 124.8, 123.6, 123.3, 81.5, 70.7, 55.3, 40.3, 29.7, 29.3, 28.3, 28.2; MS (ESI): calcd for C24H26F3NO5Na [M + Na]+, 488.0。
化合物(S)-MTPA-(S)-b:无色液体,88%的分离产率:1H NMR (400 MHz, CDCl3):δ7.92 (d,J= 8.4 Hz, 1H), 7.44-7.29 (m, 12H), 7.08 (t,J= 7.2 Hz, 1H), 6.18 (s, 1H), 5.22 (s, 2H), 4.20-4.15 (m, 1H), 3.49 (s, 3H), 3.45-3.43 (m, 1H), 2.14-2.11 (m, 2H);13C NMR (100 MHz, CDCl3):δ165.9, 154.1, 138.3, 136.0, 132.2, 129.8, 129.6, 129.4, 128.6, 128.4, 128.2, 128.0, 127.1, 124.8, 123.8, 123.5, 70.2, 67.8, 55.4, 40.2, 29.7, 28.7, 28.2; MS (ESI): calcd for C27H24F3NO5Na [M + Na]+, 521.9。
化合物(R)-MTPA-(S)-b:无色液体,84%的分离产率:1H NMR (400 MHz, CDCl3):δ7.87 (d,J= 8.0 Hz, 1H), 7.49-7.47 (m, 2H), 7.44-7.34(m, 7H), 7.29-7.25 (m, 2H), 7.21-7.19 (m, 1H),7.02 (t,J= 7.0 Hz, 1H), 6.15 (s, 1H), 5.23 (s, 2H), 4.21-4.18 (m, 1H), 3.67-3.60 (m, 1H), 3.48 (s, 3H), 2.24-2.22 (m, 2H);13C NMR (100 MHz, CDCl3):δ165.9, 154.1, 138.2, 136.0, 131.9, 129.6, 129.4, 129.2, 128.6, 128.4, 128.2, 128.0, 127.3, 124.9, 123.8, 123.4, 70.4, 67.8, 55.3, 40.6, 29.7, 29.1, 28.7; MS (ESI): calcd for C27H24F3NO5Na [M + Na]+, 521.9。
3 讨论
3.1 手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸叔丁基酯1绝对构型的确定

图2 底物a与R和S-MTPA-Cl合成的Mosher酯的模拟构象图
底物(a)与(R)和(S)-MTPA-Cl反应后,合成的Mosher酯(R)-MTPA-(S)-a和(S)-MTPA-(S)-a的模拟构象图如图2所示,通过核磁共振氢谱分析的图谱如图3和图4所示。根据图3可知(S)-MTPA-(S)-a中的C2和C3上H化学位移δ分别为4.100-4.057 ppm、3.404-3.352 ppm、2.133-2.093 ppm,而(R)-MTPA-(S)-a中的C2和C3上H化学位移δ分别为4.129-4.117 ppm、3.574-3.505 ppm、2.234-2.188 ppm。说明(S)-MTPA-(S)-a中苯基对邻近的C2和C3上H屏蔽效应比(R)-MTPA-(S)-a中苯基对邻近的C2和C3上H屏蔽效应大,化学位移小,ΔδSR值为负值,这些质子在MTPA平面的左侧,结构与图2相符。

图3 (S)-MTPA-(S)-a和(R)-MTPA-(S)-a的 1H NMR图谱上C2和C3上H的信号
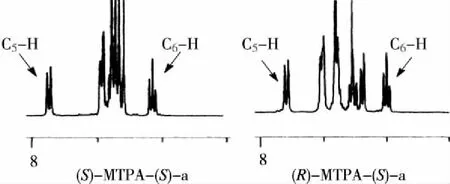
图4 (S)-MTPA-(S)-a和(R)-MTPA-(S)-a的1H NMR图谱上C5和C6上H的信号
根据图4可知(S)-MTPA-(S)-a中的C5和C6上H化学位移δ分别为7.829 ppm、7.038 ppm,而(R)-MTPA-(S)-a中的C5和C6上H化学位移δ分别为7.772 ppm、6.982ppm。说明(S)-MTPA-(S)-a中苯基对邻近的C5和C6上H屏蔽效应比(R)-MTPA-(S)-a中苯基对邻近的C5和C6上H屏蔽效应小,化学位移大,ΔδSR值为正值,这些质子在MTPA平面的右侧,结构与图2相符。
综上所述,手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸叔丁基酯(a)的结构如图2所示,所以手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸叔丁基酯(a)的绝对构型为S-构型。
3.2 手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸苄基酯(b)绝对构型的确定
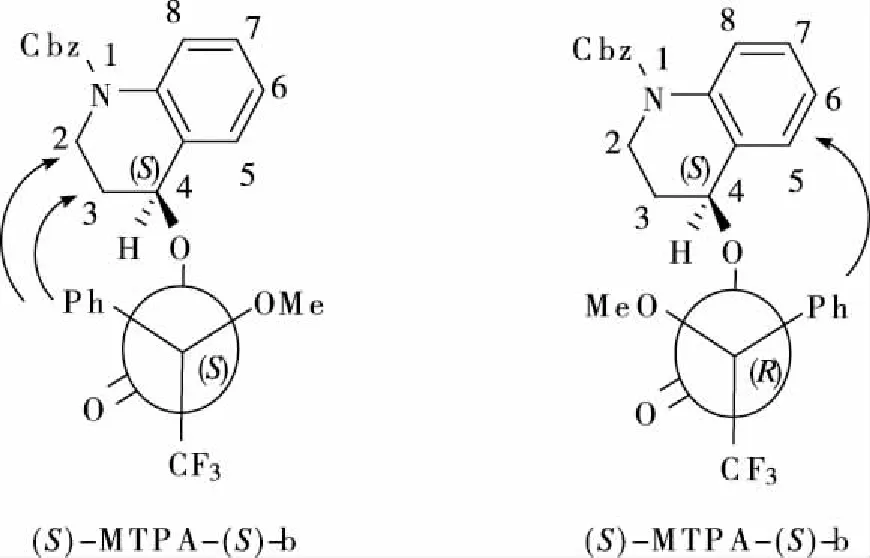
图5 底物(b)与R和S-MTPA-Cl合成的Mosher酯的模拟构象图
底物(b)与(R)和(S)-MTPA-Cl反应后,合成的Mosher酯(R)-MTPA-(S)-b和(S)-MTPA-(S)-b的模拟构象图如图5所示,通过核磁共振氢谱分析的图谱如图6和图7所示。根据图6可知,(S)-MTPA-(S)-b中的C2和C3上H化学位移δ分别为4.206-4.153 ppm、3.456-3.432 ppm、2.146-2.114 ppm,而(R)-MTPA-(S)-b中的C2和C3上H化学位移δ分别为4.212-4.179 ppm、3.667-3.599 ppm、2.239-2.217 ppm。说明(S)-MTPA-(S)-b中苯基对邻近的C2和C3上H屏蔽效应比(R)-MTPA-(S)-b中苯基对邻近的C2和C3上H屏蔽效应大,化学位移小,ΔδSR值为负值,这些质子在MTPA平面的左侧,结构与图5相符。

图6 (S)-MTPA-(S)-b和(R)-MTPA-(S)-b的 1H NMR图谱上C2和C3上H的信号

图7 (S)-MTPA-(S)-b和(R)-MTPA-(S)-b的 1H NMR图谱上C5和C6上H的信号
根据图7可知,(S)-MTPA-(S)-b中的C5和C6上H化学位移δ分别为7.926 ppm、7.078 ppm,而(R)-MTPA-(S)-b中的C5和C6上H化学位移δ分别为7.868 ppm、7.026ppm。说明(S)-MTPA-(S)-b中苯基对邻近的C5和C6上H屏蔽效应比(R)-MTPA-(S)-b中苯基对邻近的C5和C6上H屏蔽效应小,化学位移大,ΔδSR值为正值,这些质子在MTPA平面的右侧,结构与图5相符。
综上所述,手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸苄基酯(b)的结构如图6所示,所以手性-4-羟基-3, 4-二氢喹啉-1(2H)-碳酸苄基酯(b)的绝对构型为S-构型。本文通过(S)和(R)-α-甲氧基三氟甲基苯基乙酰氯为衍生化试剂、与手性四氢喹啉-4-醇衍生物反应分别得到相应的Mosher酯,然后比较Mosher酯核磁共振氢谱的的化学位移,根据质子被MTPA中苯基基团屏蔽效应的大小,判断手性四氢喹啉-4-醇衍生物的绝对构型,实验证明我们建立了一种测定手性四氢喹啉-4-醇衍生物的绝对构型简便和可靠的方法。
[参考文献]
[1] Rowan A S, Moody T S, Howard R M, et al.Preparative access to medicinal chemistry related chiral alcohols using carbonyl reductase technology[J].Tetrahedron: Asymmetry, 2013, 24 (21) :1369-1381.
[2] Chen Y Z, Yang M, Zhuo J R,et al. Asymmetric synthesis of chiral 4-chlorobenzhydrol by C-H bonds oxidation with microbial enzymes [J]. Journal of Zunyi Medical University, 2014, 37 (1): 67-71.
[3] Flack H D, Bernardinelli G.The use of X-ray crystallography to determine absolute configuration [J]. Chirality, 2008, 20 (5): 681-690.
[4] Harada N, Bernardinelli G. Determination of absolute configurations by X-ray crystallography and 1H NMR anisotropy [J]. Chirality, 2008, 20 (5): 691-723.
[5] Li X C, Ferreira D, Ding Y Q, et al.Determination of absolute configuration of natural products theoretical of electronic circular dichroism as a tool [J]. Current Organic Chemistry, 2010, 14 (16): 1678-1697.
[6]Polavarapu P L.Renaissance in chiroptical spectroscopic methods for molecular structure determination [J].The Chemical Record, 2007, 7 (2): 125-136.
[7] Joanna S, Jan C, Dobrowolski, et al. VCD spectroscopy as a novel probe for chirality transfer in molecular interactions [J]. Chemical Society Reviews, 2010, 39 (5): 1478-1488.
[8] Kusumi T, Takahashi H, Xu P, et al. New chiral anisotropic reagents, NMR tools to elucidate the absolute configurations of long-chain organic compounds [J]. Tetrahedron Letters, 1994, 35 (25): 4397-4400.
[9] Kubota T, Tsuda M, Kobayashi,et al. Absolute Stereochemistry of Amphidinolide C[J]. Organic Letters, 2001, 3 (9): 1363-1366.
[10] Morohashi A, Satake M, Nagai H,et al.The Absolute Configuration of Gambieric Acids A-D, Potent Antifungal Polyethers, Isolated from the Marine Dinoflagellate Gambierdiscus toxicus [J]. Tetrahedron, 2000, 56 (46): 8995-9001.

