TRPV3在膀胱癌细胞中的表达及其对膀胱癌细胞增殖迁移能力的影响
卢彦欣,岳续朋,蔡树春,张巨峰
(1.遵义医学院 珠海校区,广东 珠海 519041;2.广东药学院 生命科学与生物制药学院,广东 广州 510006)
膀胱癌为男性第4大肿瘤疾病,是我国泌尿生殖系统高发肿瘤之一,并且发病率呈逐年升高趋势[1-4]。对膀胱癌发病机制以及疾病发生过程中体内各蛋白表达变化的研究有助于临床膀胱癌诊断,治疗和新药的研发[5]。瞬时受体电位香草酸亚型(transient receptor potential vanilloid,TRPV)为非选择性阳离子通道,主要通透钙离子[6-7]。钙离子作为第二信使,参与人体内多种生理、病理活动,包括神经递质合成与释放,细胞信号转导以及肿瘤发生等[8-9]。TRPV3是TRPV成员之一,主要在感觉神经细胞和皮肤角化细胞中表达,同时在脑、肝、膀胱等组织器官中也有表达[10]。目前关于TRPV3的研究主要集中在中枢神经系统和皮肤中,关于TRPV3在肿瘤中的研究尚少,我们通过检测膀胱癌细胞中TRPV3 mRNA 表达水平和生物学功能,探讨TRPV3在膀胱癌发生发展中的作用,以及TRPV3作为临床膀胱癌诊疗以及新药研发的潜质。
1 材料与方法
1.1 细胞、试剂和主要仪器 膀胱癌细胞系RT4,UM-UC-3,SW780,J82,TCC-SUP,T24和人膀胱上皮永生化细胞SV-HUC-1细胞系系本实验室保存细胞株,源于ATCC,培养于含10%胎牛血清的RPMI 1640或DMEM培养液中,在37 ℃、5%CO2细胞培养箱中培养。逆转录试剂盒及荧光定量PCR试剂盒均购自Takara公司,WST-1试剂盒购自武汉博士德生物公司,麝香草酚(Thymol)购自Sigma。
本课题用到的主要实验仪器有CO2细胞培养箱(美国热电3111型),倒置相差显微镜(日本Olympus CKX41型),荧光定量PCR仪(Bio-RAD Chromo4),酶标仪(Bio—RAD Model 680型)。
1.2 实时荧光定量聚合酶链式反应(Real time RT-PCR)检测TRPV3 mRNA 的表达 膀胱癌细胞接种于30 mm培养皿,长至约95%满后,1×PBS(pH=7.4)清洗3遍,加入1 mL TRIzol (Invitrogen)试剂,室温放置5 min,吸取细胞裂解液,加入200 μL氯仿,混匀,12 000 rpm在4 ℃离心10 min;离心后吸取上层液体,加入500 μL异丙醇,混匀,冰浴10 min,12 000 rpm在4 ℃离心10 min;弃掉上清,70%乙醇溶液清洗沉淀,10 000 rpm在4℃离心5 min,弃上清,空气干燥,加入适量DEPC水溶解沉淀,即为细胞总RNA,利用NanoDrop测量总RNA吸光度,以浓度较高,A(260/280)在1.8~2.0的总RNA为模版进行逆转录。逆转录体系和反应条件根据TAKARA Reverse Transcriptase M-MLV试剂盒说明书进行,所得cDNA置4 ℃备用。Real time PCR反应体系为:SYBR Premix Ex Taq(2×),12.5 μL;cDNA模板(稀释10倍),2 μL;引物(20 μmol·L- 1),各1 μL,加 ddH2O至总体积为25 μL。反应条件为:95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火延伸30 s,40个循环;进入溶解曲线阶段。TRPV3和GAPDH引物序列(见表1)。每个样本设定3个复孔,TRPV3 mRNA相对表达量通过相对定量分析法2-△△Ct计算。
表1引物序列

1.3 细胞增殖测定实验 利用WST-1试剂盒检测TRPV3对膀胱癌细胞增殖能力的影响。膀胱癌细胞计数并以每孔3×103个细胞的密度传代与96孔板中,每组每个时间点设3个复孔。细胞处理后0、24、48、72 h分别加入含10 μL WST-1((博士德,武汉)的培养基,37 ℃孵育2 h,利用酶标仪测定吸光度值(λ=450 nm和λref=630 nm)。
1.4 细胞迁移能力测定实验 实验分为300 μmol·L-1TRPV3激动剂Thymol组和等量DMSO对照组。对数生长期膀胱癌细胞分别接种于30 mm细胞培养皿中,培养至细胞几乎铺满培养皿底部(约90%),依据实验分组处理细胞后,利用无菌200 μL吸头垂直于细胞培养皿底部,在单层细胞上直线划痕,为便于标记,本实验采用的是十字划痕,1×PBS(pH=7.4)清洗细胞,更换为含5%FBS的细胞培养基继续培养细胞,分别在划痕后0、6 h采用倒置显微镜观察划痕宽度并用数码相机拍照记录划痕愈合情况。实验重复3次。
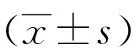
2 结果
2.1 TRPV3在膀胱癌中低表达 相对于人膀胱上皮永生化细胞SV-HUC-1,TRPV3在6株膀胱癌细胞系中表达明显降低,降低倍数不等,最明显的为UM-UC-3,mRNA表达降低达数万倍,T24细胞降低倍数最少,但也有数百倍,统计学差异明显(P<0.0001)(见图1)。
2.2 TRPV3对膀胱癌细胞增殖能力的影响 采用WST-1方法检测TRPV3通道激动剂Thymol对膀胱癌细胞系增殖能力的影响。结果显示应用300 μmol·L-1Thymol处理后的细胞增殖速度明显变慢,细胞增殖曲线变缓(见图2)。
2.3 TRPV3对膀胱癌细胞迁移能力的影响 应用细胞划痕实验检测Thymol激活TRPV3通道后对膀胱癌细胞迁移能力的影响。细胞的迁移生长可使细胞划痕的宽度变窄,以此反映细胞迁移能力的强弱。倒置显微镜下观察细胞划痕宽度变化情况。结果如图3所示,与对照组相比,Thymol实验组可明显抑制细胞迁移,划痕愈合速度变慢,划痕宽度最大。
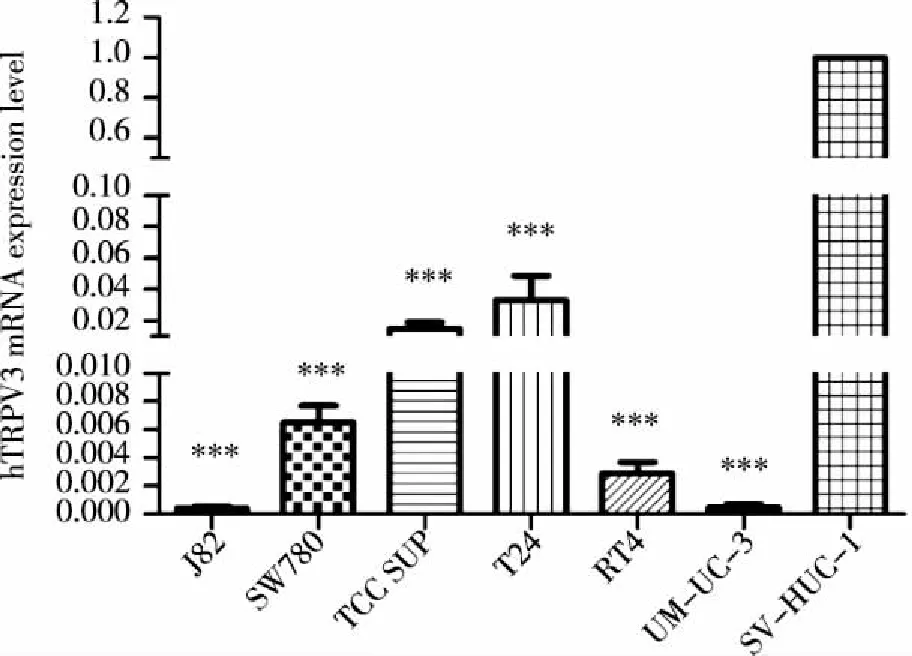
以GAPDH为内参,SV-HUC-1细胞株中基因表达相对量为标准,设定为1,其他细胞株中TRPV3 mRNA的相对表达量与SV-HUC-1相比较。(***P<0.001)。图1 Real time RT-PCR检测TRPV3 mRNA在膀胱癌以及正常膀胱上皮细胞中的表达
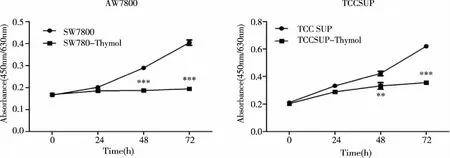
SW780细胞株:0 h,P>0.05;24 h,P>0.05;48 h,P<0.001;72 h,P<0.001。TCCSUP细胞株:0 h,P>0.05;24 h,P>0.05;48 h,P<0.01;72 h,P<0.001。图2 Thymol激活TRPV3通道抑制膀胱癌细胞系SW780和TCCSUP的增殖

箭头标注划痕宽度,***P<0.0001。 图3 Thymol激活TRPV3通道抑制膀胱癌细胞系SW780的迁移能力
3 讨论
膀胱癌是常见的泌尿生殖系统恶性肿瘤之一,其中男性发病比例占总发病人数的80%,轻者严重影响患者的生活质量,重者可直接威胁患者生命[4]。膀胱癌的发生和转移是一个多环节,多因素参与的过程,同时有多个基因,多分子参与调控。虽然近年来对膀胱癌的研究取得了一个又一个突破性的结果,但是对其发生的分子机制的研究仍在不断的探索之中。目前已证实在膀胱癌的发生和转移过程中表达发生变化并发挥关键作用的分子有整合素相关激酶(integrin-linked kinase,ILK)[11], N-甲基转移酶(N-methyltransferase,NNMT)[12], 微小染色体维持蛋白(Mcm5)[13]等。
瞬时感受器电位通道是一类广泛分布细胞膜或胞内细胞器膜上的非选择阳离子跨膜蛋白质,广泛表达于多种组织器官中,如脑、脊髓、肝、肺、肾等,参与多种生理活动,如温度感觉、触觉,感受外部激素,生长发育过程,调节钙平衡以及细胞分化,细胞凋亡等[6-7,14-15]。迄今为止已有超过30个TRP家族成员被克隆,分为7个亚族,分别是TRPA、TRPC、TRPM、TRPML、TRPN、TRPP和TRPV。其中TRPV亚家族包含6个成员,TRPV1-4通道为热敏感通道,可被不同的温度的温热刺激激活,TRPV3能被温热(32℃和39℃)和一系列非热性外源化合物激活,如薄荷(Peppermint)、樟脑(Camphor)、磷脂酶C(PLC) 、2-APB、一氧化氮(N0)和麝香草酚(Thymol)等[16-18]。TRPV3参与多种生物学活动,如温度觉,炎症反应,细胞信号传导,细胞内外钙离子稳态等,并可能与恶性肿瘤的发生与转移有关[19-20]。为阐明TRPV3在膀胱癌发生过程中的作用,我们检测了TRPV3在膀胱癌细胞中的表达水平以及TRPV3对膀胱癌细胞增殖和迁移能力的影响。
我们首先利用实时荧光定量RT-PCR检测6株膀胱癌细胞与人膀胱上皮永生化细胞中TRPV3基因表达水平,TRPV3的mRNA在膀胱癌细胞中的表达相对正常膀胱上皮细胞明显下降,下降倍数最高可达数万倍。提示TRPV3通道的激活或者通道表达量的升高可能在膀胱癌中起到抑癌的作用。我们利用TRPV3通道激活剂Thymol激活细胞中的TRPV3通道,观察膀胱癌细胞功能的变化。细胞内加入300 μmol·L-1的Thymol后,细胞被TRPV3被大量激活,阳离子尤其Ca2+内流,膀胱癌细胞的生长曲线相对对照细胞明显变缓,增殖能力明显受到抑制。我们进一步利用细胞划痕试验检测了TRPV3激活后,膀胱癌细胞迁移能力的变化。用含有300 μmol·L-1Thymol 培养基培养的膀胱癌细胞划痕愈合能力明显变弱,细胞迁移能力降低,提示TRPV3通道功能的增强可明显抑制膀胱癌细胞的迁移能力。
综上所述,我们发现TRPV3基因在膀胱癌细胞中mRNA表达水平明显降低。此外,激活TRPV3通道可明显降低膀胱癌细胞增殖和迁移速度。我们初步的研究结果表明,TRPV3参与了膀胱癌发生发展过程,并在其中扮演抑癌基因的角色,为临床膀胱癌的诊疗和新药研发提供了理论依据。
[参考文献]
[1] Griffiths T R. Current perspectives in bladder cancer management [J]. Int J Clin Pract, 2012, 67(5):435-448.
[2] Mitra A P, Datar R H, Cote R J. Molecular pathways in invasive bladder cancer: new insights into mechanisms, progression, and target identification [J]. Journal of clinical oncology,2006, 24(35):5552-5564.
[3] Smith Z L, Guzzo T J. Urinary markers for bladder cancer [J]. F1000Prime Rep, 2013,Jul l,doi:10.12703/P5.21.5:21.
[4] Skeldon S C, Larry Goldenberg S. Bladder cancer: A portal into mens health [J]. Urol Oncol, 2014,Apr 15,doi:10.1016/j.urolonc.2013.12.005.
[5] Ghafouri-Fard S, Nekoohesh L, Motevaseli E. Bladder Cancer Biomarkers: Review and Update [J]. Asian Pac J Cancer Prev, 2014, 15(6):2395-2403.
[6] Montell C. The history of TRP channels, a commentary and reflection [J]. Pflugers Arch, 2011, 461(5):499-506.
[7] Nilius B, Owsianik G. The transient receptor potential family of ion channels [J]. Genome Biol, 2011, 12(3):218.
[8] Monteith G R, Davis F M, Roberts-Thomson S J. Calcium channels and pumps in cancer: changes and consequences [J]. J Biol Chem, 2012, 287(38):31666-31673.
[9] Roderick H L, Cook S J. Ca2+signalling checkpoints in cancer: remodelling Ca2+for cancer cell proliferation and survival [J]. Nat Rev Cancer, 2008, 8(5):361-375.
[10] Dhaka A, Viswanath V, Patapoutian A. Trp ion channels and temperature sensation [J]. Annu Rev Neurosci, 2006, 29:135-161.
[11] Wang D L, Lan J H, Chen L, et al. Integrin-linked kinase functions as a tumor promoter in bladder transitional cell carcinoma [J]. Asian Pac J Cancer Prev, 2012, 13(6):2799-2806.
[12] Sartini D, Muzzonigro G, Milanese G, et al. Upregulation of tissue and urinary nicotinamide N-methyltransferase in bladder cancer: potential for the development of a urine-based diagnostic test [J]. Cell Biochem Biophys, 2012, 65(3):473-483.
[13] Kelly J D, Dudderidge T J, Wollenschlaeger A, et al. Bladder cancer diagnosis and identification of clinically significant disease by combined urinary detection of Mcm5 and nuclear matrix protein 22 [J]. PLoS One, 2012, 7(7):e40305.
[14] Nilius B, Owsianik G, Voets T, et al. Transient receptor potential cation channels in disease [J]. Physiol Rev, 2007, 87(1):165-217.
[15] Song M Y, Yuan J X. Introduction to TRP channels: structure, function, and regulation [J]. Adv Exp Med Biol, 2010, 661:99-108.
[16] Huang S M, Li X, Yu Y,et al. TRPV3 and TRPV4 ion channels are not major contributors to mouse heat sensation [J]. Mol Pain, 2011,May17,7:37.doi:10.1186/1744-8069-7-37.
[17] Xu H, Ramsey I S, Kotecha S A, et al. TRPV3 is a calcium-permeable temperature-sensitive cation channel [J]. Nature, 2002, 418(6894):181-186.
[18] Xiao R, Tang J, Wang C,et al.Calcium plays a central role in the sensitization of TRPV3 channel to repetitive stimulations [J]. J Biol Chem, 2008, 283(10):6162-6174.
[19] Prevarskaya N, Skryma R, Shuba Y. Calcium in tumour metastasis: new roles for known actors [J]. Nat Rev Cancer,2011, 11(8):609-618.
[20] Miyamoto T, Petrus M J, Dubin A E,et al. TRPV3 regulates nitric oxide synthase-independent nitric oxide synthesis in the skin [J]. Nat Commun, 2011, 2:369.

