康莱特注射液对晚期非小细胞肺癌化疗患者免疫功能的影响
邓新娜,赵淑芳,赵海静,闫永龙,贺丽亚,张洪珍
(河北省人民医院,河北 石家庄 050051)
康莱特注射液对晚期非小细胞肺癌化疗患者免疫功能的影响
邓新娜,赵淑芳,赵海静,闫永龙,贺丽亚,张洪珍
(河北省人民医院,河北 石家庄 050051)

目的 探讨晚期非小细胞肺癌患者血中T细胞亚群、CD4+CD25+调解性T细胞(Treg)及免疫球蛋白的改变,观察康莱特注射液(KLT)联合化疗对晚期非小细胞肺癌患者免疫功能的影响。方法 将68例晚期非小细胞肺癌患者随机分为2组,对照组应用多西他赛、顺铂联合化疗,不予康莱特及其他提高免疫力的治疗措施;治疗组同时给予康莱特注射液200 mL静点,连用14 d。2组均以21 d为1个周期,2个周期后评价T细胞亚群及免疫球蛋白的变化情况。另选30例健康人作为正常对照组。结果 化疗前对照组及治疗组患者T细胞亚群CD3+、CD4+、CD8+比例及CD4+CD25+Treg与正常对照组比较差异有统计学意义(P均<0.05)。化疗后对照组免疫球蛋白、CD3+、CD4+、CD8+、CD4+/CD8+比值及治疗组CD4+CD25+Treg与化疗前比较差异有统计学意义(P均<0.05)。化疗后对照组与治疗组CD3+、CD4+、CD8+及CD4+/CD8+比值、IgG比较差异有统计学意义(P均<0.05)。结论 康莱特注射液可保护晚期非小细胞肺癌患者的免疫功能,降低免疫耐受。
非小细胞肺癌;康莱特注射液;免疫功能;免疫耐受;化疗
肺癌是我国及世界范围内最常见也是恶性程度最高的恶性肿瘤之一,在我国,每年有将近50万的新发肺癌患者,其中非小细胞肺癌占肺癌的80%~85%。免疫功能低下和免疫耐受是恶性肿瘤转移和复发的重要原因之一,目前临床上常规的治疗手段如手术、化疗或放疗使多数患者治疗后的免疫力下降,不能耐受继续治疗,影响生活质量,因此晚期肺癌化疗患者的免疫治疗得到广泛关注。笔者观察了康莱特注射液联合多西他赛、顺铂治疗晚期非小细胞肺癌的疗效,以及对患者免疫功能的影响,现将结果报道如下。
1 临床资料
1.1 一般资料 选择2009年6月—2012年6月入住我院的ⅢB~Ⅳ期非小细胞肺癌患者68例,均为不能手术或远处转移患者,均经病理学证实,其中腺癌46例,鳞癌17例,其他5例;预计生存期≥3 个月,KPS评分≥80 分;血常规、肝肾功能和心电图基本正常。将68例患者随机分为2组:治疗组34例,男20例,女14例;年龄(63.88±1.99)岁。对照组34例,男22例,女12例;年龄(64.29±2.07)岁。2组患者一般资料比较差异无统计学意义。另选择同期性别、年龄与患者匹配的30例正常健康人作为正常对照组,男18例,女12例;年龄(63.14±1.48)岁。
1.2 治疗方法 对照组单纯采用化疗药物治疗:多西他赛85 mg/m2,第1天,顺铂25 mg/m2,第1—3天,21 d为1个周期,治疗期间不应用免疫药物。治疗组在化疗的基础上联合应用康莱特注射液200 mL静点,1次/d,从化疗前1 d开始连用2周,21 d为1个周期,共治疗2个周期。
1.3 观察指标 治疗前1 d及治疗2个周期后1周使用流式细胞仪检测淋巴细胞免疫分型(包括T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+、CD4+CD25+Treg),使用免疫比浊法检测免疫球蛋白(IgA、IgG、IgM);此外,还检测血常规、生化等一般指标。
1.4 检测方法
1.4.1 外周血T淋巴细胞亚群及Treg检测方法 采用免疫荧光标记全血溶血法,将新鲜的肝素抗凝的待测血浆25 μL加入流式试管内,加单抗5 μL,混匀后于室温下避光15 min,加溶血素125 μL混匀后室温避光10 min,上机检测。流式细胞仪测定淋巴细胞表面各种荧光素的荧光强度,荧光强度以二维 dot-plot 散点图储存于电脑中。自动分析结合某一单抗的阳性细胞个数和百分比,得到T淋巴细胞各亚群的百分数,在FITC-CD4/PE-CD25双参数图上计算得到CD4+CD25+Treg的百分数。主要试剂及仪器:CD3-PC5单克隆抗体、CD4-FITC单克隆抗体、CD8-PE单克隆抗体、CD25-PE单克隆抗体均购自美国贝克曼库尔特有限公司BeckmanCoulter,流式细胞仪型号:Beckman Coulter EpicsXL。
1.4.2 外周血免疫球蛋白检测方法 应用免疫比浊法,将抗人免疫球蛋白抗体与待测血中免疫球蛋白相结合,利用动力学原理观察单位时间内抗原与抗体结合的量来测定其浓度。应用Beckman公司的Immage特种蛋白分析仪上机检测,运行软件进行样品测定分析。IgG、IgA、IgM试剂均采用贝克曼公司专用试剂盒。
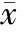
2 结 果
2.1 各组T淋巴细胞亚群比较 化疗前对照组及治疗组T细胞亚群CD3+、CD4+比例均低于正常对照组(P均<0.05),CD4+/CD8+比值低于正常对照组但差异无统计学意义(P>0.05),CD8+比例、CD4+CD25+Treg均高于正常对照组(P均<0.05)。化疗后治疗组与对照组T细胞亚群CD3+、CD4+比例,CD4+/CD8+比值均较治疗前降低(P均<0.05),且2组化疗后比较差异均有统计学意义(P均<0.05)。化疗后对照组CD8+比例较前明显升高(P<0.05),治疗组升高不明显(P>0.05)。化疗后,治疗组CD4+CD25+Treg明显降低(P<0.05),对照组虽有降低,但治疗前后比较差异无统计学意义(P>0.05),且2组治疗后比较差异无统计学意义(P>0.05)。见表1。
2.2 各组血清IgG、IgA、IgM比较 化疗前治疗组及对照组免疫球蛋白IgG水平较正常对照组略低,IgA较正常对照组略高,IgM对照组略高于正常对照组、治疗组略低于正常对照组,但均无显著性差异(P均>0.05)。化疗后,对照组免疫球蛋白IgG、IgA、IgM较化疗前均降低(P均<0.05);治疗组免疫球蛋白IgG、IgA、IgM水平较化疗前均降低,但无显著性差异(P均>0.05)。化疗后对照组免疫球蛋白IgG水平低于治疗组(P<0.05)。见表2。
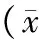
表1 各组外周血T淋巴细胞亚群测定结果比较±s)
注:①与正常对照组比较,P<0.05;②与化疗前比较,P<0.05;③与治疗组比较,P<0.05。
3 讨 论
由于肺癌起病隐匿,大部分患者确诊时已达晚期,失去手术机会,化疗是晚期肺癌主要的治疗手段之一。但化疗在杀伤大量肿瘤细胞、减轻瘤负荷的同时又对机体免疫系统、骨髓造血系统等造成破坏,而免疫功能下降进一步影响肺癌的预后及患者的依从性,因此,在肺癌化疗的同时,应用具有抗癌、低毒、保护机体免疫功能的药物意义重大。
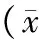
表2 各组外周血免疫球蛋白测定结果比较±s,mg/L)
注:①与化疗前比较,P<0.05;②与治疗组比较,P<0.05。
薏苡仁是禾本科植物的成熟种仁,性甘、淡、微寒,归脾、胃、肺经,具有渗湿利水、健脾止泻、舒筋、清热排脓之功效。康莱特注射液(KLT)是薏苡仁提取物,主要成分为薏苡仁油,是抗肿瘤制剂。康莱特具有诱导肿瘤细胞凋亡,阻滞肿瘤细胞有丝分裂,逆转肿瘤细胞多药耐受性(MDR),杀伤癌细胞,激活NK细胞和IL- 2的活性,促进巨噬细胞吞噬功能及脾淋巴细胞的增殖,显著提高机体免疫力的功能[2],配合放化疗还可增效减毒,缓解疼痛,稳定病情,抗癌症恶病质,提高癌症患者的生活质量[3],并在预防肿瘤的复发、转移中具有重要的意义。张爱琴等[4]通过测定Lewis肺癌小鼠外周血中TNF-α、IL-1、IL-6 的活性,探讨康莱特注射液在抗肿瘤的同时对机体免疫功能的影响,结果显示康莱特注射液不仅有杀灭肿瘤细胞作用,而且对机体的免疫器官及免疫功能也具有保护作用。吴岩等[5]的研究也显示康莱特注射液在抗肿瘤的同时能通过提高T细胞增殖活力,调节IL-2、NF-κB等因子的表达,达到增强机体免疫功能的目的。
随着肿瘤免疫学及分子生物学的不断发展,人们逐渐认识到,恶性肿瘤的发生、发展、转移和复发与机体的免疫功能缺陷有关,尤其与细胞免疫功能抑制有关[6]。抗肿瘤免疫以细胞免疫为主,体液免疫起一定协同作用[7]。T 淋巴细胞来源于骨髓淋巴样干细胞,在胸腺中发育成熟后进入外周血液循环,约占外周血淋巴细胞的70%,是免疫应答最为重要的参与者,主要执行细胞免疫的功能,在杀伤靶细胞、免疫调节及免疫监视方面具有极其重要的作用[8]。T 细胞在发育的不同阶段,细胞膜上均表达一些相对稳定的分子标记,从而成为鉴定及分离 T 淋巴细胞亚群的重要依据。依据白细胞分化抗原的表达可大致将外周血成熟的T淋巴细胞(CD3+T)分为 CD4+T 淋巴细胞和CD8+T淋巴细胞。CD4+T淋巴细胞识别MHCⅡ类分子所提呈的外源性抗原肽,活化后主要分化为辅助性T淋巴细胞(Th),具有直接杀伤肿瘤细胞及免疫记忆功能,在细胞免疫中起重要作用;而CD8+T淋巴细胞,它识别MHCⅠ类分子所提呈的内源性抗原肽,活化后主要分化为细胞毒性T淋巴细胞(CTL)等,主要介导体液免疫。两者相互协调、相互制约而共同参与对免疫应答的调节作用[9]。CD4+/CD8+比值反映宿主免疫调节的平衡,其比值降低表明细胞免疫功能低下[10]。CD4+CD25+Treg是目前已知的人体内功能最为强大的具有免疫抑制功能的CD4+T细胞亚群,在诱导机体免疫耐受中发挥关键作用[11],于1995年首次由Sakaguchi等[12]提出。CD4+CD25+Treg细胞主要通过抑制性调节CD8+T细胞和CD4+T细胞的辅助性作用,包括抗原提呈细胞(APC)和B细胞在内的整个免疫系统的应答;但是,其抑制作用只限于活化后的效应细胞。Treg 抑制机体细胞免疫功能的机制主要包括4个途径:①分泌TGF-β、IL-10等多种抑制性细胞因子的途径。②通过颗粒蛋白酶A、B及穿孔素等杀死靶细胞。③破坏细胞代谢影响效应细胞的功能:通过细胞间的缝隙连接将抑制性的第二信使 cAMP 导入效应T细胞,干扰效应T细胞的代谢;通过消耗 IL-2使效应T细胞生长受抑制乃至凋亡;产生CD39及CD73引起细胞微环境中腺苷增加,继而活化效应T细胞表面的腺苷受体A2A,发挥抑制功能。④调节树突状细胞功能的途径:Treg可通过自身表达的免疫抑制性分子影响树突状细胞的功能,而这些树突状细胞又能进一步促进Treg的分化和增殖[13]。因此,Treg在肿瘤的发生与发展中起了很重要的作用。
免疫球蛋白识别并特异性结合抗原发挥免疫效应,对体液免疫应答起主要作用。免疫球蛋白主要分布在体内血清中或外分泌物中,测定其含量有助于了解人体的体液免疫功能,对临床的诊治有一定的指导意义。人类免疫球蛋白一般分为IgG、IgA、IgM、IgD、IgE 5种, 由于IgD、IgE含量甚微,故测定免疫球蛋白主要是以IgG、IgA、IgM为主。IgG约占血清免疫球蛋白总量的75%,是正常人血清中含量最多的一种免疫球蛋白,在特异性免疫中起重要作用;IgM主要分布在血液中,约占血清总免疫球蛋白的10%,也参与某些自身免疫病和Ⅱ、Ⅲ型超敏反应的病理过程。IgM和IgA在抗感染中都有重要作用,通常免疫球蛋白含量过高或过低均对人体不利[14]。
本研究结果显示,治疗组及对照组化疗前CD3+、CD4+比例,CD4+/CD8+比值均低于正常对照组,IgG、IgA、IgM含量较正常对照组无明显变化,CD8+、CD4+CD25+Treg水平高于正常对照组。可能与晚期肿瘤患者本身存在的免疫抑制状态有关。对照组化疗后CD3+、CD4+比例,CD4+/CD8+比值,IgG、IgA、IgM含量均明显低于化疗前;而CD3+、CD4+比例,IgG、IgA、IgM等含量的变化在治疗组不明显,这与张斌等[15]的研究结果相近,即单纯化疗组化疗后大部分的细胞免疫和体液免疫功能指标明显降低,康莱特联合化疗组化疗后大部分的细胞免疫及体液免疫功能指标无明显变化。表明康莱特的联合应用减轻了化疗对机体免疫系统的损伤,对晚期非小细胞肺癌化疗患者细胞免疫及体液免疫功能均有保护作用。而CD4+CD25+Treg在治疗组及对照组化疗后均有下降趋势,治疗组降低趋势更明显,表明康莱特联合应用有降低免疫耐受的趋势,其有关机制有待于基础实验进一步探讨。
[1] 孙燕,石远凯. 临床肿瘤内科手册[M]. 北京:人民卫生出版社,2007:418
[2] 王云杰,黄立军,张志培,等. 康莱特治疗原性肺癌的临床研究[J]. 现代肿瘤医学,2006,14(1):36-37
[3] 魏智勇,韩旭鹤. 康莱特注射液的药理作用与临床评价[J]. 中草药,2009,40(7):1166-1168
[4] 张爱琴,马胜林,孙在典,等. 康莱特注射液对Lewis肺癌小鼠免疫功能的影响[J]. 浙江中西医结合杂志,2007,17(4):199-200
[5] 吴岩,潘沛,王彧杰,等. 康莱特注射液对Lewis肺癌小鼠免疫功能的影响[J]. 上海交通大学学报:医学版,2009,29(12):1455-1458[6] Lukaszewicz M,Mroczko B,Szmitkski M. Clinical sign if cance of interleukin-6(IL-6) as a prognostic factor of cancer disease[J]. PolArch Med Wewn,2007,117(5/6):247-251
[7] 陈慰峰. 医学免疫学[M]. 北京:人民卫生出版社,2006:220-228
[8] 程超群,刘涛. 变应性鼻炎中调节性T细胞和Bcl-6的研究进展[J]. 中国医药指南,2012,10(27):447
[9] Wang XY,Kazim L. Immunization with tumor-derived ER chaperone grp170 elicits tumor-specific CD8+T-cell responses and reduces pulmonary metastatic disease[J]. Int J Cancer,2003,105(2):26-231
[10] Nishikawa H,Kato T,TawaraIsao,et al. IFN-γ controls the generation/activation of CD4+CD25+regulatory T cells in antitum or immune response[J]. Immunol,2005,175(7):4433-4440
[11] Seidel MG,Ernst U,Printz D,et al. Expression of the putatively Regulatory T-cell marker FOXP3 by CD4+CD25+T cells after pediatric hematopoietic stem cell transplatition[J]. Haematologica,2006,91(4):566-569
[12] Sakaguchi S,Sakaguchi N,AsanoM,et al. Immunologic selftolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of selftolerance causes various autoimmune diseases[J]. J Immunol,1995,155(3):1151-1164
[13] 于益芝,曹雪涛. 调节性T细胞在肿瘤免疫和肿瘤免疫治疗中的作用[J]. 中国肿瘤生物治疗杂志,2010,17(1):1-6
[14] 王耿新,张美莲,陈传刚,等. 786例恶性肿瘤患者免疫球蛋白检测结果分析[J]. 华中医学杂志,2005,29(4):302-303
[15] 张斌,吴勉华. 益气养阴中药联合化疗对中晚期非小细胞肺癌免疫功能的影响[J]. 吉林中医药,2013,33(3):259-261
Regulatory effect of Kanglaite Injection on immune function in patients with non small cell lung cancer treated with chemotherapy
Deng Xinna,Zhao Shufang,Zhao Haijing,Yan Yonglong, He Liya, Zhang Hongzhen
(Hebei General Hospital,Shijiazhuang 050051, Hebei, China)
Objective It is to explore the changes of T cell subsets and CD4+CD25+Treg cells and immunoglobulin in blood of patients with advanced non small cell lung cancer, and to observe the influence of Kanglaite injection (KLT)combined with chemotherapy on immune function of these patients. Methods 68 cases of patients with advanced non small cell lung cancer were randomly divided into 2 groups, the control group was treated with docetaxel combined with sisplatin, and was not given KLT or other therapy which could improve immune function, and the treatment group was treated with KLT 200 mL by drip intravenous infusion for 14 days on the basis of control group's treatment. 21 days was one treatment cycles, after two cycles, the changes of T cell subsets and immunoglobulin were observed. 30 cases of healthy people were selected as normal control group. Results Compared with that before chemotherapy in normal control group, the differences in the levels of T cell subsets CD3+, CD4+, CD8+, CD4+/CD8+and the levels of CD4+CD25+Treg cell were significant in treatment group and control group (Pall<0.05). After chemotherapy the differences in immunoglobulin and T cell subsets of CD3+, CD4+, CD8+, CD4+/CD8+in control group and CD4+CD25+Treg in treatment group after treatment were significant (Pall<0.05). There were significant differences in CD3+, CD4+, CD8+, CD4+/CD8+and IgG between control group and treatment group after chemotherapy(P<0.05). Conclusion Kanglaite injection can protect immune function in patients with advanced non small cell lung cancer and reduce the immune tolerance.
non small cell lung cancer;Kanglaite;immune function; immune tolerance; chemotherapy
邓新娜,女,主治医师,硕士,从事肿瘤的综合治疗。
张洪珍,E-mail:dengxinna@sina.com
河北省中医药管理局资助项目(2013031)
10.3969/j.issn.1008-8849.2014.34.002
R734.2
A
1008-8849(2014)34-3767-04
2014-03-05

