GSTP1 A313G多态性与儿童急性淋巴细胞白血病无关联
——基于9篇病例对照研究的Meta分析
任艳飞 岳丽杰
·论著·
GSTP1 A313G多态性与儿童急性淋巴细胞白血病无关联
——基于9篇病例对照研究的Meta分析
任艳飞 岳丽杰
目的 对GSTP1 A313G位点AG、GG、AG+GG基因型和G等位基因与儿童急性淋巴细胞白血病(ALL)关联性进行Meta分析。方法 检索PubMed、EMBASE、OVID、中国生物医学文献数据库、中国知网和万方数据库(2000年1月至2014年6月)中的文献,收集GSTP1 A313G多态性与儿童ALL关联性的病例对照研究,应用RevMan 5.3软件和Stata 12.0软件进行Meta分析,统计合并OR值及其95%CI。结果 符合本文Meta分析纳入标准的文献有10篇,其中9篇文献具同质性(病例组1 476例,对照组1 905例)。Meta分析结果显示,GSTP1 A313G位点AG、GG、AG+GG基因型与儿童ALL发病风险无关联(AG基因型:OR=1.07,95%CI:0.93~1.24,P=0.35;GG基因型:OR=1.12,95%CI:0.86~1.45,P=0.41;AG+GG基因型:OR=1.08,95%CI:0.94~1.24,P=0.28),G等位基因与儿童ALL发病风险亦无关联性(OR=1.11,95%CI:0.96~1.28,P=0.16)。按种族、对照组来源、基因分型方法和样本量大小行分层分析,显示GSTP1 A313G位点上述基因型和等位基因与儿童ALL发病无关联。结论GSTP1 A313G位点多态性与儿童ALL发病风险无关联。
谷胱甘肽转移酶P1; 急性淋巴细胞白血病; 多态性; Meta分析; 儿童
急性淋巴细胞白血病(ALL)是儿童最常见的一类恶性肿瘤性疾病,具有一定的种族遗传倾向。目前对ALL发病机制仍不十分清楚,有观点认为ALL发生危险性可能与某些参与异源性物质代谢的酶类有关,如Ⅱ相代谢酶超家族中的谷胱甘肽转移酶(GSTs)[1]。GSTs是一类复杂且分布广泛的酶类超家族,可与内源亲水性底物如谷胱甘肽、鸟苷二磷酸葡糖醛酸及甘氨酸结合,而发挥解毒作用,是机体抵抗毒性物质的关键。其中,编码谷胱甘肽转移酶P1(GSTP1)基因的A313G多态性位点(NCBI dbSNP:rs1695),在氨基酸水平上发生105位氨基酸置换(Ile105Val),进而改变GSTP1催化活性[2]。目前已有研究表明,GSTP1 A313G多态性在肿瘤发生危险性中发挥着关键作用[3]。然而,国内外文献中关于GSTP1 A313G多态性与儿童ALL关联性的研究数据仍存在较大差异[4],这可能与各研究纳入样本量、种族以及多态性筛查手段不同有关,目前尚缺乏发表文献的汇总分析报道。因此,本研究将采用Meta分析方法评估GSTP1 A313G多态性与儿童ALL的关联。
1 方法
1.1 纳入标准 ①公开发表的GSTP1 A313G多态性与儿童ALL关系的文献;②研究设计为病例对照研究;③语种为中文或英文;④研究对象种族不限;⑤ALL组和对照组年龄≤18岁;⑥纳入文献中应包括研究设计、样本量、种族来源、GSTP1 A313G位点各基因型和等位基因频率。
1.2 排除标准 ①ALL组和对照组基因型分布分别行Hardy-Weinberg平衡检验,以验证研究人群具有群体代表性,对不符合该平衡的文献予以剔除;②重复文献予以剔除。
1.3 文献检索策略
1.3.1 数据库 PubMed、EMBASE和OVID数据库;中国生物医学文献数据库、中国知网和万方数据库。文献检索起止时间为建库至2014年6月30日。并回溯检索到的相关综述和Meta分析中的参考文献。
1.3.2 检索式 中文检索式:谷胱甘肽转移酶P1或GSTP1或GSTpi和基因多态性和急性淋巴细胞白血病或ALL和儿童或小儿;英文检索式:(glutathione S-transferase P1 OR GSTP1 OR GSTpi) AND (genetic polymorphism) AND (acute lymphoblastic leukemia OR ALL) AND (children OR childhood)。
1.4 文献筛选与资料提取 由任艳飞根据纳入和排除标准进行文献筛选和提取数据,包括作者、发表时间、国家、种族、样本数、样本来源、实验方法、ALL组和对照组中GSTP1 A313G位点各基因型(AA、AG、GG)和等位基因(G)的样本例数,并对纳入文献行Hardy-Weinberg平衡检验。遇到不确定的问题与岳丽杰讨论决定。
1.5 文献质量评价 由任艳飞参照NHI-NHGRI研究工作组2007年制定的遗传关联性研究报告规范[5]中的14条标准进行质量评价。每条标准以“是”(满足标准)、“否”(不满足标准)和“不清楚”(文献未描述)进行评价。如遇不确定的问题与岳丽杰讨论决定。
1.6 统计学方法 对纳入文献中ALL组和对照组行χ2检验,P>0.05为符合Hardy-Weinberg平衡检验。应用RevMan 5.3软件对各文献进行异质性分析,统计学上无异质性(P≥0.05),采用固定效应模型合并分析;存在异质性(P<0.05),则采用随机效应模型合并分析。I2=0为文献间无异质性,~25%为存在低度异质性,I2~50%为中度异质性,>50%为高度异质性。采用分层分析法和对应效应模型替换方法进行敏感性分析。分别对GSTP1 A313G位点AG、GG、AG+GG基因型和G等位基因与儿童ALL关联进行Meta分析,计算合并比值比(OR)及其95%CI,P<0.05为差异有统计学意义。当纳入文献数>20篇时,行Begg's秩相关法和Egger's回归法评估发表偏倚[6],当纳入文献<20篇时行剪补法评估发表偏倚。采用Stata 12.0软件进行剪补法分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 共检索到相关文献27篇(英文24篇,中文3篇)。文献筛选流程如图1所示,10篇文献[7~16]进入Meta分析(英文9篇,中文1篇)。表1显示:10篇文献均发表在2002至2011年;来自10个国家;7篇文献以高加索人为对象,3篇以亚洲人为对象;对照组8篇以人群为基础,2篇以医院为基础。基因分型方法包括限制性片段长度多态性聚合酶链式反应(PCR-RFLP)、等位基因特异性聚合酶链式反应(AS-PCR)、聚合酶链式反应等位基因特异性寡核苷酸杂交法(PCR-ASO)、实时荧光定量聚合酶链式反应(RQ-PCR)。纳入分析的10篇文献中,ALL组1 556例,对照组1 990例;表2为10篇文献GSTP1 A313G位点各基因型和等位基因分布情况,10篇文献数据分布均符合Hardy-Weinberg平衡(P>0.05)。

图1 文献筛选流程图
Fig 1 Flow chart of aricle screening and selection process
2.2 文献质量评价 图2显示,10篇纳入文献均未进行把握度的计算、均未采用其他或相同方法重复基因型检测、均未描述是否采用盲法进行结果评价、均未进行多重检验校正和协变量调整、均未进行重复性和功能验证性实验;10篇纳入文献的ALL组和对照组均来自同一人群、均描述了ALL组人口学及临床信息,均进行了危险因素分析 ;6篇文献[7,10~12,14,16]进行了连锁不平衡分析;文献[10,13]给出了多态性的鉴定序列;除文献[1]外均进行Hardy-Weinberg平衡检验;除文献[15]外均进行了人群分层分析。
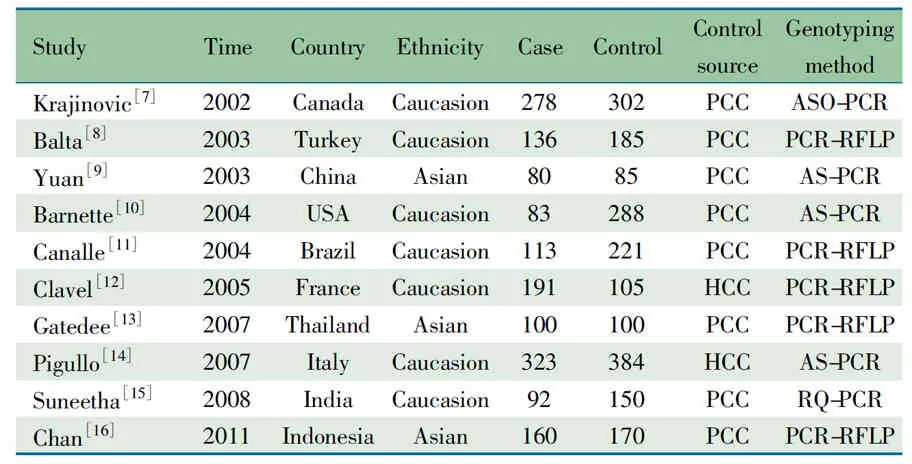
表1 纳入10篇文献一般情况
Notes HWE: Hardy-Weinberg equilibrium

表2 GSTP1 A313G位点各基因型和等位基因频数

图2 纳入10篇文献的质量评估结果
Fig 2 Quality of 10 included studies
Notes 1: power; 2: control characterization; 3: case characterization; 4: LD exploration; 5: polymorphism identification; 6: genotyping error check; 7: Hardy-Weinberg equilibrium; 8: blinding; 9: multiple testing; 10: covariate adjustment; 11: risks; 12: population stratification adjustment; 13: replication; 14: functional study
2.3 异质性分析 对纳入的10篇文献GSTP1 A313G位点各基因型和等位基因分别进行异质性分析(表3),发现G等位基因表现出低异质性(I2=19%),Galbraith图(图3)显示文献[9]不在回归直线内部,说明文献[9]存在异质性,剔除文献[9]后再行异质性分析,各基因型和等位基因I2=0,各文献间异质性消除,采用固定效应模型进行Meta分析。
表3 文献间的异质性分析
Tab 3 Hetergeneity analysis of included studies

Polymor-phismI2/%χ2dfPModelAllstudiesAG49.3780.40RandomGG04.4080.88RandomAG+GG39.2580.41RandomG1911.1680.26RandomRemovalofstudy[9]AG03.8980.87RandomGG02.2380.97RandomAG+GG02.8580.94RandomG02.7580.95Random
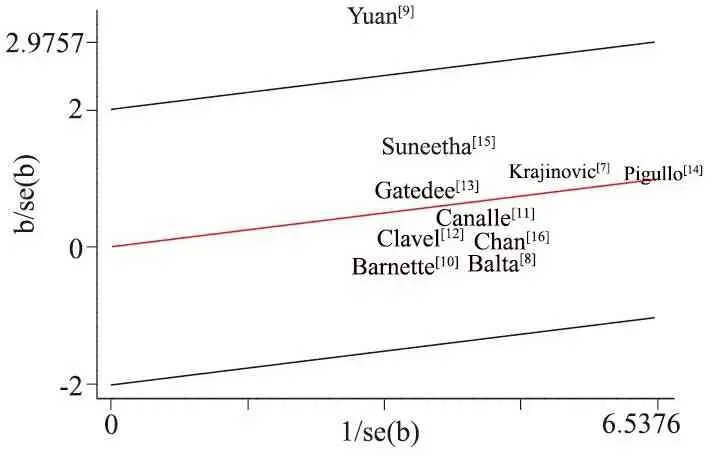
图3 异质性分析Galbraith图
Fig 3Galbraith plot for hetergeneity analysis
Notes Red line represented fitted values
2.4GSTP1 A313G多态性与儿童ALL易感性 Meta分析结果显示,AG基因型文献合并OR=1.07(95%CI:0.93~1.24),P=0.35(图4);GG基因型文献合并OR=1.12(95%CI:0.86~1.45),P=0.41(图5);AG+GG基因型文献合并OR=1.08(95%CI:0.94~1.24),P=0.28(图6);G等位基因文献合并OR=1.11(95%CI:0.96~1.28),P=0.16(图7);提示GSTP1 A313G位点AG、GG、AG+GG基因型和G等位基因与儿童ALL发病风险无关联。
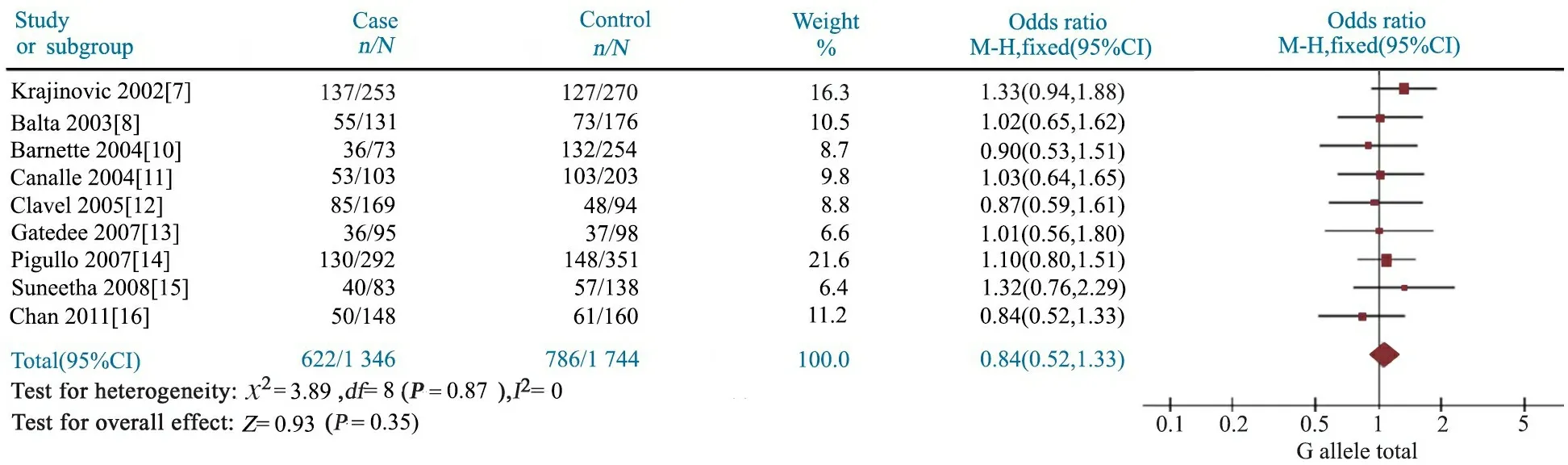
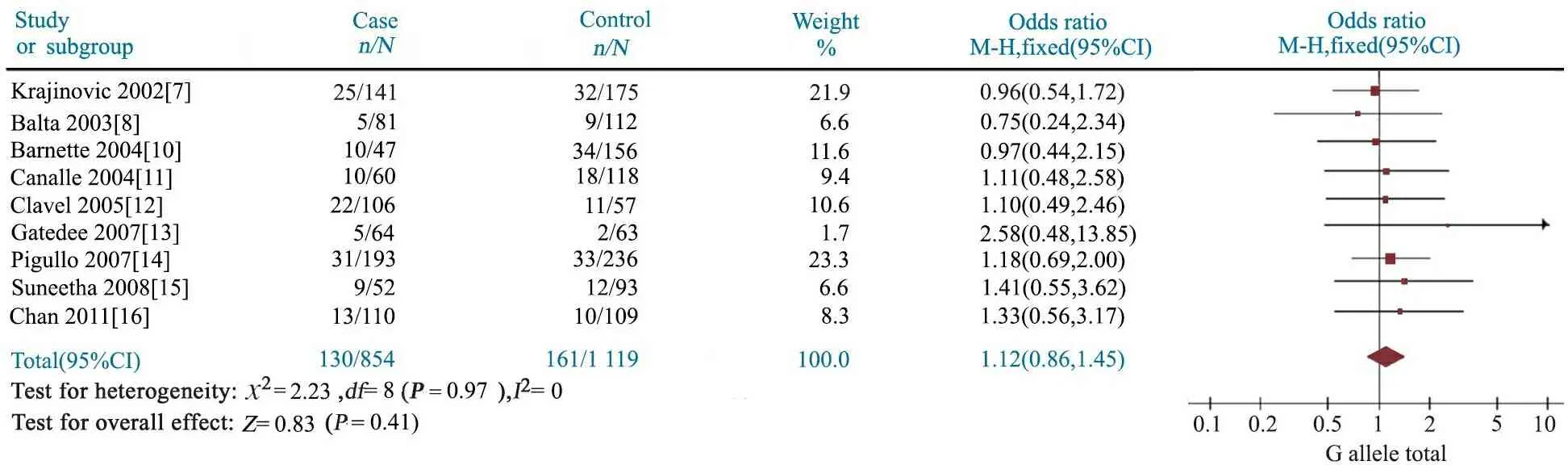
图4 GSTP1 A313G位点AG基因型与儿童急性淋巴细胞白血病关联性的Meta分析
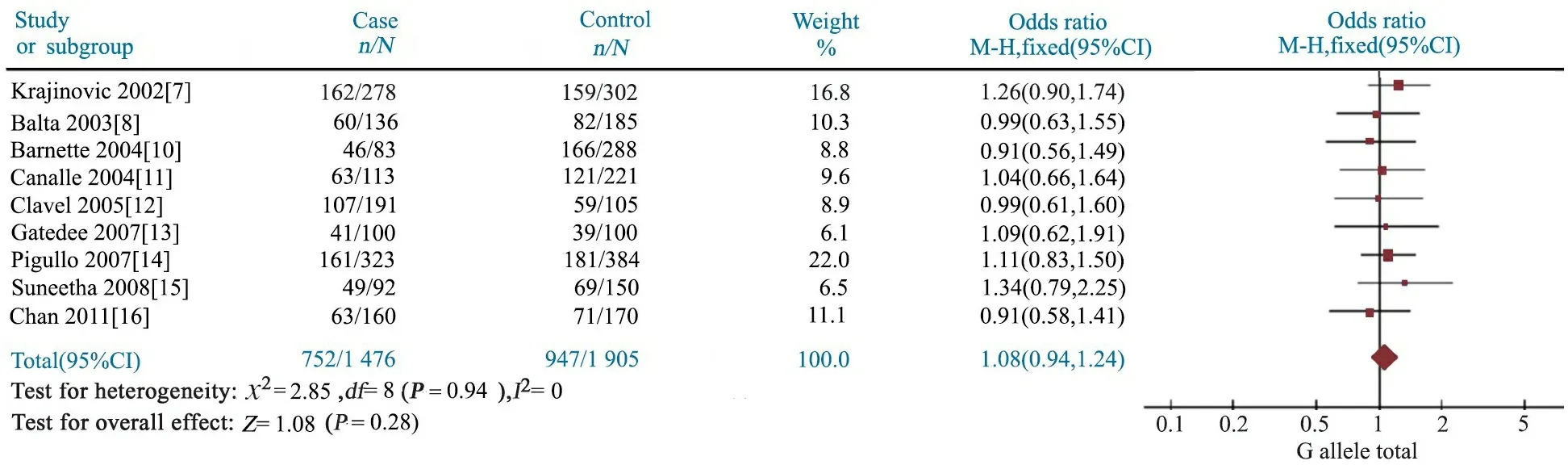
图5 GSTP1 A313G位点GG基因型与儿童ALL易感性的Meta分析
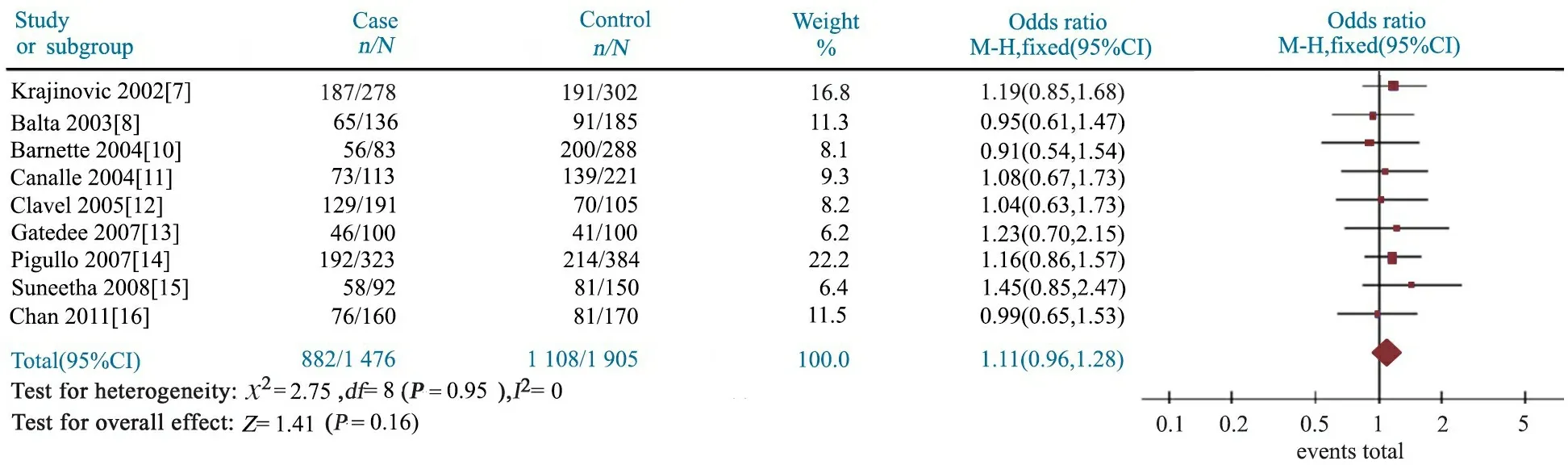
图6 GSTP1 A313G位点AG+GG基因型与儿童急性淋巴细胞白血病关联性的Meta分析
图7GSTP1 A313G位点G等位基因与儿童急性淋巴细胞白血病关联性的Meta分析
Fig 7 Meta-analysis of the relationship between G allele ofGSTP1 A313G and the susceptibility to childhood ALL
2.5 敏感性分析 利用随机效应模型分别对9篇[7,8,10~16]GSTP1 A313G多态性AG、GG、AG+GG基因型和G等位基因与儿童ALL关联性的文献进行合并分析,合并OR值(95%CI)分别为1.07(0.93~1.24)、1.12(0.86~1.45)、1.08(0.94~1.24)和1.11(0.96~1.28),P均>0.05,与固定效应模型结果一致,研究结果可靠。
儿童GSTP1 多态性差异性分布受多方面因素影响,为防止过低评价GSTP1 A313G多态性与儿童ALL的关联性,本文按种族、对照组来源、基因分型方法和样本量大小对各文献进行亚组分析,表4显示,GSTP1 A313G位点各基因型和G等位基因在不同亚组中均与儿童ALL发病风险无关(P均>0.05)。
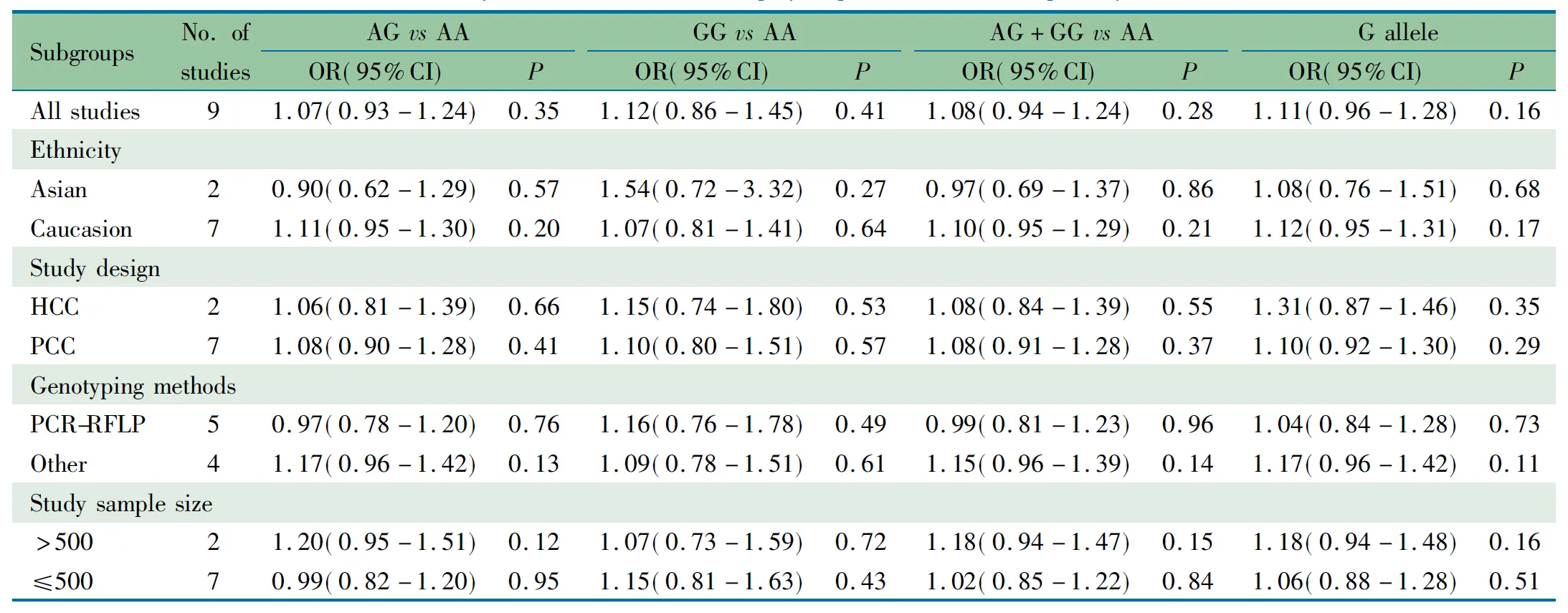
表4 GSTP1 A313G多态性与儿童急性淋巴细胞白血病关联性的分层分析
2.6 发表偏倚评估 采用剪补法行发表偏倚评估,GSTP1 A313G位点AG、AG+GG基因型和G等位基因剪补前logOR值分别为0.07、0.08和0.10,95%CI均为0.08~0.22,剪补前后的logOR值和95%CI一致,无需补充研究数目,表明结果稳定(表5,图8A、C、D)。GSTP1 A313G位点GG基因型剪补前logOR值为0.11,95%CI为0.15~0.37,剪补后logOR值变为0.09,95%CI变为0.17~0.35,剪补前后95%CI均无统计学意义,提示结果稳定;补充1个点,消除发表偏倚的影响后漏斗图中心位置左移(表5,图8B)。
图8GSTP1 A313G多态性与儿童急性淋巴细胞白血病关联性发表偏倚的剪补法漏斗图
Fig 8 Funnel plot for publication bias of the association betweenGSTP1 A313G polymorphism and the susceptibility to childhood ALL by trim and fill method
Notes A: publication bias of the relationship between 313AG genotype and childhood ALL; B: publication bias of the relationship between 313GG genotype and childhood ALL(square for the trim number); C: publication bias of the relationship between 313AG+GG genotype and childhood ALL; D: publication bias of the relationship between 313G allele and childhood ALL
表5GSTP1 A313G多态性与儿童急性淋巴细胞白血病关联性发表偏倚(剪补法)
Tab 5 Publication bias of the association betweenGSTP1 A313G polymorphism and the susceptibility to childhood ALL (trim and fill method)
3 讨论
Perera等[17]的研究表明,儿童相对于成人体内代谢途径仍未成熟且多数细胞处于分裂和生长状态,使其极易受外界毒性物质的影响而诱导突发各种肿瘤类疾病。其中最常见的一类恶性肿瘤性疾病即为ALL。目前研究发现[18],儿童ALL发病机制不仅受环境因素的影响而且遗传因素也起着至关重要的作用,特别是体内各类外源性物质代谢酶的遗传多态性在探究儿童ALL发病风险方面具有肯定意义。目前为止国内外已有大量关于Ⅰ相解毒代谢酶(细胞色素氧化酶类、EPHX1、XRCC1、RFC1等)和Ⅱ相解毒代谢酶(GSTP1、GSTM、GSTT、GSTA等)基因多态性与儿童ALL发病风险相关性的研究报道[19, 20]。然而,单独一项研究往往因样本量太少或研究范围局限等,很难得出一个明确或更具普遍意义的结论,因此,对同质性好的研究采用Meta分析的方法可提高结论的可靠性。
纳入的10篇关于GSTP1多态性与儿童ALL关联性的病例对照研究中,剔除存在异质性的1篇文献[9],以遗传关联性研究报告规范中的14条标准进行质量评价,表明9篇文献质量中等偏下。进入分析的ALL组1 476例,对照组1 905例,且均采用较成熟的基因分型方法,表明本Meta分析结论较任意单个研究的结论更可靠。Meta分析常受到多种混杂因素的影响,如对照组群体来源、基因的种族差异性以及基因型检测方法等。为消除混杂因素对统计结果的干扰,本研究将纳入文献按种族来源、对照组来源、基因分型和样本量大小不同进行亚组分类,结果显示在不同亚组中GSTP1 A313G位点的各基因型和等位基因均与儿童ALL无明显关联性(P均>0.05),证实本研究结果可靠。除此之外,Meta分析中最重要的2个环节就是异质性分析和发表偏倚评估。纳入的10篇文献中文献[9]表现出明显异质性,这可能与某些不可控混杂因素和遗传选择性偏倚有关。另外,病例对照研究中样本量的大小在预测基因型和肿瘤发病风险关系中也起着重要作用,当研究样本量过少可能会过高评估两者间的相关性。
Meta分析结果显示,GSTP1 A313G位点AG、GG、AG+GG基因型及G等位基因均与儿童ALL发病风险无关,Vijayakrishnan[20]和Huang[21]等的Meta分析结果一致。晚近研究[22]发现异源性物质代谢酶的基因多态性在儿童ALL发生危险中存在性别调节效应,即不同性别儿童的代谢酶遗传多态性对ALL易感性的影响不同,已报道过的异源性物质代谢酶基因有NQO1、MTHFR、GSTM1和GSTT1等。然而,导致儿童ALL中男孩的发生概率高于女孩40%的原因仍不清楚,并且与之相关的研究报道也较少[23]。本研究仅文献[10]对GSTP1 A313G多态性进行了性别差异性研究,结果显示GSTP1 A313G位点AG基因型可降低女孩ALL发病风险(OR=0.43,P=0.031),这可能与雌激素受体上调抗氧化应激调节基因(包括GSTP1)有关[24]。
本研究的局限性:①纳入文献以高加索人种为主,仅2篇文献为亚洲人群,缺乏来自于其他种族人群的报道,容易造成研究结果发表偏倚;②纳入的文献均为已发表文献,未检索未发表文献,可能导致发表偏倚;③由于纳入文献仅有1篇报道了不同性别儿童GSTP1多态性对ALL的影响,故无法分析性别在GSTP1多态性与儿童ALL易感性中所起的作用。
本Meta分析结果提示GSTP1 A313G位点AG、GG、AG+GG基因型及G等位基因均与儿童ALL发病风险无关。
[1]Krajinovic M, Labuda D, Sinnett D. Childhood acute lymphoblastic leukemia: genetic determinants of susceptibility and disease outcome. Rev Environ Health, 2001, 16(4): 263-279
[2]Zimniak P, Nanduri B, Pikula S, et al. Naturally occurring human glutathione S-transferase GSTP1-1 isoforms with isoleucine and valine in position 104 differ in enzymic properties. Eur J Biochem / FEBS, 1994, 224(3): 893-899
[3]Di Pietro G, Magno LA, Rios-Santos F. Glutathione S-transferases: an overview in cancer research. Expert Opin Drug Metab & Toxicol, 2010, 6(2): 153-170
[4]Ye Z, Song H. Glutathione s-transferase polymorphisms (GSTM1, GSTP1 and GSTT1) and the risk of acute leukaemia: a systematic review and meta-analysis. Eur J Cancer, 2005, 41(7): 980-989
[5]Yang L(杨琳), Ding JJ, Zhou WH. Association between polymorphisms of UDP-glucuronosyltransferase 1A1 gene and hyperbilirubinemia in neonates: a meta-analysis. Chin J Evid Based Pediatr(中国循证儿科杂志), 2010, 5(5): 335-348
[6]Sterne JA, Egger M, Smith GD. Systematic reviews in health care: Investigating and dealing with publication and other biases in meta-analysis. BMJ, 2001, 323(7304): 101-105
[7]Krajinovic M, Labuda D, Sinnett D. Glutathione S-transferase P1 genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukaemia. Pharmacogenetics, 2002, 12(8): 655-658
[8]Balta G, Yuksek N, Ozyurek E, et al. Characterization of MTHFR, GSTM1, GSTT1, GSTP1, and CYP1A1 genotypes in childhood acute leukemia. Am J Hematol, 2003, 73(3): 154-160
[9]Yuan XJ(袁晓军), Gu LJ, Pan HL, et al. Analysis on GST-Pi genetic polymorphism in children with acute leukemia. Natl Med J China(中华医学杂志), 2003, 83(21): 27-30
[10]Barnette P, Scholl R, Blandford M, et al. High-throughput detection of glutathione s-transferase polymorphic alleles in a pediatric cancer population. Cancer Epidemiol Biomarkers Prev, 2004, 13(2): 304-313
[11]Canalle R, Burim RV, Tone LG, et al. Genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukemia. Environ Mol Mutagen, 2004, 43(2): 100-109
[12]Clavel J, Bellec S, Rebouissou S, et al. Childhood leukaemia, polymorphisms of metabolism enzyme genes, and interactions with maternal tobacco, coffee and alcohol consumption during pregnancy. Eur J Cancer Prev, 2005, 14(6): 531-540
[13]Gatedee J, Pakakassama S, Muangman S, et al. Glutathione S-transferase P1 genotypes, genetic susceptibility and outcome of therapy in thai childhood acute lymphoblastic leukemia. Asian Pac J Cancer Prev, 2007, 8(2): 294-296
[14]Pigullo S, Haupt R, Dufour C, et al. Are genotypes of glutathione S-transferase superfamily a risk factor for childhood acute lymphoblastic leukemia? Results of an Italian case-control study. Leukemia, 2007, 21(5): 1122-1124
[15]Suneetha KJ, Nancy KN, Rajalekshmy KR, et al. Role of GSTM1 (Present/Null) and GSTP1 (Ile105Val) polymorphisms in susceptibility to acute lymphoblastic leukemia among the South Indian population. Asian Pac J Cancer Prev, 2008, 9(4): 733-736
[16]Chan JY, Ugrasena DG, Lum DW, et al. Xenobiotic and folate pathway gene polymorphisms and risk of childhood acute lymphoblastic leukaemia in Javanese children. Hematol Oncol, 2011, 29(3): 116-123
[17]Perera FP. Environment and cancer: who are susceptible?. Science, 1997, 278(5340): 1068-1073
[18]Buffler PA, Kwan ML, Reynolds P, et al. Environmental and genetic risk factors for childhood leukemia: appraising the evidence. Can Invest, 2005, 23(1): 60-75
[19]Nousome D, Lupo PJ, Okcu MF, et al. Maternal and offspring xenobiotic metabolism haplotypes and the risk of childhood acute lymphoblastic leukemia. Leu Res, 2013, 37(5): 531-535
[20]Vijayakrishnan J, Houlston RS. Candidate gene association studies and risk of childhood acute lymphoblastic leukemia: a systematic review and meta-analysis. Haematologica, 2010, 95(8): 1405-1414
[21]Huang GZ, Shan W, Zeng L, et al. The GSTP1 A1578G polymorphism and the risk of childhood acute lymphoblastic leukemia: results from an updated meta-analysis. Genet Mol Res, 2013, 12(3): 2481-2491
[22]Yeoh AE, Lu Y, Chan JY, et al. Genetic susceptibility to childhood acute lymphoblastic leukemia shows protection in Malay boys: results from the Malaysia-Singapore ALL Study Group. Leu Res, 2010, 34(3): 276-283
[23]Cartwright RA, Gurney KA, Moorman AV. Sex ratios and the risks of haematological malignancies. Br J Haematol, 2002, 118(4): 1071-1077
[24]Montano MM, Deng H, Liu M, et al. Transcriptional regulation by the estrogen receptor of antioxidative stress enzymes and its functional implications. Oncogene, 2004, 23(14): 2442-2453
(本文编辑:张崇凡)
No association between GSTP1 A313G polymorphisms and the susceptibility to childhood acute lymphoblastic leukemia: a meta-analysis based on 9 case-control studies
RENYan-fei,YUELi-jie
(InstituteofPediatricsResearch,ShenzhenChildren'sHospitalofZunyiMedicalCollege,Shenzhen518026,China)
YUE Li-jie,E-mail:2376028869@qq.com
ObjectiveTo assess the relationship between AG, GG and AG+GG genotype and G allele of glutathione S-transferase pi (GSTP1) A313G polymorphisms and childhood acute lymphoblastic leukemia (ALL).Methods PubMed, EMBASE, OVID, China Bio-Medicine Database, China National Knowledge Infrastructure and Wanfang Chinese Periodical Database were searched for the case-control study on the association ofGSTP1 A313G polymorphisms with ALL from January 2000 to June 2014. According to the inclusion criteria, related articles were evaluated. Poor-quality studies were excluded. RevMan 5.3 software and Stata 12.0 software were applied for investigating the meta-analysis and calculating the pooled odds ratio (OR) and 95% confidence interval (CI).ResultsNine eligible studies were included with 1 476 childhood ALL cases and 1 905 controls. Overall, the variant genotypes AG, GG, AG+GG and G allele ofGSTP1 A313G polymorphisms had no association with childhood ALL risk (AG genotype: OR=1.07, 95%CI:0.93-1.24,P=0.35; GG genotype: OR=1.12, 95%CI:0.86-1.45,P=0.41; AG+GG genotype: OR=1.08, 95%CI: 0.94-1.24,P=0.28; G allele: OR=1.11, 95%CI: 0.96-1.28,P=0.16). Similarly, no significant associations were detected in any subgroups of race, source of control group, gene analysis method and sample size.ConclusionThe results suggested there was no association betweenGSTP1 A313G polymorphisms and childhood ALL.
Glutathione S-transferase pi; Acute lymphoblastic leukemia; Polymorphism; Meta analysis; Childhood
国家自然科学基金资助项目:30471830;深圳市科技计划重点项目:20110101
遵义医学院附属深圳市儿童医院,儿科研究所 深圳,518026
岳丽杰,E-mail:2376028869@qq.com
10.3969/j.issn.1673-5501.2014.05.001
2014-07-03
2014-08-20)

